
контр. раб. микробиология
.docx
55.Роль микроорганизма и условий внешней среды в возникновении и развитии инфекционного процесса.
79.Бруцеллез, характеристика. Морфологические, культуральные, биохимические и другие свойства микроба. Материал исследования. Лабораторная диагностика и специфическая профилактика.
88.Патогенные микобактерии. Возбудитель туберкулеза. Характеристика заболевания. Морфологические, культуральные, биохимические и другие свойства микроба. Материал исследования. Лабораторная диагностика и специфическая профилактика.
99.Микозы. Возбудитель эпизоотического лимфангоита, кандидамикоза. Морфологические, культуральные, биохимические и другие свойства микробов. Материал исследования. Лабораторная диагностика и специфическая профилактика.
55. Роль микроорганизма и условий внешней среды в возникновении и развитии инфекционного процесса.
Возникновение, развитие и исход инфекции зависят не только от вирулентности и количества попавших в организм патогенных микробов, ворот инфекции, но и от степени устойчивости организма генетически восприимчивого вида животных. Поэтому в явлениях инфекции роли макроорганизма и условий внешней среды, влияющих на его резистентность, следует уделять не меньше внимания, чем самому главному этиологическому фактору – возбудителю инфекции. Восприимчивость организма – это способность организма животного к заражению и последующему заболеванию в результате контакта с возбудителем инфекции. Являясь одним из основных факторов, определяющих возможность проявления патогенного действия микроба, восприимчивость как качественное состояние макроорганизма генетически детерминирована на уровне вида животных.
Состояние, обратное восприимчивости и отражающее потенциальные адаптационные способности животного организма противостоять патогенному действию возбудителя инфекции в конкретных условиях существования, называется устойчивостью (естественной резистентностью). Резистентность непосредственно связана с иммунореактивностью организма и как состояние определяется многими факторами самого организма (конституцией, полом, возрастом, видовыми анатомо-морфологическими особенностями, развитием иммунной системы и т. п.) и внешней среды (стрессоры, особенности кормления, размещения, эксплуатации и т. д.). Следовательно, одним из условий возникновения инфекционной болезни является необходимость проникновения патогенного микроба в генетически восприимчивый организм с ослабленной естественной резистентностью, который неспособен в достаточной мере проявить свои защитно-приспособительные функции и тем самым противостоять (сопротивляться) заражению. Если же патогенный микроб попадает в генетически восприимчивый организм, но с достаточной степенью устойчивости, инфекционная болезнь может не развиться.
Наличие реактивного взаимодействия между патогенным микробом и организмом животного восприимчивого вида является одной из элементарных предпосылок возникновения инфекционной болезни.
Однако нельзя признать, что для возникновения инфекционной болезни во всех случаях достаточно лишь наличия вирулентного возбудителя и восприимчивого к нему животного. Такая трактовка вопроса имеет свое значение при сравнительно немногих, остро протекающих инфекционных болезнях, при которых контакт животного с возбудителем инфекции, как правило, приводит к возникновению инфекционной болезни (например, ящур, сибирская язва, чума свиней, оспа овец). Возбудители этих болезней полностью удовлетворяют трем условиям постулата Генле и Коха: а) микроба-возбудителя обнаруживают у больных во всех случаях аналогичного заболевания при наличии определенных патологических изменений и клинической картины; б) возбудителя не находят при других заболеваниях; в) при заражении восприимчивого животного чистой культурой возбудителя воспроизводится аналогичное заболевание.
Но имеется довольно обширная вторая группа инфекционных болезней, для возникновения которых встречи микро - и макроорганизмов совершенно недостаточно, необходимы либо определенные условия внешней среды, вызывающие стресс, либо ассоциация нескольких биологических агентов, включая бактерии, вирусы, микоплазмы и др. Возбудители этой группы инфекционных болезней, как правило, не полностью удовлетворяют требованиям постулата Коха. Их выделяют от здоровых и заболевших другими болезнями животных (они имеют низкую вирулентность и болезнь трудно воспроизводится ими в эксперименте). Патологические изменения и клинические признаки обычно не строго специфичны, и болезнь, как правило, проявляется в виде общего синдрома. Поэтому в практических условиях их специфичность, как возбудителей инфекционной болезни, нередко устанавливается с большими трудностями.
Если в конкретных условиях в патогенезе таких болезней одновременно участвуют ассоциации специфических агентов (бактерии, вирусы, микоплазмы) и неспецифические причины (всевозможные стресс-факторы), то развивается полный, клинически выраженный симптомокомплекс болезни. Когда же в патогенезе не участвует ассоциация биологических агентов, а воздействует только один из видов микроорганизмов бактериальной, микоплазмозной или вирусной природы без влияния неспецифического фактора, то болезнь клинически проявляется неполным симптомокомплексом в виде легкого или бессимптомного переболевания. В качестве примера можно привести возникновение и развитие у телят респираторного и энтеритного симптомокомплексов, а также ряд патологических состояний животных инфекционной и неинфекционной природы, трудно и различно диагностируемых, которые чаще всего выявляются по зоотехническим критериям (плохая поедаемость корма, медленный рост, низкая продуктивность) или при убое после нормального снятия с откорма. В настоящее время основное внимание в эпизоотологии уделяют болезням этой группы, в частности смешанным инфекциям, поскольку они составляют главную проблему для крупных хозяйств промышленного типа.
Следовательно, возникновение инфекционной болезни и характер ее клинического проявления зависят от разнообразных факторов: вирулентности микроба и его количества, ворот инфекции, степени резистентности восприимчивого животного и факторов внешней среды, включая ассоциативные связи биологических агентов. Все это вместе взятое и составляет этиологию (причину) возникновения инфекционной болезни. Таким образом, понятие «этиологии» как причины инфекционной болезни намного шире понятия основного этиологического фактора – возбудителя инфекции/Значение этиологических факторов неодинаково при разных инфекционных болезнях. Микроорганизмы, обладающие высокой вирулентностью, попадая в восприимчивый организм (например, при сибирской язве, чуме свиней, эмкаре), имеют решающее значение в возникновении и исходе инфекционной болезни. При других болезнях, вызываемых менее вирулентными микроорганизмами (сельмонеллез. эшерихиозы, лептоспирозы, микоплазмозы, туберкулез, парагрипп-3 и др.), возникновение и исход инфекционного процесса в большей степени определяется свойствами поражаемого организма. Как правило, все факторы внешней среды, которые ослабляют защитные функции организма (переохлаждение, перегревание, нерациональное кормление, хроническое отравление и т. д.), способствуют возникновению и клиническому проявлению инфекции.
79. Бруцеллез, характеристика. Морфологические, культуральные, биохимические и другие свойства микроба. Материал исследования. Лабораторная диагностика и специфическая профилактика.
Бруцеллёз сельскохозяйственных животных относится к особо опасным инфекциям, так как при уходе за больными животными, а так же при употреблении необезвреженных мяса, молока, масла, сыра и других продуктов питания, полученных от больных животных, может и заразится и человек. Бруцеллёзу подвержены все виды сельскохозяйственных, домашних и диких животных. Кроме того, бруцеллёз может поражать некоторые виды холоднокровных и членистоногих. Это обусловлено приспособляемостью и способностью возбудителя бруцеллеза размножатся в организме животных и долго сохранять жизнеспособность во внешней среде. Являясь широко распространенной инфекцией, бруцеллёз наносит большой экономический ущерб, который характеризуется массовыми абортами и яловостью больных бруцеллёзом животных, эндометритами, задержанием последа, орхитами, рецидивирующей лихорадкой, Снижением жизнеспособности приплода, уменьшением продуктивности животных, затратой больших сил и средств при его ликвидации. у лошадей – преимущественно бурситами в области холки и воспалением связок затылочного сустава. . B.ovisвызывает эпидидимит у баранов, яловость, аборты и рождение нежизнеспособных ягнят. Основным источником заражения являются больные бруцеллёзом животные того же вида, но могут быть и другие. Например, у крупного рогатого скота и свиней выявили бруцеллы козье-овечьего вида (B.melitensis). Так как у животных и человека могут выделятся все виды бруцелл, следует признать наличие в природе естественной миграции бруцелл. Необходимо отметить, что первоисточником бруцеллёзной инфекции являются не дикие, а сельскохозяйственные животные. Возможно, бывают отдельные случаи переноса бруцеллёза от диких животных к сельскохозяйственным, но они не играют большой роли в общей эпизоотической цепи заболевания.
Бруцеллы обнаружил в 1886 г. Д. Брюс, микроскопируя мазки из селезёнки солдата, умершего от мальтийской лихорадки, а в 1887 г. он выделил чистую культуру и возбудителя назвал Micrococcus melitensis. Банг и Стрибольт (1897) из околоплодной жидкости коровы выделили второй вид – B.abortus bovis; Траум (1914) от абортировавшей свиньи - третий вид-B.abortus suis. В 1920 г. Майер и Фезье объединили эти три микроба в одну группу и предложили отнести эти микроорганизмы к роду Brucella и назвали их бруцеллами в честь открывшего их Брюса. 1953 г. Бадл изучая аболевание инфекционного эпидидимита баранов, выделил B. ovis. 1957 г. Стоеннерг и лакман в лесах их трупов древесных крыс выделил микроорганизмы идентичные бруцеллам, назвал B. neotomae . В 1966 г. К. Майкл выделил возбудитель бруцеллёза собак - B.canis .
Бруцеллы – мелкие кокковидные ( рис.1.) или палочковидные бактерии.
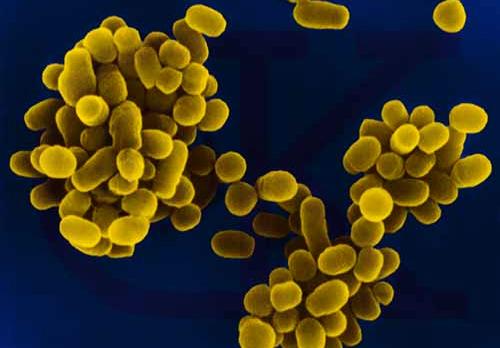
Рис.1. Возбудитель бруцеллёза.
Входят в секцию 4 (грамотрицательные аэробные палочки и кокки), род Brucella, который включает в себя шесть видов:B.abortus -возбудитель бруцеллёза крупного рогатого скота; B.melitensis - ов[ец и коз; B.Suis -свиней; B.canis - собак; B. neotomae - кустарниковых крыс; B.ovis - инфекционного эпидимита баранов. По антигенным и биохимическим свойствам подразделяют B. abortus на девять биоваров, B. melitensis-на три и B.suis- на пять биоваров. Наибольшее значение в патологии бруцеллёза имеют бруцеллы первых трёх видов.
Морфологические свойства. Бруцеллы – относят к самым мелким коккобактериям (длина палочек приближается к толщине). Размеры, толщина - 0,3…0,6мкм, длина - 0,6…1,5мкм. В окрашенных препаратах располагаются одиночно, парами или небольшими группами. Неподвижны, спор не образуют. Мукойдные и гладкие варианты синтезируют нежную капсулу, грамотрицательные. Окраска по грамму не является определяющей, связано с размерами бруцелл, используют дифференциальные методы окраски бруцелл - окраске по Козловскому, окраска по Стампу. Хорошо окрашиваются анилиновыми красителями. При окраске по Козловскому бруцеллы красные, другие микроорганизмы и фон препарата синего цвета.
Культуральные свойства. Возбудитель бруцеллёза является факультативным анаэробом. Бруцеллы В.abortusи B.ovis – микроаэрофилы, первые их генерации выращивают в условиях при содержании 10…15% СО2 . Выделяемые из первичного материала бруцеллы растут очень медленно, в среднем 15…30 суток, старые лабораторные культуры вырастают уже через 24…48 часов. Бруцеллы могут расти на обычных питательных средах при 36°…38°С и ph6,8…7,2, однако для их культивирования используют специальные среды: мясопептонный печёночный бульон (МППБ), мясопептонный печёночно – глюкозный – глицериновый агар (МППГГА), печёночно – глюкозно – глицериновый бульон агар (ПГГП, ПГГА) с 1% глюкозы и 2…3% глицерина (рис.2.), картофельный агар и др. Типичные вирулентные штаммы (S-форма) на поверхности агара образуют мелкие, 2…3мм в диаметре, круглые, выпуклые, с гладкой поверхностью и ровными краями, прозрачные с голубоватым оттенком колонии с возрастом цвет ржавчины; в бульоне – слабое равномерное помутнение, и пристеночное кольцо, в дальнейшем – небольшой осадок. Авирулентные варианты (R-форма) на агаре образуют шероховатые колонии, в бульоне – неравномерное помутнение с просветлением и крошковатым осадком. На агаре с кровью бруцеллы гемолиза не дают, пигмент не синтезируют.

Рис.2. Культура бруцелл. (ПГГА)
Биохимические свойства. Биохимическая активность у бруцелл выражена слабо. Не изменяют сахара короткого пёстрого ряда. Они утилизируют углеводы, но не образуют кислоту и газ в количествах, достаточных для их идентификации. Нитраты редуцируют в нитриты. Молоко не свёртывают, желатин и свёрнутую сыворотку не разжижают. Индол не образует. Некоторые виды гидролизуют аминокислоты с образованием аммиака. Ферментируют глюкозу, арабинозу, декстрозу, левулезу и др. с образованием кислоты. B.abortus и особенно B.suis при росте выделяют сероводород; B.melitensis образует его в незначительном количестве на средах серосодержащими аминокислотами. Могут продуцировать каталазу, пероксидазу, липазу, фосфотазу.
Патогенные свойства. Патогенное действие связано с образованием эндотоксинов, а также гиалуронидазы, каталазы, уреазы. Бруцеллы высокоинвазивны, могут проникать через не поврежденные слизистые покровы пищеварительного тракта, лёгких, глаз и кожу. Восприимчивы овцы, козы, крупный рогатый скот, буйволы, свиньи, лошади, мулы, верблюды, северные олени, собаки, кошки и многие дикие животные (лоси, косули, сайгаки и др.). Молодняк до половой зрелости более устойчив. Каждый вид бруцелл поражает определённый вид животного. Но бруцеллы могут мигрировать, заражая животных других видов, например, B.melitensis – крупный рогатый скот, свиней и лошадей, B. abortus – коз, овец, лошадей и свиней, B.suis – крупный и мелкий рогатый скот, лошадей. Для человека наиболее опасна B.melitensis. Больные животные выделяют возбудителя с молоком, абортированным плодом, околоплодной жидкостью, влагалищной слизью, мочой, калом. Из экспериментальных животных к бруцеллёзу чувствительны морские свинки и белые мыши. У мышей после заражения иногда развивается септицемия, морские свинки абортируют, худеют, у них выпадают волосы, возникает генерализованная инфекция. У многих животных через 1…2 года наступает самовыздоровление.
Антигенная структура. В структуру клетки бруцеллы входит S-антиген – липидный комплекс; и О-антиген – белковый комплекс.S-антиген трёх основных видов обладает двумя соматическими антигенами: М (melitensis) и А (B.abortus). М – антигена уB.melitensisв 20 раз больше, чем у других видов, в не большом количестве также имеется А – антиген; соотношение антигенов А и М уB.abortusсоставляет 20:1.B.suisсодержит больше М – антигена, чемB.abortus. Предполагают, что эти антигены представлены сложными глюцидо – липидополипептидным комплексом. Они активно индуцируют синтез антител, выявляемых в реакциях преципитации, агглютинации, РСК и других. Особенности антигенной структуры бруцелл позволяют получить моноспецифические А - и М - антисыворотки. Кроме того, был обнаружен поверхностныйL-антиген, сходный сVi– антигеном сальмонелл.
Устойчивость. Бруцеллы малоустойчивы к действию различных физических и химических факторов. Агаровые культуры в запарафинированных пробирках сохраняются несколько недель, лиофильно высушенные – годами. Прямые солнечные лучи убивают их через 1,5 - 4,5 часа. В воде бруцеллы выживают и более 5 месяцев, в поверхностном слое почвы – 40 суток, на глубине 5…8см – до 3 месяцев, в навозе при медленном высушивании – до 120 суток, в моче коров – до 4 суток, в почве зимой – 4…5суток, в высушенных плодных оболочках – до 120суток. В охлажденном молоке сохраняются 6…8суток, в кислом молоке – 1…4, в масле – 40…60, в сырах – более 42, в брынзе (5…11%-й раствор поваренной соли) – 45…60, в замороженном мясе – свыше 320 суток, в засоленных шкурах – 2мес, в шерсти – до 3…4мес. При температуре 60°С бруцеллы погибают через 30 мин, при 80…85°С – через 5 мин, при 100°С – мгновенно. Пастеризацию молока проводят при 85…90°С 30 мин. Дезинфицирующие растворы – 2%-й фенол, 1%-й креолин, 0,5%-й лизол, 1…2%-й формалин, 0,5…1%-й хлорамин, 1%-я соляная кислота, 3%-й гидроксид натрия, 5%-я хлорная известь убивают бруцелл в течение нескольких минут.
Материал исследования. Для бактериологического исследования на бруцеллёз ( при жизни животного) в лабораторию направляют: абортированный плод с плодными оболочками, околоплодную жидкость, истечения из родовых путей, желудок плода, перевязанный с двух концов лигатурой, кусочки печени и селезёнки плода. Молоко берут от коров в стерильные пробирки по 10 – 15мл из каждой доли вымени (последние порции), у овец и коз – путём пункции цистерны вымени посредством стерильного шприца с иглой. Для исследования молоко отсылают свежим (в день взятия пробы); если это представляется возможным, то его консервируют (лучше сухой борной кислотой из расчета 0,1г на 10мл молока). При убое самцов (баранов и др.) исследуют пораженные ткани органов – семенники с придатками. Тканевой материал от каждого животного в отдельности упаковывают в целлофан или пергаментную бумагу, затем помещают в водонепроницаемую тару (полиэтиленовый пакет, ящик, банку). Патологический материал отправляют в свежем виде или консервированным 30%-ным стерильным водным раствором химически чистого глицерина в соотношении 1: 4 (1:5). От абортировавших животных (не ранее чем через неделю после аборта) обязательно исследуют кровь. В лабораторию материал доставляют с нарочным и с сопроводительным письмом.
Лабораторная диагностика. Диагностика этой болезни основывается на показаниях результатов серологических, бактериологических, а также аллергических методов исследования (с учётом клинических признаков болезни – аборты, бурситы, орхиты, эпидидимиты, эндометриты).
Бактериологическая диагностика. Проводится по общепринятому принципу – микроскопия, высев на питательные среды для выделения и изучения чистой культуры, биопроба (заражение морских свинок).
Микроскопия. Из каждой пробы патматериала готовят два мазка-отпечатка из тканей органов или два мазка из жидкого материала (истечения), высушивают, фиксируют пламенем. Один препарат окрашивают по грамму, другой – специальным методом (по Козловскому, Шуляку – Шину или Стампу). Мазки, приготовленные из осадка молока (сливок), после центрифугирования перед окраской следует обезжирить смесью Никифорова.
Для выявления бруцелл непосредственно в патологическом материале, а также в объектах окружающей среды предложен прямой метод иммунофлюоресценции (РИФ); непрямой метод позволяет обнаружить антитела в сыворотке крови больных, переболевших или вакцинированных животных.
Бруцеллы – мелкие, палочко - или кокковидной формы бактерии, длиной 0,6 – 1,5 мкм, в диаметре – 0,3 – 0,5 мкм; неподвижные, спор не образуют, располагаются в мазке изолированно, попарно или небольшими скоплениями, кучками. Грамотрицательные.
Для выделения бруцелл делают посевы на специальные питательные среды: мясо-пептонный печёночны бульон (МППБ) и мясо-пептонный печёночный агар (МППА) с глицерином и глюкозой с добавлением генцианвиолета (1:2000000) или ацетата натрия (0,125 мг/мл), печёночно-глюкозно-глицериновый агар и бульон (ПГГА, ПГГБ), картофельный агар, эритрит агар или сывороточно-декстрозный агар.
Изучение сроков появления роста. Рост бруцелл проявляется через 7-10-30 и даже 40 дней. По мере адаптации к питательным средам рост культуры может появиться на 2 – 3-й день. На плотных питательных средах рост бруцелл проявляется мелкими прозрачными выпуклыми, округлыми, блестящими колониями с гладкой (S-формы) поверхностью с голубоватым оттенком (встречаются и R-формы). При более длительном культивировании колонии мутнеют, с появлением пигмента – темнеют, сливаются. В жидких питательных средах рост бруцелл проявляется в начале равномерным помутнением и образованием пристеночного кольца голубоватого оттенка; В последствии образуется незначительный осадок. При обнаружении роста из типичных колоний готовят мазки, окрашивают специальными методами и просматривают под микроскопом. Затем пересевают на плотную питательную среду и культивируют при тех же условиях.
Кроме того ставят РА на предметном стекле с позитивной бруцеллёзной сывороткой, разведённой 1:50 и 1:2 (для выявления слабоагглютинирующих культур ). Первичную культуру Br.ovisнадлежит подвергнуть серологической идентификации – чистой выделенной культурой гипериммунизируют кроликов, затем их сыворотку исследуют в РДСК с антигеном Br. ovis (овисный антиген)
Культуры бактерии, обладающие типичными морфологическими, тинкториальными и культуральными свойствами, дающими положительную РА с позитивной бруцеллёзной сывороткой, относят к бруцеллам.
Для дифференциации (табл.1) видов бруцелл используют чистые культуры (в S-форме). Бруцеллы дифференцируют по способности роста в отсутствии повышенной концентрации СО2, ВыделениюHS2, чувствительности к фагу Тб, бактериостатическому действию анилиновых красителей и агглютинации моноспецифическими сывороткам..
|
Вид бруцелл |
Потребность в СО2 |
Образование Н2S |
Рост в средах с красителями |
Агглютинация моноспецифическими сыворотками. |
Лизис фагом Тб |
||||
|
Основной фуксин (1:50000) |
Тионин (1:25000) |
||||||||
|
А |
М |
Р |
|||||||
|
B.melitensis |
- |
- |
+ |
- |
- |
+ |
- |
- |
|
|
B.abortus |
+ |
+ |
+ |
- |
+ |
- |
- |
+ |
|
|
B.suis |
- |
+ |
- |
+ |
+ |
- |
- |
- |
|
|
B.ovis |
+ |
- |
+ |
+ |
- |
- |
+ |
- |
|
|
B.neotomae |
- |
+ |
- |
- |
+ |
- |
- |
- |
|
|
B.canis |
- |
- |
- |
+ |
- |
- |
+ |
- |
|
Таблица.1. Дифференциация бруцелл.
Примечание. «+» - интенсивный рост; «-» - отрицательный рост.
Серологическая диагностика. Для серологического исследования направляют кровь или сыворотку крови и молоко.
Применяют пробирочную реакцию агглютинации (РА), реакцию связывания комплемента (РСК), реакцию длительного связывания комплемента (РДСК), пластинчатую реакцию агглютинации с роз бенгал антигеном (роз бенгал проба - РБП) и кольцевую с молоком (КР).
РА ставят в объёме 1 мл с единым бруцеллёзным антигеном для РА, РСК, и РДСК. Сыворотки крови овец, коз, буйволов, оленей и собак исследуют в разведении 1:25, 1:50, 1:100, 1:200; крупно рогатого скота, лошадей и верблюдов – 1:50, 1:100, 1:200 и 1:400. РА считают положительным при наличии агглютинации с сыворотками крови крупно рогатого скота, лошадей и верблюдов начиная с разведения 1:100 (100 МЕ); овец, коз, буйволов, оленей и собак – с 1:50 (50 МЕ) с сыворотками крови крупно рогатого скота, лошадей и верблюдов и 1:25 (25 МЕ) – с сыворотками овец, коз, буйволов, оленей и собак с оценкой не менее чем на два креста.
РСК – Специфичный и высокочувствительный метод диагностики бруцеллёза животных. Её показания более постоянны и сохраняются дольше: комплементсвязывающие антитела появляются позже, чем агглютинины. Эта реакция позволяет выявить большее количество больных в стадах с давней инфекцией. РСК применяют при диагностике бруцеллёза у выше перечисленных видов животных, а также свиней.
РДСК – более чувствительный тест, чем РСК. При инфицированном эпидидимите баранов используют только РДСК с овисным антигеном. РСК и РДСК считают положительными при задержке гемолиза на 2…4 креста в одном или двух разведениях (1:5 или 1:10) и полном гемолизе эритроцитов в контрольной пробирке (без антигена). Сомнительной – при задержке гемолиза с оценкой в один крест.
РПБ – используют для исследования сывороток крови крупного рогатого скота, овец, коз, лошадей свиней, буйволов, верблюдов и оленей. Реакцию проводят при температуре 18-30 °С с бруцеллёзным антигеном, окрашенным бенгальским розовым, на пластинках с лунками. При положительной реакции в течение 4 мин. Появляются мелкие или крупные хлопья агглютината розового цвета.
КР – ставят с цельным свежим или консервированным формалином молоком коров и антигеном – взвесью убитых бруцелл, окрашенных в синий цвет гематоксилином. При наличии в молоке специфических антител происходит агрегация антигена, образовавшийся комплекс адсорбируется сливками молока и поднимается с ними вверх, образуя чёткое, окрашенное кольцо. Проводится реакция в уленгутовских пробирках, в которые вносят по 0,05мл антигена, добавляют 1 мл молока и содержимое тщательно смешивают, выдерживают при 37-38 °С в течении 1 часа. Результаты учитывают визуально и оценивают в крестах: +++ - чётко выраженное синее кольцо в верхней части молока, остальная часть молока белая; ++ - достаточно выраженное синее кольцо, столбик молока синеватого цвета. Пробы, давшие реакцию с оценкой три и два креста, считают положительными. Эта реакция показательна для проверки благополучия стад (ферм) по бруцеллёзу крупного рогатого скота и молока на рынках.
