
- •Правила хранения химических реактивов
- •Площадь
- •3.9 Принципы оценки результатов лабораторных исследований
- •Подвижная фаза
- •Иммуноэлектрофорез
- •Электрофорез с последующей иммунофиксацией
- •4.4.1 Методы световой микроскопии
- •4.4.2 Современные микроскопические приборы
- •Инвертированные микроскопы проходящего света
- •Люминесцентный микроскоп
- •4.4.3 Уход за микроскопом
- •Витамин В6
- •Кофеин
- •Соответствие единиц
Иммуноэлектрофорез методом переноса. Основан на принципе класси-
ческого иммуноэлектрофореза. Отличие состоит в том, что первичное электрофоретическое разделение производится на ацетатцеллюлозе, затем ацетатцеллюлозу переносят на поверхность чашки с агаром и на расстоянии 3–5 мм параллельно зоне электрофоретического разделения помещают полоски фильтровальной бумаги, смоченные соответствующей антисывороткой. При взаимодействии антигена и специфических антител образуются дуги преципитации. Преимущества метода — возможность более легкой идентификации отдельныхбелков(описаннаяметодикауменьшаетплотностьдугпреципитации).
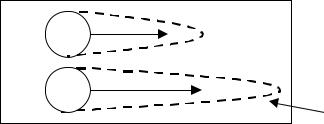
Ракетный имуноэлектрофорез (двумерный) происходит по схеме,
представленной на рисунке 4.15.
- |
+ |
|
Ag |
Катод |
Анод |
|
Ag |
|
Линия |
|
преципитации |
Рисунок 4.15 — Схема проведения ракетного электрофореза
Электрофорез происходит в геле агарозы, содержащем специфические антитела. При этом антигены (Ag) движутся по направлению к аноду и взаимодействуют с АТ в геле. Это приводит к образованию длинных ракетоподобных участков преципитации, которые легко увидеть при окрашивании геля. Процесс завершается, когда зона преципитации образует на конце острие. Длина и площадь зоны преципитации пропорциональны концентрации исследуемого антигена.
Описанный метод позволяет провести количественное определение концентрации антигена, сравнивая тестовые и контрольные образцы, одновременно подвергшиеся электрофорезу. Общая продолжительность реакции 3–8 часов. Используется специальная электрофоретическая камера с охлаждением. Существует модификация данного метода с применением ацетат-целлюлозных мембран.
Электрофорез с последующей иммунофиксацией
Проводят электрофорез (чаще на целлюлозно-ацетатных мембранах), а затем идентифицируют белки с помощью антисывороток. Для этого пластину делят на сегменты, которые затем погружают в антисыворотку. Обработанный сегмент (в нем образуется преципитат) прокрашивают (например, красителем понсо S или нигрозином). Метод удобен для определения белков Бенс-Джонса, парапротеинов в низкой концентрации.
109
Встречный иммуноэлектрофорез отличается тем, что взаимодейст-
вие антигена и антител происходит не вследствие свободной диффузии, а в постоянном электрическом поле, в результате чего и формируются зоны преципитации. Ввиду различного состава белков, они передвигаются в щелочной среде буферного раствора с различной скоростью и в разных направлениях: большинство АГ имеет отрицательный заряд и двигается к аноду, в то время как АТ обычно практически нейтральны и вместе с током жидкости передвигаются в обратном направлении — к катоду. Таким образом, АГ и сыворотка, содержащая специфичные к нему АТ, двигаются в слое геля навстречу друг другу. При контакте АГ и АТ образуются четкие зоны преципитации. Оценка реакции производится качественно в сравнении с контрольным рисунком, в качестве которого используется рисунок зон преципитации, образовавшийся при взаимодействии известных АГ и АТ. Метод используется для диагностики различных инфекционных заболеваний и считается методом 2-го поколения по сравнению с методами иммунодиффузии (чувствительность ≈ в 10 раз выше, продолжительность реакции меньше — около 3-х часов в сравнении с 24 часами при иммунодиффузии).
В целом следует отметить, что методы иммуноэлектрофореза достаточно трудоемки для выполнения и требуют большого количества дополнительного оборудования (камеры для электрофореза, электроды, камеры для окрашивания и сушки образцов и др.). Учет результатов чаще проводится качественно, но возможна и количественная оценка за счет использования оптических денситометров. Эти приборы позволяют определять оптические характеристики зон преципитации с последующим вычислением концентрации вещества в каждой фракции.
4.4 Методы микроскопии в клинико-диагностической лаборатории
Микроскоп (от лат. micros — «малый» и scopein — «рассматривать», «наблюдать») — прибор, позволяющий получать увеличенное изображение объектов и структур, недоступных глазу человека.
Основу микроскопических методов исследования составляет световая и электронная микроскопия. Световая микроскопия основывается на законах геометрической оптики и волновой теории образования изображения, в качестве освещения используются естественный или искусственные источники света. Электронная микроскопия обеспечивает получение элек- тронно-оптического изображения с помощью потока электронов. Построение изображения основывается на законах геометрической и волновой оптики, а также теории электромагнитных полей. Световые микроскопы обеспечивают увеличение до 2–3 тыс. раз, а электронные микроскопы — в 20 тыс. раз. Однако, несмотря на широкие возможности, электронные микроскопы в основном используются в научно-исследовательских лабораториях.
110
