
Материалы по истории
.doc
Т. неоднократно подчёркивал, что современные формы организмов — результат длительной приспособительной эволюции; на любом виде ныне живущих организмов лежит печать, с одной стороны, приспособленности к условиям обитания, с другой, — всей предшествующей эволюции. Исходя из этого, Т. считал, что для правильного понимания законов биологии, разнообразных проявлений жизни и возможности управления ими необходим исторический метод, то есть последовательный эволюционный подход к изучению организмов. Он писал: "... ни морфология, со своим блестящим и плодотворным сравнительным методом, ни физиология, со своим еще более могущественным экспериментальным методом, не покрывают всей области биологии, не исчерпывают ее задач; и та, и другая ищет дополнения в методе историческом" (Соч., т. 6, 1939, с. 61).
Т. как популяризатор и историк науки. Популяризация науки — одна из характерных и блестящих особенностей многогранной деятельности Т. Он писал: "С первых шагов своей умственной деятельности я поставил себе две параллельные задачи: работать для науки и писать для народа, то есть популярно…" (там же, т. 9, с. 13—14). Популяризацию научных знаний он рассматривал как путь, на котором соединяются наука и демократия.
Классический пример популяризации науки — книга Т. "Жизнь растения" (1878), выдержавшая десятки изданий на русском и иностранном языках. Сочетание глубокого анализа современных проблем естествознания с доступным и увлекательным их изложением характерно и для др. произведений Т.: "Столетние итоги физиологии растений" (1901), "Основные черты истории развития биологии в XIX столетии" (1907), "Пробуждение естествознания в третьей четверти века" (1907; в 1920 вышла под названием "Развитие естествознания в России в эпоху 60-х годов"), "Успехи ботаники в XX веке" (1917; в 1920 вышла под названием "Главнейшие успехи ботаники в начале XX столетия"), "Наука. Очерк развития естествознания за 3 века (1620—1920)" (1920), биографических очерков, воспоминаний и некрологов, посвященных выдающимся деятелям мировой науки (Дарвину, Л. Пастеру и др.). Т. защищал мысль об огромной роли науки в борьбе за мир. В 1917 Т. писал: "...Наука и демократия по самому существу своему враждебны войне" (там же, с. 252).
Т. был одним из первых крупных русских учёных, приветствовавших Великую Октябрьскую социалистическую революцию. В 1920 вышел в свет сборник статей Т. "Наука и демократия", по поводу которого В. И. Ленин в письме к Т. писал: "Я был прямо в восторге, читая Ваши замечания против буржуазии и за Советскую власть" (Полн. собр. соч., 5 изд., т. 51, с. 185). Несмотря на тяжёлую болезнь, 75-летний Т. участвовала работе Наркомпроса РСФСР и Социалистической (позднее Коммунистической) академии общественных наук, членом которой был избран в 1918. В 1920 Т. был избран депутатом Моссовета.
Незадолго до смерти Т. говорил: "Большевики, проводящие ленинизм, — я верю и убежден, — работают для счастья народа и приведут его к счастью" (см. Соч., т. 1, 1937, с. 160).
В Москве сооружен памятник Т. и создан мемориальный музей-квартира; имя Т. присвоено Московской с.-х. академии, институту физиологии растений АН СССР. Его именем названы один из районов Москвы и улицы во многих городах СССР. АН СССР раз в три года присуждает премию им. Тимирязева за лучшие работы по физиологии растений и ежегодно проводит Тимирязевские чтения.
Т. был членом Лондонского королевского общества (1911), почётным доктором университетов в Глазго (1901), Кембридже (1909) и Женеве (1909), член-корреспондентом Эдинбургского ботанического общества (1911), почётным членом многих русских университетов и научных обществ.
Соч.: Сочинения, т. 1—10, М., 1937—40; Избр. соч., т. 1—4, М., 1948—49; Избр. соч., т. 1—2, М., 1957; Наука и демократия. Сб. ст., М., 1963.
Лит.: Комаров В. Л., Максимов Н. А. и Кузнецов Б. Г., Климент Аркадьевич Тимирязев, М., 1945 (имеется список работ о Т., вышедших до 1945); Новиков С. А., К. А. Тимирязев (1843— 1920), под ред. А. К. Тимирязева, М.,1948; Цетлин Л. С., К. А. Тимирязев, 2 изд., М., 1952; Корчагин А. И., К. А. Тимирязев. Жизнь и творчество, 3 изд., М., 1957; Чайлахян М. Х., К, А. Тимирязев — учёный, борец, мыслитель, М., 1960; Сенченкова Е. М., К. А. Тимирязев и учение о фотосинтезе, М., 1961; Генкель П. А., К 125-летию со

Дмитрий Иосифович Ивановский
Биография
Окончил Петербургский университет (1888). Ассистент Ботанической лаборатории Петербургской АН (с 1890), приват-доцент Петербургского (1895—1901), профессор Варшавского (1901—15) и Донского (с 1915) университетов.
Умер 20 апреля 1920 года в Ростове-на-Дону; похоронен на территории Братского кладбища в его северо-восточной части.
Начав в 1887 изучение заболеваний табака на территории Бессарабии и Никитского ботанического сада, различил ранее смешиваемые так называемые рябуху и мозаичную болезнь. Выяснил (1892), что возбудитель последней, в отличие от бактерий, невидим в микроскоп при самом сильном увеличении, проходит через фарфоровые фильтры и не растет на обычных питательных средах. Обнаружил в клетках больных растений кристаллические включения («кристаллы Ивановского»), открыв, таким образом, особый мир возбудителей заболеваний небактериальной и непротозойной природы, названных впоследствии вирусами. Ивановский рассматривал их как мельчайшие живые организмы. Кроме того, Ивановский опубликовал работы об особенностях физиологических процессов в больных растениях, влиянии кислорода на спиртовое брожение у дрожжей, состоянии хлорофилла в растениях, его устойчивости к свету, значении каротина и ксантофилла, по почвенной микробиологии.

Ван Ниль (Van Niel) Корнелис Бернардус
(р. 4.11.1897, Харлем, Нидерланды), американский микробиолог, член Американской академии наук и искусств и Национальной АН. Окончил Политехнический институт в Делфте (Нидерланды, 1922) и до 1928 работал там же, затем переехал в США. В 1929—35 доцент Станфордского, затем Принстонского университета. С 1935 профессор. С 1954 в Ратжерском университете (Нью-Брансуик). Основные труды по физиологии и систематике пропионовокислых, затем фотосинтезирующих бактерий. Доказал, что пурпурные и зелёные бактерии осуществляют фотосинтез без выделения О2, т.к. при ассимиляции СО2 окисляют сероводород или другие восстановленные субстраты (тиосульфат, серу, органические соединения или молекулярный водород). Вывел общее уравнение фотосинтеза для растений и бактерий.
Robert Hill FRS
(April 2, 1899–March 15, 1991), known as Robin Hill, was a British plant biochemist who, in 1939, demonstrated the 'Hill reaction' of photosynthesis, proving that oxygen is evolved during the light requiring steps of photosynthesis. He also made significant contributions to the development of the Z-scheme of oxygenic photosynthesis.
Hill was born in New Milverton, a suburb of Leamington Spa, Warwickshire. He was educated at Bedales School, where he became interested in biology and astronomy (he published a paper on sunspots in 1917), and Emmanuel College, Cambridge, where he read natural sciences, specialising in chemistry. During the First World War he served in the Anti-gas Department of the Royal Engineers.
In 1922 he joined the Department of Biochemistry at Cambridge where he was directed to research haemoglobin. He published a number of papers on haemoglobin, and in 1926 he began to work with David Kellin on the haem containing protein cytochrome c. In 1932 he commenced work on plant biochemistry, focusing on photosynthesis and the oxygen evolution of chloroplasts, leading to the discovery of the 'Hill reaction'.
From 1943 Hill's work was funded by the Agricultural Research Council (ARC), although he remained working in the Cambridge Biochemistry Department. He was elected a Fellow of the Royal Society in 1946. Hill continued to receive most recognition for his work on photosynthesis and from the late 1950s his work concentrated on the energetics of photosynthesis. Working with Fay Bendall he made his second great contribution to photosynthesis research. In 1960 Bendall and Hill discovered the 'Z scheme' of electron transport. He was awarded the Royal Medal in 1963, and the Copley Medal in 1987.
Hill retired from the ARC in 1966, although his research at Cambridge continued until his death in 1991. In his later years Hill worked on the issue of the application of the Second Law of Thermodynamics to photosynthesis.
He was an expert on natural dyes and grew plants such as madder and woad. He painted watercolours using pigments he had extracted himself.[1] In the 1920s he developed a fish-eye camera and used it to take stereoscopic whole-sky images, recording cloud patterns in three dimensions.
ФОТОСИНТЕЗ
ФОТОСИНТЕЗ , образование зелеными растениями и нек-рыми бактериями орг. в-в с использованием энергии солнечного света. Происходит при участии пигментов (у растений хлорофиллов ). В основе Ф. лежат окислит.-восстановит. р-ции, в к-рых электроны переносятся от донора (напр., H2O, H2S) к акцептору (CO2) с образованием восстановленных соед. (углеводов) и выделением O2 (если донор электронов H2O), S (если донор электронов, напр., H2S) и др.
Ф.- один из самых распространенных процессов на Земле, обусловливает круговорот в природе углерода, O2 и др. элементов. Он составляет материальную и энергетич. основу всего живого на планете. Ежегодно в результате Ф. в виде орг. в-ва связывается ок. 8·1010 т углерода, образуется до 1011 т целлюлозы. Благодаря Ф. растения суши образуют ок. 1,8·1011 т сухой биомассы в год; примерно такое же кол-во биомассы растений образуется ежегодно в Мировом океане. Тропич. лес вносит до 29% в общую продукцию Ф. суши, а вклад лесов всех типов составляет 68%. Ф. высших растений и водорослей - единственный источник атм. O2.
Возникновение на Земле ок. 2,8 млрд. лет назад механизма окисления воды с образованием O2 представляет собой важнейшее событие в биол. эволюции, сделавшее свет Солнца главным источником-своб. энергии биосферы, а воду - практически неограниченным источником водорода для синтеза в-в в живых организмах. В результате образовалась атмосфера совр. состава, O2 стал доступным для окисления пищи (см. Дыхание ), а это обусловило возникновение высокоорганизов. гетеротрофных организмов (применяют в качестве источника углерода экзогенные орг. в-ва).
Ок. 7% орг. продуктов Ф. человек использует в пищу, в качестве корма для животных, а также в виде топлива и строит. материала. Ископаемое топливо - тоже продукт Ф. Его потребление в кон. 20 в. примерно равно приросту биомассы.
Общее запасание энергии солнечного излучения в виде продуктов Ф. составляет ок. 1,6 · 1021 кДж в год, что примерно в 10 раз превышает совр. энергетич. потребление человечества. Примерно половина энергии солнечного излучения приходится на видимую область спектра (длина волны l от 400 до 700 нм), к-рая используется для Ф. (физиологически активная радиация, или ФАР). ИК излучение не пригодно для Ф. кислородвыделяющих организмов (высших растений и водорослей), но используется нек-рыми фотосинтезирующи-ми бактериями.
В связи с тем, что углеводы составляют осн. массу продуктов биосинтетич. деятельности растений, хим. ур-ние Ф. обычно записывают в виде:
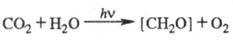
Для этой р-ции 469,3 кДж/моль, понижение энтропии 30,3 Дж/(К·моль), -479 кДж/моль. Квантовый расход Ф. для одноклеточных водорослей в лаб. условиях составляет 8-12 квантов на молекулу CO2. Утилизация при Ф. энергии солнечного излучения, достигающего земной пов-сти, составляет не более 0,1% всей ФАР. Наиб. продуктивные растения (напр., сахарный тростник) в среднем за год усваивают ок. 2% энергии падающего излучения, а зерновые культуры - до 1%. Обычно суммарная продуктивность Ф. ограничена содержанием CO2 в атмосфере (0,03-0,04% по объему), интенсивностью света и т-рой. Зрелые листья шпината в атмосфере нормального состава при 25 0C на свету насыщающей интенсивности (при солнечном освещении) дают неск. литров O2 в час на грамм хлорофилла или на килограмм сухого веса. Для водорослей Chlorella pyrenoidosa при 35 0C повышение концентрации CO2 от 0,03 до 3% позволяет повысить выход O2 в 5 раз, такая активация является предельной.
Бактериальный Ф. и общее ур-ние Ф. Наряду с Ф. высших растений и водорослей, сопровождаемым выделением O2, в природе осуществляется бактериальный Ф., в к-ром окисляемым субстратом является не вода, а др. соединения, обладающие более выраженными восстановит. св-вами, напр. H2S, SO2. Кислород при бактериальном Ф. не выделяется, напр.:
Фотосинтезирующие бактерии способны использовать не только видимое, но и ближнее ИК излучение (до 1000 нм) в соответствии со спектрами поглощения преобладающих в них пигментов - бактериохлорофиллов. Бактериальный Ф. не имеет существенного значения в глобальном запасании солнечной энергии, но важен для понимания общих механизмов Ф. Кроме того, локально бескислородный Ф. может вносить существенный вклад в суммарную продуктивность планктона. Так, в Черном море кол-во хлорофилла и бактериохлорофил-ла в столбе воды в ряде мест приблизительно одинаково.
Учитывая данные о Ф. высших растений, водорослей и фотосинтезирующих бактерий, обобщенное ур-ние Ф. можно записать в виде:
![]()
А - кислород в случае высших растений и водорослей, S либо др. элементы - в бактериальном Ф.
Мол. механизм Ф. и структура фотосинтетич. аппарата.
С использованием изотопных меток показано, что источником O2 в Ф. является только вода:

Ф. пространственно и во времени разделяется на два сравнительно обособленных процесса: световую стадию окисления воды и темновую стадию восстановления CO2 (рис. 1). Обе эти стадии осуществляются у высших растений и водорослей в специализир. органеллах клетки - хлоропластах. Исключение - синезеленые водоросли (цианобактерии), у к-рых нет аппарата Ф., обособленного от цитоплазматич. мембран.
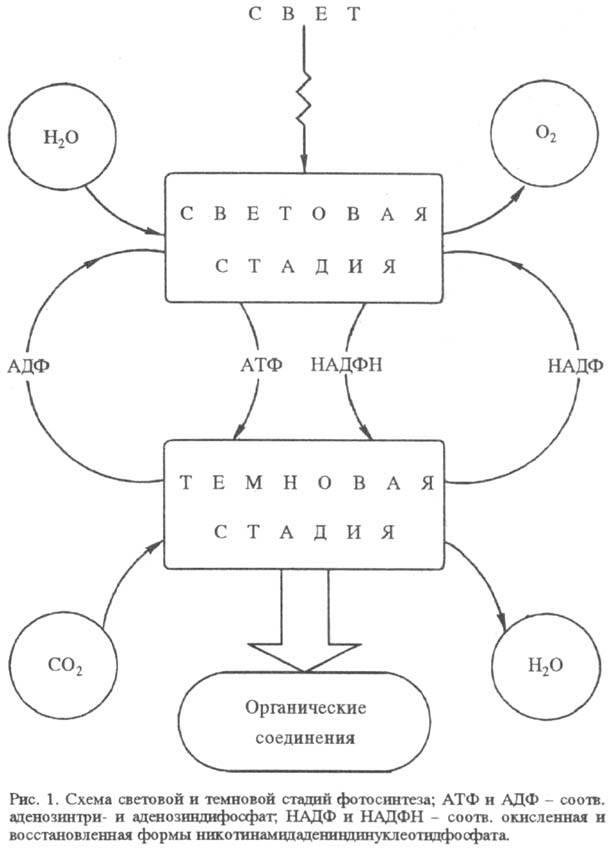
Хлоропласт, представляющий собой замкнутую структуру, отделенную от остальной части клетки оболочкой, заключает в себе весь фотосинтетич. аппарат. Световая стадия реализуется в мембранных структурах хлоропласта (т. наз. тилакои-дах), тогда как темновая стадия происходит в жидком содержимом хлоропласта (строме) при участии водорастворимых ферментов. У фотосинтезирующих бактерий хлоропласты отсутствуют, но световая стадия также осуществляется в мембранных образованиях - в т. наз. хроматофорах.
Световая стадия. Миним. функциональная единица, еще способная осуществлять световую стадию Ф.,- тилакоид. Он представляет собой микроскопич. плоский диск, образованный белковолипидными мембранами, в к-рых находятся пигменты. В эти мембраны встроены все компоненты, необходимые для окисления воды, восстановления кофермента никотинамиддинуклеотидфосфата (НАДФ) до НАДФН и синтеза АТФ из аденозиндифосфата. Световая стадия инициируется поглощением кванта света пигментами, организованными в спец. светособирающие комплексы. Среди пигментов преобладает хлорофилл а. К вспомогат. пигментам относятся хлорофилл b, каротиноиды и др. Наличие светособирающей структуры из неск. сотен или десятков молекул пигментов на каждый фотохимически активный (реакционный) центр на 2-3 порядка увеличивает сечение захвата излучения и обеспечивает возможность Ф. при слабом освещении.
Часть вспомогат. пигментов, спектрально наиб. близких к фотохимически активному хлорофиллу, непосредственно окружает каждый из реакционных центров, образуя т. наз. антенны.
Высокая эффективность переноса возбуждения от молекулы, поглотившей квант, к фотохим. центру определяется спектр. св-вами и структурной организацией пигментов светособирающего комплекса и антенны, окружающей фотохим. центр. Эти пигменты обеспечивают передачу возбуждения за время менее 100 пс в пределах времени жизни синглетно возбужденного состояния хлорофилла.
В реакц. центре Ф., куда почти со 100%-ной вероятностью переносится возбуждение, происходит первичная р-ция между фотохимически активной молекулой хлорофилла а (у бактерий - бактериохлорофилла) и первичным акцептором электрона (ПА). Дальнейшие р-ции в тилакоидных мембранах происходят между молекулами в их осн. состояниях и не требуют возбуждения светом. Эти р-ции организованы в электронтранспортную цепь - последовательность фиксированных в мембране переносчиков электрона. В электронтранс-портной цепи высших растений и водорослей содержится два фотохим. центра (фотосистемы), действующих последовательно (рис. 2), в бактериальной электронтранспортной цепи - один (рис. 3).
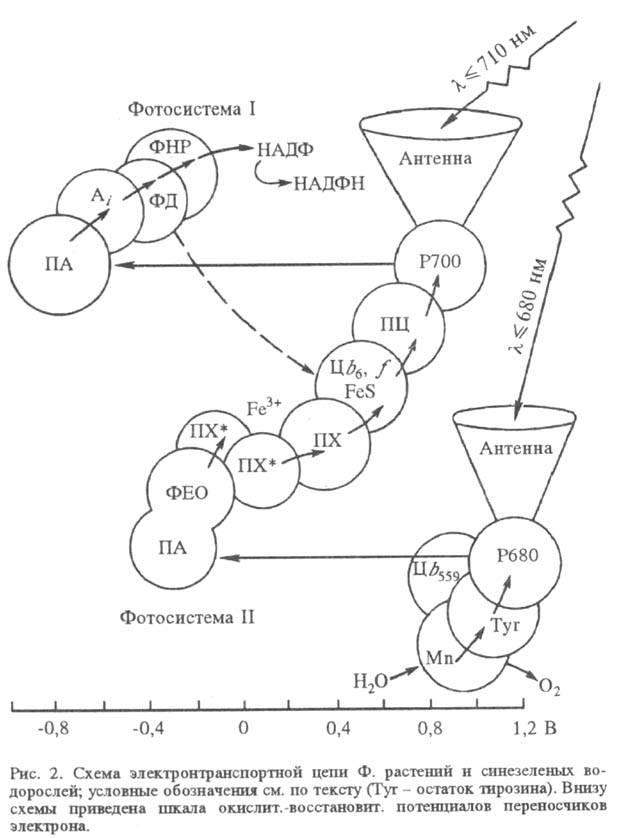
В фотосистеме II высших растений и водорослей синглетно возбужденный хлорофилл а в центре Р680 (число 680 обозначает, что максимум спектральных изменений системы при возбуждении светом находится вблизи 680 нм) отдает электрон через промежуточный акцептор к феофитину (ФЕО, безмагниевый аналог хлорофилла), образуя катион-радикал . Анион-радикал восстановленного феофитина служит далее донором электрона для связанного пластохинона (ПХ*; отличается от убихинонов заместителями в хиноидном кольце), координированного с ионом Fe3+ (в бактериях имеется аналогичный Fе3+-убихинонный комплекс). Далее электрон переносится по цепи, включающей свободный пластохинон (ПХ), присутствующий в избытке по отношению к остальным компонентам цепи, затем цитохромы (Ц) b6 и f, образующие комплекс с железо-серным центром, через медьсодержащий белок пластоцианин (ПЦ; мол. м. 10400) к реакционному центру фотосистемы I.
Центры быстро восстанавливаются, принимая электрон через ряд промежут. переносчиков от воды. Образование O2 требует последоват. четырехкратного возбуждения реакционного центра фотосистемы П и катализируется мембранным комплексом, содержащим Mn.
Хлорофилл a в фотосистеме I, имеющий максимум поглощения вблизи 700 нм (центр Р700), является первичным фотовозбуждаемым донором электрона, к-рый он отдает первичному акцептору (ПА; его природа однозначно не установлена), а затем, через ряд промежут. переносчиков (Ai) -растворимому белку ферредоксину (ФД), восстанавливающему с помощью фермента ферредоксин-НАДФ-редуктазы (ФНР) НАДФ до НАДФН. Катион-радикал окисленного пигмента восстанавливается пластоцианином.
В зрелых хлоропластах имеются граны (стопки тилакои-дов), в мембранах к-рых присутствуют все компоненты злек-тронтранспортной цепи, и т. наз. агранальные тилакоиды, не содержащие фотосистемы II.
Благодаря асимметрич. расположению компонентов электронтранспортной цепи относительно плоскости мембраны при разделении зарядов между хлорофиллом в каждом из двух фотосинтетич. центров и акцептором электрона на тилако-идной мембране создается разность электрич. потенциалов (плюс - на внутренней, минус - на внешней ее стороне). Перенос электрона пластохиноном сопровождается транспортом протонов, к-рые захватываются снаружи тилакоида при восстановлении пластохинона и освобождаются внутрь тилакоида при окислении пластогидрохинона. Перенос электронов сопряжен с синтезом АТФ из аденозиндифосфата (АДФ) и неорг. фосфата. Предполагают, что обратный транспорт протонов из тилакоидов в строму через белковый сопрягающий фактор (Н+-АТФ-синтетазу) сопровождается образованием АТФ.

Фотосистема I может действовать автономно без контакта с системой II. В этом случае циклический перенос электрона (на схеме показан пунктиром) сопровождается синтезом АТФ, а не НАДФН. Образующиеся в световой стадии кофермент
НАДФН и АТФ используются в темновой стадии Ф., в ходе к-рой снова образуется НАДФ и АДФ.
Электронтранспортные цепи фотосинтезирующих бактерий в основных своих чертах аналогичны отдельным фрагментам таковых в хлорогшастах высших растений. На рис. 3 показана электронтранспортная цепь пурпурных бактерий.
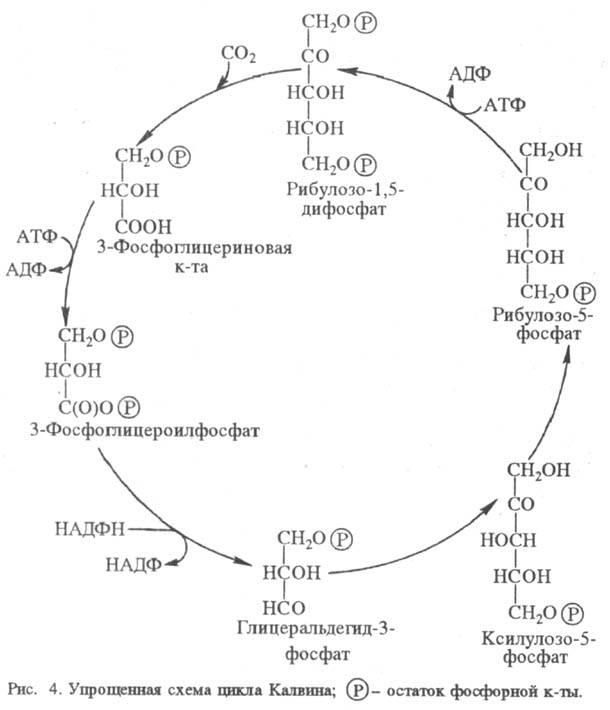
Темновая стадия Ф. Все фотосинтезирующие организмы, выделяющие O2, а также нек-рые фотосинтезирующие бактерии сначала восстанавливают CO2 до фосфатов Сахаров в т. наз. цикле Калвина. У фотосинтезирующих бактерий встречаются, по-видимому, и др. механизмы. Большинство ферментов цикла Калвина находится в растворимом состоянии в строме хлоропластов.
Упрощенная схема цикла показана на рис. 4. Первая стадия - карбоксилирование рибулозо-1,5-дифосфата и гидролиз продукта с ооразованием двух молекул 3-фосфоглицериновой к-ты. Эта С3-кислота фосфорили-руется АТФ с образованием 3-фос-фоглицероилфосфата, к-рый затем восстанавливается НАДФН до гли-церальдегид-3-фосфата. Полученный триозофосфат затем вступает в ряд р-ций изомеризации, конденсации и перегруппировок, дающих 3 молекулы рибулозо-5-фосфата. Последний фосфорилируется при участии АТФ с образованием риоу-лозо-1,5-дифосфата и, т. обр., цикл замыкается. Одна из 6 образующихся молекул глицеральдегид-3-фос-фата превращается в глюко-зо-6-фосфат и используется затем для синтеза крахмала либо выделяется из хлоропласта в цитоплазму. Глицеральдегид-3-фосфат может также превращаться в 3-глицеро-фосфат и затем в липиды. Триозофосфаты, поступающие из хлоропласта, превращаются в осн. в сахарозу, к-рая переносится из листа в др. части растения.
В одном полном обороте цикла Калвина расходуется 9 молекул АТФ и 6 молекул НАДФН для образования одной молекулы 3-фосфоглицериновой к-ты. Энергетич. эффективность цикла (отношение энергии фотонов, необходимых для фотосинтеза АТФ и НАДФН, к DG0 образования углевода из CO2) с учетом действующих в строме хлоропласта концентраций субстратов составляет 83%. В самом цикле Калвина нет фотохим. стадий, но световые стадии могут косвенно влиять на него (в т. ч. и на р-ции, не требующие АТФ или НАДФН) через изменения концентраций ионов Mg2+ и H+, а также уровня восстановленности ферредоксина.
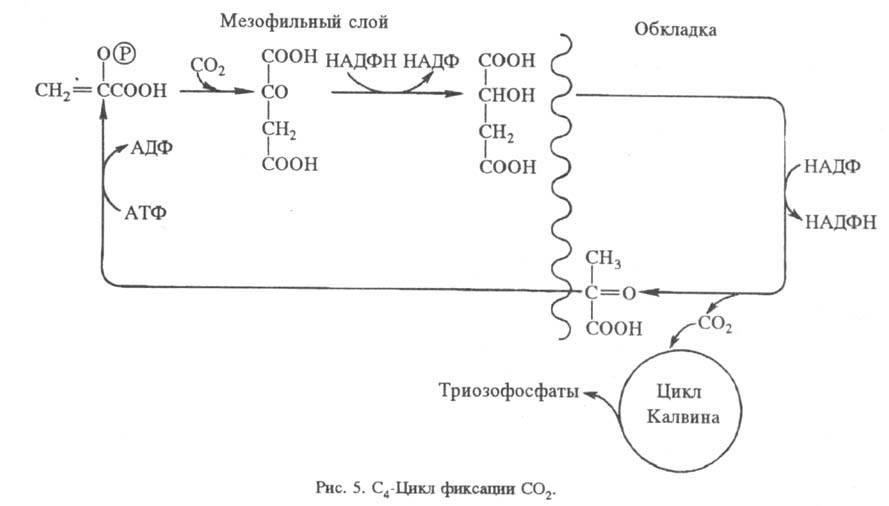
Нек-рые высшие растения, приспособившиеся к высокой интенсивности света и к теплому климату (напр., сахарный тростник, кукуруза), способны предварительно фиксировать CO2 в дополнит. С4-цикле. При этом CO2 сначала включается в обмен четырехуглеродных дикарбоновых к-т, к-рые затем декарбоксилируются там, где локализован цикл Калвина. С4-Цикл характерен для растений с особым анатомич. строением листа и разделением ф-ций между двумя типами клеток: мезофильных, где сосредоточено карбоксилирование фосфоенолиировиноградной к-ты, и клеток обкладки сосудистого пучка, где функционирует цикл Калвина. Образующаяся в С4-цикле щавелевоуксусная кислота восстанавливается НАДФН до яблочной, к-рая перемещается в клетки сосудистой обкладки и здесь подвергается окислит, декарбоксили-рованию, образуя пировиноградную к-ту, CO2 и НАДФН. Два последних используются в цикле Калвина, а пировиноградная к-та возвращается в С4-цикл (рис. 5). Физиол. смысл С4-цикла состоит в запасании CO2 и повышении, т. обр., общей эффективности процесса.
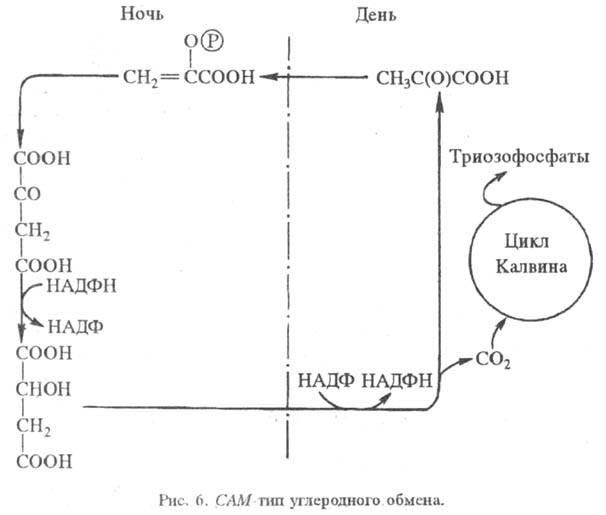
Для кактусов, молочая и др. засухоустойчивых растений характерно частичное разделение фиксации CO2 и Ф. во времени (САМ-обмен, или обмен по типу толстянковых; САМ сокр. от англ. Crassulaceae acid metabolism). Днем устьица (каналы, через к-рые осуществляется газообмен с атмосферой) закрываются, чтобы уменьшить испарение воды. При этом поступление CO2 также затруднено. Ночью устьица открываются, происходит фиксация CO2 в виде фосфоенол-пировиноградной к-ты с образованием С4-кислот, к-рые днем декарбоксилируются, а освобождаемый при этом CO2 включается в цикл Калвина (рис. 6).
Ф. галобактерий. Единственный известный в природе не-хлорофилльный способ запасания энергии света осуществляют бактерии Halobacterium halobium. Ha ярком свету при пониженной концентрации O2 они образуют в своих мембранах пурпурный белок бактериородопсин . В результате индуцированной светом цис-транс-изомеризации ретиналя (хромофора этого пигмента) происходит поглощение H+ и синтез АТФ. Последний используется для частичного обеспечения энерге-тич. потребностей клетки.
Историческая справка. Ок. 1770 Дж. Пристли обнаружил, что растения выделяют O2. В 1779 Я. Ингенхауз установил, что для этого необходим свет и что O2 выделяют только зеленые части растений. Ж. Сенебье в 1782 показал, что для питания растений требуется CO2; в нач. 19 в. H. Соссюр, исходя из закона сохранения массы, подтвердил, что большая часть массы растений создается из CO2 и воды. В 1817 П. Пельтье и Ж. Каванту выделили зеленый пигмент хлорофилл. Позже К.А. Тимирязев показал близость спектра действия Ф. и спектра поглощения хлорофилла. Ю. Сакс в сер. 19 в., по-видимому, первым осознал, что этот продукт накапливается в хлоропластах, а Т.В. Энгельман доказал, что именно там же выделяется и O2.
В работах Ф. Блэкмана (1905), P. Эмерсона и У. Арнолда (1932), а также P. Хилла (1936-41) показано наличие световой и темновой стадий Ф. и экспериментально реализована световая стадия в отсутствие CO2 с использованием искусств. акцепторов электрона. Тем самым были получены подтверждения представлений об образовании O2 путем окисления воды. Окончательно это было доказано масс-спектрометрич. методом (С. Рубен, M. Камен, а также А.П. Виноградов и Р.В. Тейс, 1941).
В 1935-41 К. Ван Ниль обобщил данные по Ф. высших растений и бактерий и предложил общее ур-ние, охватывающее все типы Ф. X. Гаффрон и К. Воль, а также Л. Дёйсенс в 1936-52 на основе количеств. измерений выхода продуктов Ф. поглощенного света и содержания хлорофилла сформулировали представление о "фотосинтетич. единице" - ансамбле молекул пигмента, осуществляющих светосбор и обслуживающих фотохим. центр.
В 40-50-х гг. M. Калвин, используя изотоп 14C, выявил механизм фиксации CO2. Д. Арнон (1954) открыл фотофос-форилирование (инициируемый светом синтез АТФ из АДФ и H3PO4) и сформулировал концепцию электронного транспорта в мембранах хлоропластов. P. Эмерсон и Ч.M. Льюис (1942-43) обнаружили резкое снижение эффективности фотосинтеза при 700 нм (красное падение, или первый эффект Эмерсона), а в 1957 Эмерсон наблюдал неаддитивное усиление Ф. при добавлении света низкой интенсивности с 650 нм к дальнему красному свету (эффект усиления, или второй эффект Эмерсона). На этом основании в 60-х гг. сформулировано представление о последовательно действующих фотосистемах в электронтранспортной цепи Ф. с максимумами в спектрах действия вблизи 680 и 700 HM.
Осн. закономерности образования O2 при окислении воды в Ф. установлены в работах Б. Кока и П. Жолио (1969-70). Близится к завершению выяснение мол. организации мембранного комплекса, катализирующего этот процесс. В 80-х гг. методом рентгеновского структурного анализа детально изучена структура отдельных компонентов фотосинтетич. аппарата, включая реакционные центры и светособирающие комплексы (И. Дайзенхофер, X. Михель, P. Хубер).
