
- •Вопросы к коллоквиуму по мкт и термодинамике
- •В чем особенности статистического и термодинамического подходов к изучению газовых систем?
- •Что такое броуновское движение частиц вещества малых размеров, чем оно вызвано и о чем свидетельствует?
- •Что понимают под степенями свободы механического движения элементов молекулярных систем?
- •Почему невозможен вечный двигатель первого рода?
- •О чем говорит третье начало термодинамики?
-
Что понимают под степенями свободы механического движения элементов молекулярных систем?
механической системы называется количество независимых величин, е помощью которых может быть задано положение системы. Одноатомный газ имеет три поступательные степени свободы і = 3, так как для описания положения такого газа в пространстве достаточно трёх координат (х, у, z).
Жесткой связью называется связь, при которой расстояние между атомами не изменяется. Двухатомные молекулы с жесткой связью (N2, O2, Н2) имеют 3 поступательные степени свободы и 2 вращательные степени свободы: i=iпост +iвр=3 + 2=5.
Поступательные
степени свободы связаны
с движением молекулы как целого в
пространстве, вращательные - с поворотом
молекулы как целого. Вращение относительного
осей координат x и z на
угол ![]() приведет
к изменению положения молекул в
пространстве, при вращении относительно
оси умолекула
не изменяет своё положение, следовательно,
координата φy в
данном случае не нужна. Трехатомная
молекула с жёсткой связью обладает 6
степенями свободы
приведет
к изменению положения молекул в
пространстве, при вращении относительно
оси умолекула
не изменяет своё положение, следовательно,
координата φy в
данном случае не нужна. Трехатомная
молекула с жёсткой связью обладает 6
степенями свободы
-
Как распределяется энергия по степеням свободы поступательного, вращательного и колебательного видов движения?
Больцман установил закон равномерного распределения энергии молекул идеального газа по степеням свободы: на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная kT/2.
Таким образом, молекула с i-степенями свободы обладает средней кинетической энергией, равной

Рис.20.1
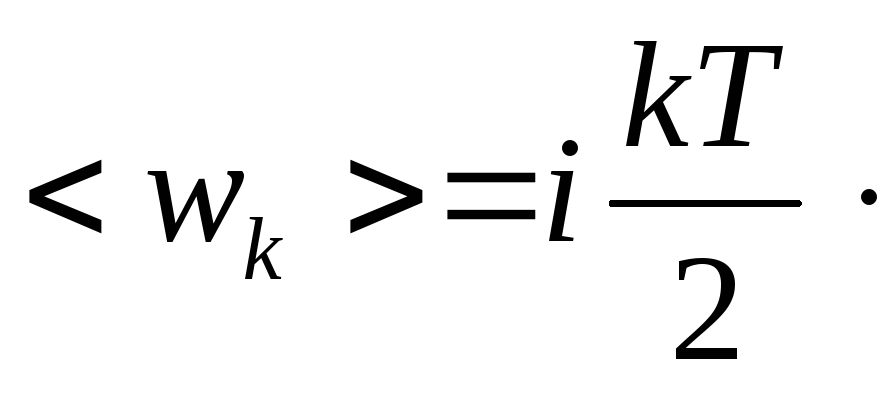
-
Что понимают под началами термодинамики? Сколько их?
Классическая термодинамика включает в себя следующие разделы: началатермодинамики (иногда также называемые законами или аксиомами)
Всего 3
-
Каков физический смысл удельной и молярной теплоемкостей?
Физический смысл теплоемкости – это величина, равная тому количеству теплоты, которое необходимо передать телу, чтобы изменить его температуру на 10К. Теплоемкость С определяется массой тела, его химическим составом и термодинамическим состоянием.
Понятие теплоемкости включает в себя понятия удельной и молярной теплоемкости. Теплоемкость единицы массы вещества называют удельной теплоемкостью. В случае однородного тела она равна:
c = C/ m,
где m – масса газа.
Теплоемкость одного моля вещества называют молярной или молекулярной теплоемкостью (обозначается С). Молярная и удельная теплоемкости связаны соотношением:
с = С / М,
где М – молярная масса вещества.
В СИ удельная и молярная теплоемкости имеют следующие размерности: [с] = Дж/кгК, [С] = Дж/мольК.
-
Как соотносятся друг с другом теплота, подводимая к газу, и работа, совершаемая против него внешними силами.
-
Как формулируется первое начало термодинамики?
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии.Следовательно, работу и количество теплоты измеряют в одних единица— джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: ΔU = A + Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
