
- •Теории химической кинетики
- •Теория активных
- •Кинетическая теория газов
- •Кинетическая теория газов
- •Основные положения ТАС
- •Основные факторы протекания реакции
- •Сравнение скоростей реакций, рассчитанных по опытным данным, показывает, что в большин- стве случаев
- •Основные факторы протекания реакции
- •Понятие о столкновении частиц
- •Вывод уравнения
- •Параметры столкновения
- •Параметры
- •Расчет приведенной
- •Выражение для
- •Для одноименных частиц
- •Эффективный диаметр столкновения
- •Анализ уравнения для скорости
- •Анализ
- •Анализ
- •Классификация
- •• Размерность
- •Пример экзаменационной задачи
- •Пример
- •Недостатки и достоинство ТАС
- •Примеры мономолекулярной реакции
- •Кинетические особенности мономолекулярной реакции
- •Предсказательная сила
- •Теория Линдемана 1922
- •Анализ уравнения
- •Тримолекулярные
- •Кинетические особенности тримолекулярной реакции
- •Кинетическое
- •Выводы
- •Выводы
- •Теория активированного комплекса (ТАК)
- •Поверхность потенциальной энергии (ППЭ)
- •Кривая потенциальной энергии и ППЭ
- •Классификация
- •Основные положения ТАК
- •Поверхность потенциальной
- •Выражение для скорости реакции
- •Методы приближенного описания кинетики сложных реакций
- •Основные факторы протекания реакции в ТАК
- •Термодинамический
- •Термодинамический
- •Выводы
- •Выводы
- •Сравнение Еа с
- •Выводы
- •Энтропийный фактор
- •Расчетные выражения
- •Расчетные выражения
- •Расчет энтальпии
- •Расчет изменения энтропии
- •Расчет изменения энтропии
- •Пример экзаменационной задачи
- •Решение

Выводы
3• . Физический смысл
предъэкспоненциального множителя А – это частота распада активированного комплекса.
Стерический фактор р в ТАС пропорционален энтропийному фактору в ТАК
р
4. Влияние температуры на константу
скорости k в ТАК определяется влиянием температуры на константу равновесия K1 по
уравнению Вант – Гоффа: dlnK1/dT =
rH01/RT2

Энтропийный фактор
•По величине энтропийного фактора реакции можно разделить на три типа:
-Нормальные 0
-Медленные << 0
-Быстрые >> 0
N2O4 2 NO2 >> 0 NH3 + HCl NH4Cl << 0

Расчетные выражения
•k = (kбT/h) при =1
Из уравнения скорости получим выражение для константы скорости в различных единицах измерения:
[л/моль*время]
Kс = (kбT/h) *(С0)1-n.
[1/(атмn-1·время)] kр = (kбT/h) *(Рº)1-n.
Множители (Сº) и (Рº) , введены для согласования размерности константы скорости.
=1-n, где n – число молекул, вступающих в реакцию.
Для бимолекулярной реакции n=2 и =1-n = -1
Расчетные выражения
•При стандартном состоянии для реакции в растворах С0 = 1 моль/cм3 .
•Для газовых реакций за стандарт принимается давление компонентов, равное Р0 =1 атм.
•Если реакция протекает в газовой фазе, то
P=CRT и C= RT/P тогда при изменении стандарта константу скорости в единицах концентрации следует пересчитать по формуле
kр[1/(атмn-1·время)] = kс [(л/моль)n- 1/время]*(RT)1-n ,
где R = 0,082 л·атм/(моль·К)
Расчет энтальпии
активации
• Для реакции в газовой фазеHo = Е − nRT,
где - n равно числу молекул, образующих активированный комплекс в газовой фазе.
• Для реакции в растворе n = 1 и Ho = Е
−RT
•Величину Ho можно рассчитать непосредственно из экспериментальных данных без вычисления Еа:
•ln(k1*T2/k2*T1) = - Ho /R*(1/T1 -1/T2)
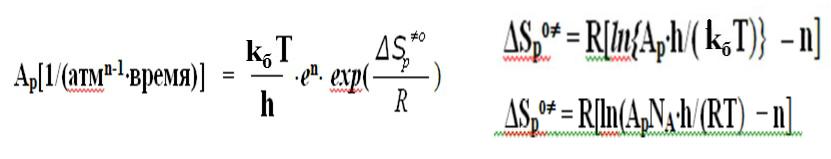
Расчет изменения энтропии
Рассчитаем величину энергии активации Еа по уравнению
• |
ln(k1/k2) = - Еа/R*(1/T1 -1/T2) или графически в |
|
|
координатах lnki |
= f(1/Ti) ) |
Для любой температуры , зная Ea найдем А: |
||
|
k = A*exp(-Ea/RT) из логарифмического уравнения: |
|
|
lnk = lnA -Ea/RT |
lnA = lnk +Ea/RT |
•В таком случае предэкспонент уравнения Аррениуса можно представить в виде :
•Для реакции в газовой фазе Ар

Расчет изменения энтропии
• Для реакции в растворе
Для реакции в растворе ΔSco при
условии , что n =1
ΔSco = R[ln(Ас·hNA/RT) − 1]
(Сº=1моль/л)
Пример экзаменационной задачи
•Для реакции разложения в растворе диазосоединения СН3N NCH3 при двух температурах следующие данные :
k =0,528*10-4 |
с-1 |
при |
T = 495K |
k =5,091*10-4 |
с-1 |
при |
T = 523K |
•Найдите Еа и А, H , S при температуре T = 495K и Сº=1моль/л и оцените значение стерического фактора (р)
Решение
E RT1T2 ln k2 / k1 T2 T1
Еa = 8,314*495*523*ln(5,091*10-4/0,528*10-4)/( 523 - 495) = 174198,47 Дж/моль
lnА = ln k + Ea/RT = - 9,849 + 174198,47 /495*8,314 = - 6,905+42,328 =32,45
Ас = 1,275 *1014 с-1
Ho = Еа − RT =170083,03 Дж/моль
h = 6,62*10-34 Дж/К; NA = 6,02*1023 1/моль ΔSco = R[ln(Ас·hNA/RT) − 1] =
= 8,314[ln(1,275 *1014 *6,62*10-34* 6,02*1023/8,314*495)
– 1]= 12,36 Дж/моль*K при Сo= 1моль/л Реакция близка к нормальной ΔSco 0
р = ехр(ΔSco /R) = ехр(12,36 /8,314) ~ 4,42
