
- •Теории химической кинетики
- •Теория активных
- •Кинетическая теория газов
- •Кинетическая теория газов
- •Основные положения ТАС
- •Основные факторы протекания реакции
- •Сравнение скоростей реакций, рассчитанных по опытным данным, показывает, что в большин- стве случаев
- •Основные факторы протекания реакции
- •Понятие о столкновении частиц
- •Вывод уравнения
- •Параметры столкновения
- •Параметры
- •Расчет приведенной
- •Выражение для
- •Для одноименных частиц
- •Эффективный диаметр столкновения
- •Анализ уравнения для скорости
- •Анализ
- •Анализ
- •Классификация
- •• Размерность
- •Пример экзаменационной задачи
- •Пример
- •Недостатки и достоинство ТАС
- •Примеры мономолекулярной реакции
- •Кинетические особенности мономолекулярной реакции
- •Предсказательная сила
- •Теория Линдемана 1922
- •Анализ уравнения
- •Тримолекулярные
- •Кинетические особенности тримолекулярной реакции
- •Кинетическое
- •Выводы
- •Выводы
- •Теория активированного комплекса (ТАК)
- •Поверхность потенциальной энергии (ППЭ)
- •Кривая потенциальной энергии и ППЭ
- •Классификация
- •Основные положения ТАК
- •Поверхность потенциальной
- •Выражение для скорости реакции
- •Методы приближенного описания кинетики сложных реакций
- •Основные факторы протекания реакции в ТАК
- •Термодинамический
- •Термодинамический
- •Выводы
- •Выводы
- •Сравнение Еа с
- •Выводы
- •Энтропийный фактор
- •Расчетные выражения
- •Расчетные выражения
- •Расчет энтальпии
- •Расчет изменения энтропии
- •Расчет изменения энтропии
- •Пример экзаменационной задачи
- •Решение
Основные положения ТАК
•АК следует рассматривать как обычную молекулу с обычными термодинамическими свойствами при одном допущении: движение вдоль координаты реакции приводит к его распаду с определенной скоростью. (qпост переходит в qкол)
•Координата реакции – это энергетически самый выгодный путь реакции с Emin в критической точке.
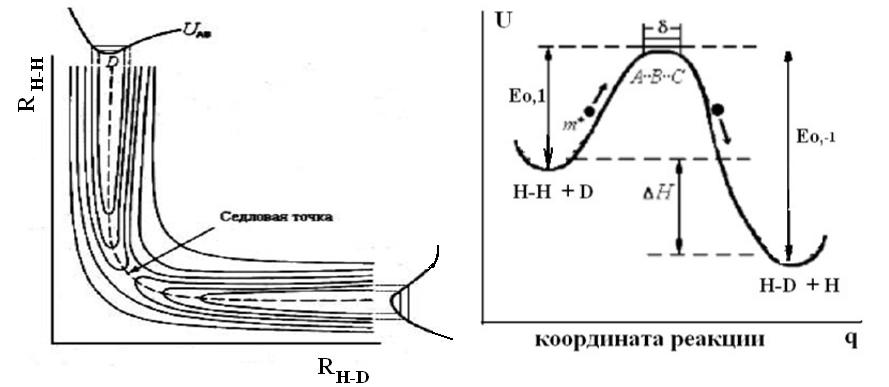
Поверхность потенциальной
кривой
• H-H + D H --H-- D H + H-D
H0 = E0,1 – E0,-1 |
Путь по |
координате реакции |
|
Выражение для скорости реакции
• Для реакции: А + В Пр
W = * C , где
= kбT/h [c-1] - частота распада АК,
эффектив-ная скорость перехода АК через энергетический барьер;
1 - трансэмиссионный коэффициент,
показывает долю АК , переходящих в продукты
Механизм реакции: А + В k1 АВ
k-1
k2
АВ Пр
Методы приближенного описания кинетики сложных реакций
•Метод квазистационарных концентраций
•Метод квазиравновесных концентраций
Механизм реакции: |
||
А + В k1 АВ |
Для получения |
|
конечного |
k-1 |
уравнения |
применим |
||
k2 |
Пр |
МКРК |
АВ |
|
|
Основные факторы протекания реакции в ТАК
•Элементарный акт реакции происходит адиабатически, т.е. ядра движутся независимо от движения электронов. Потенциальная энергия U при движении ядер изменяется непрерывно и является функцией межъядерных расстояний
•Исходные вещества и активированный комплекс находится в состоянии равновесия
•Протекание реакции распада активирован- ного комплекса не смещает равновесие в первой стадии

Термодинамический
• W = r2 = k2C ABподход
• K 1 = C AB / CACB |
C AB = K1CACB |
•W = k2C AB = k2K 1CACB
•Из термодинамики
•G0 = H0 - Т S0 = -RTlnK 1
K1 = =
В теории ТАК
K 1= =

Термодинамический
подход
•K 1=
•W = k2C AB = k2K 1CACB = k2 CACB
•Сравним с W = * C , отсюда
k2 = * = kбT/h и
окончательно:
W = (kбT/h) CACB
Для простой реакции
А + В Пр W = k* CACB

Выводы
•
1.Для бимолекулярной реакции получили в ТАК уравнение скорости второго порядка.
Физический смысл порядка реакции это количество молекул, участвующих в образовании активированного комплекса
2. Сравним выражения: k = (kбT/h) k = A*
Они совпадают еслии тогда A = (kбT/h)
( Более точно: , где
n – молекулярность реакции)

Выводы
• Более точно: , где
n – молекулярность реакции
•Для мономолекурных реакции и реакций в растворе n = 1
•Для реакций в газовой фазе, например,
А+ В Пр n = 2
(ТАК) A = (kбT/h) |
= *Атеор |
Атеор = (kбT/h) = |
- частота распада |
АК |
|
(ТАС) А = рАтеор Отсюда р
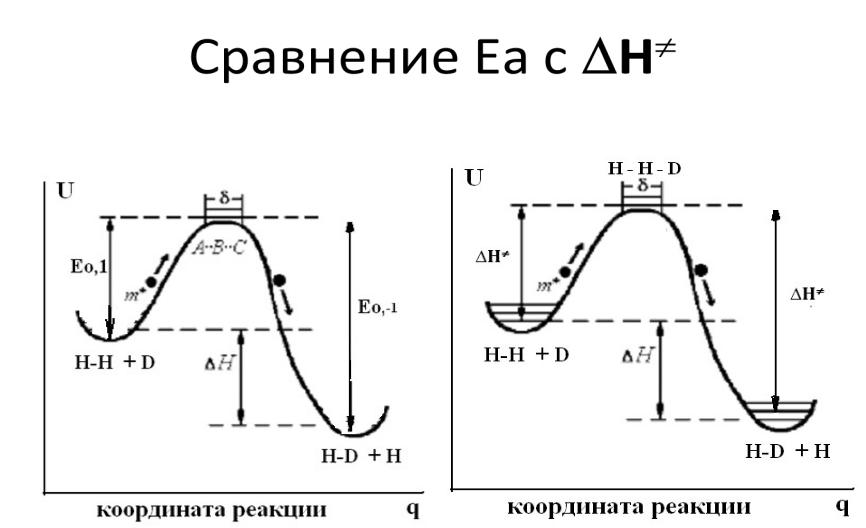
Сравнение Еа с
Ea = H + nRT
