
- •Вариант № 22
- •47. Гальванические элементы составлены по схемам:
- •72. При электролизе одного из соединений олова ток силой в 10 а за 3 мин выделил на электродах металл массой 0,554 г и хлор объемом 209 мл (н.У.). Найдите формулу этого соединения.
- •122. При растворении в кислоте 5,00 г СаО, содержащего примесь CaCo3, выделилось 140 мл газа, измеренного при н.У. Сколько процентов CaCo3 (по массе) содержалось в исходной навеске?
- •147. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Al Al2(so4)3 Na[Al(oh)4] Al(no3)3.
- •272. Определите температуру затвердевания и плавления сплава, содержащего 60% Ni и 40% Cu. Диаграмма плавкости на рисунке 7.
72. При электролизе одного из соединений олова ток силой в 10 а за 3 мин выделил на электродах металл массой 0,554 г и хлор объемом 209 мл (н.У.). Найдите формулу этого соединения.
Решение:
|
Дано: I = 10А t = 3 мин = 180 с m (Sn) = 0.554 г V(Cl2) = 209 мл = 0.209 л |
Решение: Согласно закону Фарадея:
где: m — масса осаждённого на электроде вещества в граммах Q — полный электрический заряд, прошедший через вещество (Q = I·t = 10·180 = 1800 Кл) F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль) z — валентное число ионов вещества (число электронов на один ион). Заметим, что M/z — это эквивалентная массаосаждённого вещества. Из этой формулы вычислим эквивалентную массу осажденного вещества: M/z
=
Тогда валентное число ионов вещества равно: Z = M/29.7 = 119/29.7 = 4 Таким образом, в процессе электролиза участвует 4 электрона, значит, степень окисления олова + 4: Sn+4 + 4e → Sn0 В этом случае, формула соединения SnCl4. |
|
Найти: SnxCly = ? |
Ответ: SnCl4 |
97. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Протекает коррозия обеих пластинок
Цинковая пластина:
Zn + CuSO4 → Cu↓ + ZnSO4
Zn0 - 2e → Zn2+
Cu2+ + 2e → Cu0
Железная пластина:
Fe + CuSO4 → Cu↓ + FeSO4
Fe0 - 2e → Fe2+
Cu2+ + 2e → Cu0
2. При замыкании пластин образуется гальванический элемент.
Электродные потенциалы металлов пластинок:
φо(Fe2+/ Fe0) = − 0,44 В
φо(Zn 2+/ Zn 0) = − 0,763 В
Т.к. E0Zn2+/Zn < E0Fe2+/Fe, железо будет катодом, а цинк - анодом.
Процессы на электродах
A: Zn0 - 2e → Zn2+ - окисление цинка (цинковая пластинка растворяется)
К: Cu2+ + 2e → Cu0 – восстановление (выделяется на железной пластинке)
122. При растворении в кислоте 5,00 г СаО, содержащего примесь CaCo3, выделилось 140 мл газа, измеренного при н.У. Сколько процентов CaCo3 (по массе) содержалось в исходной навеске?
Решение:
|
Дано: m (СаО+СаСО3) = 5.00 г V(CO2) = 140 мл = 0.140 л |
Решение: С кислотой будут взаимодействовать 2 компонента смеси: СаО+2HCl→ CaCl2 + H2O СаСО3 +2HCl→ CaCl2 + H2O + CO2↑ Вычислим массу углекислого газа, который выделяется, по формуле:
m(CO2)
=
вычислим массу карбоната кальция по уравнению реакции: m
(CaCO3)
=
Вычислим массовую долю карбоната кальция по формуле: ω(CaCO3)
=
|
|
Найти: ω(CaCO3) = ? |
Ответ: ω(CaCO3) = 12.5 %/ |
147. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Al Al2(so4)3 Na[Al(oh)4] Al(no3)3.
Решение:
Уравнения химических реакций:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Al2(SO4)3 + 8NaOH → 2Na[Al(OH)4] + 3Na2SO4
Na[Al(OH)4] + 4HNO3 → NaNO3 + Al(NO3)3 + 4H2O
172.
Карбонил никеля может быть получен при
действии оксида углерода на тонкодисперсный
порошок металла. Процесс может быть
выражен уравнением Ni (Т)
+ 4CO (Г)
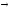 [Ni(CO)4]
(Г)
[Ni(CO)4]
(Г)
Какой объем займет тетракарбонил никеля, если в реакцию вступило 23,48 г никеля, а производственные потери составили 10%?
Решение:
|
Дано: m (Ni) = 23.48 г α = 10% |
Решение: Процесс выражен уравнением реакции: Ni
(Т)
+ 4CO
(Г)
Вычислим массу никеля, который вступил в реакцию с учётом производственных потерь: 23,48 г – 100% Х г – 10% Х = 10%·23.48 г/100% = 2.348 (г) То есть потери составили 2.348 г. Таким образом, массу вступившего в реакцию никеля равна: m(Ni) = 23.48 – 2.348 = 21.132 (г) По приведенному уравнению реакци вычислим массу карбонила никеля: 21.132 г Х г Ni
(Т)
+ 4CO (Г)
59 59+4·(12+16) = 171 Х = 21.132·171/59 = 61.25 (г) Переведем вычисленную массу в объём:
|
|
Найти: V([Ni(CO)4]) = ? |
Ответ: V([Ni(CO)4]) = 8.02 л. |
197.
Какие комплексные ионы входят в состав
солей: K2PtCl6;
KAu(CN)4;
CrCl3 5H2O;
K4Fe(CN)6;
KAu(CN)2;
CoCl3
5H2O;
K4Fe(CN)6;
KAu(CN)2;
CoCl3 6NH3,
если комплексообразователями в них
являются ионы Pt4+;
Au3+;
Cr3+;
Fe2+;
Au+
и Co3+.
Составьте
уравнения диссоциации этих солей.
6NH3,
если комплексообразователями в них
являются ионы Pt4+;
Au3+;
Cr3+;
Fe2+;
Au+
и Co3+.
Составьте
уравнения диссоциации этих солей.
Решение:
K2[PtCl6]
Комплексный ион - [PtCl6]2-
Уравнение диссоциации:
K2[PtCl6] ↔ 2К+ + [PtCl6]2-
K[Au(CN)4]
Комплексный ион - [Au(CN)4]-
Уравнение диссоциации:
K[Au(CN)4] ↔ К+ + [Au(CN)4]-
CrCl3
 5H2O
5H2O
Комплексный ион – [Cr(H2O)5]3+
Уравнение диссоциации:
[Cr(H2O)5]Cl3 ↔ [Cr(H2O)5]3+ + 3Cl-
K4 [Fe(CN)6]
Комплексный ион - [Fe(CN)6]4-
Уравнение диссоциации:
K4 [Fe(CN)6] ↔ 4К+ +[Fe(CN)6]4-
K[Au(CN)2]
Комплексный ион - [Au(CN)2]-
Уравнение диссоциации:
K[Au(CN)2]↔К+ + [Au(CN)2]-
CoCl3
 6NH3
6NH3
Комплексный ион – [Co(NH3)6]3+
Уравнение диссоциации:
[Co(NH3)6]Cl3 ↔ [Co(NH3)6]3+ + 3Cl-
222. Напишите уравнение реакции поликонденсации карбамида с уксусным альдегидом исходя из того, что с каждыми 3 моль карбамида вступают в реакцию 2 моль альдегида. Рассчитайте массу смолы, которая получится, если в реакции участвуют 15 кг карбамида и 12 кг альдегида.
Решение:
Запишем для начала уравнение реакции поликонденсации:
15000 г х г
3(NH2)2C=O + 2H2C=O → H2NCONHCH2NHCONHCH2NHCONH2 + 2H2O
3·М(NH2)2C=O= 2·(2+12+16)= 60
= 3·(28+4+12+16) =
= 180
Определим, какое из веществ – в избытке, а какое – в недостатке.
Решим пропорцию:
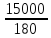 =
=

Х = 15000·60/180 = 5000 (г) = 5(кг).
Таким образом, альдегид дан в избытке. Выичслим массу смолы, используя массу альдегида, по уравнению реакции:
12000 г y г
3(NH2)2C=O + 2H2C=O → H2NCONHCH2NHCONHCH2NHCONH2 + 2H2O
2·(2+12+16)= 60 6·14+12·1+5·12+3·16 = 204
Решим пропорцию:
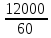 =
=
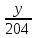
Y = 12000·204/60 = 40800 (г) = 40.8 (кг).
Масса образовавшейся смолы mсмолы = 40.8 кг.
Ответ: mсмолы = 40.8 кг.
247.
Жженый гипс mСаSО4 nH2O
готовят из обычного гипса xСаSО4
nH2O
готовят из обычного гипса xСаSО4 yH2O
выдерживанием последнего при 1300С.
По данным анализа образец гипса содержит
20,9% (по массе) воды, а образец жженого
гипса - только 6,2%. Установите
химический состав обоих кристаллогидратов.
yH2O
выдерживанием последнего при 1300С.
По данным анализа образец гипса содержит
20,9% (по массе) воды, а образец жженого
гипса - только 6,2%. Установите
химический состав обоих кристаллогидратов.
Решение:
|
Дано: ω(yH2O)= 20.9% ω(nH2O)= 6.2% |
Решение: Вычислим массовую долю сульфата кальция в обычном гипсе: ω(xCaSO4) = 100% - 20.9% = 79.1 (%) Массовая доля сульфата кальция в жженом гипсе: ω(mCaSO4) = 100% - 6.2% = 93.8 (%) Вычислим соотношение коэффициентов в обычном гипсе: Х:Y
=
То есть химичесий состав обычного гипса: СаSО4 Проведем аналогичные расчёты для жжёного гипса: m:n
=
То есть химичесий состав жжёного гипса: СаSО4 |
|
Найти: mСаSО4 xСаSО4 |
Ответ: СаSО4 СаSО4 |

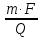 =
=
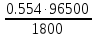 = 29.7
= 29.7 =
=
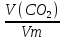
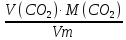 =
=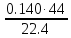 = 0.275 (г)
= 0.275 (г)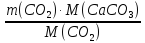 =
= = 0.625 (г)
= 0.625 (г)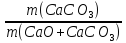 ·100%
=
·100%
=
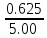 ·100%
= 12.5 (%)
·100%
= 12.5 (%) [Ni(CO)4]
(Г)
[Ni(CO)4]
(Г)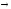 [Ni(CO)4]
(Г)
[Ni(CO)4]
(Г)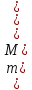 =
=
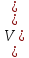
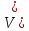 =
=
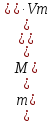 =
=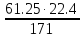 = 8.02(л)
= 8.02(л) :
:
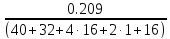 = 0.005: 0.001 = 5:1
= 0.005: 0.001 = 5:1 5H2O
5H2O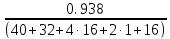 :
:
 = 0.006: 0.0004 = 15:1
= 0.006: 0.0004 = 15:1 15H2O
15H2O nH2O
= ?
nH2O
= ? yH2O
= ?
yH2O
= ? 5H2O;
5H2O;
 15H2O.
15H2O.