
- •Вариант № 22
- •47. Гальванические элементы составлены по схемам:
- •72. При электролизе одного из соединений олова ток силой в 10 а за 3 мин выделил на электродах металл массой 0,554 г и хлор объемом 209 мл (н.У.). Найдите формулу этого соединения.
- •122. При растворении в кислоте 5,00 г СаО, содержащего примесь CaCo3, выделилось 140 мл газа, измеренного при н.У. Сколько процентов CaCo3 (по массе) содержалось в исходной навеске?
- •147. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Al Al2(so4)3 Na[Al(oh)4] Al(no3)3.
- •272. Определите температуру затвердевания и плавления сплава, содержащего 60% Ni и 40% Cu. Диаграмма плавкости на рисунке 7.
Вариант № 22
22.
В кислый раствор, содержащий смесь солей
Kcl,
Kbr
и KJ
добавлено достаточное количество KNO2.
Записать редокси-цепи, выражающие
взаимодействие NO2-иона
с каждым по отдельности галогенид-ионом
(один из электродов NO + 2H+/NO
+ H2O).
Сопоставлением электродных потенциалов
установить, какой из галогенид-ионов
будет окисляться до свободного состояния
и какие не будут. Для окисляющегося
галогенид-иона написать молекулярное
уравнение реакции.
+ 2H+/NO
+ H2O).
Сопоставлением электродных потенциалов
установить, какой из галогенид-ионов
будет окисляться до свободного состояния
и какие не будут. Для окисляющегося
галогенид-иона написать молекулярное
уравнение реакции.
Решение:
Редокси-цепи, выражающие взаимодействие NO2-иона с каждым по отдельности галогенид-ионом:
К(-) NO
 + 2H+
+
1е →NO
+ H2
O
(Согласно табличным данным, Е0(NO2-/NO)
= +1.2 B
+ 2H+
+
1е →NO
+ H2
O
(Согласно табличным данным, Е0(NO2-/NO)
= +1.2 B
А(+) 2Cl - -2e → Cl20 (E0(2Cl-/Cl2) = +1.36 В)
Вычислим значение ЭДС по формуле:
Е = Ек-Еа = 1.2 – 1.36 = -0.16 (В). Так как ЭДС меньше 0, то реакция самопроизвольно не протекает, то есть идёт в обратном направлении. Значит, хлорид-ион окисляться до свободного хлора не будет.
К(-) NO
 + 2H+
+
1е →NO
+ H2
O
(Согласно табличным данным, Е0(NO2-/NO)
= +1.2 B
+ 2H+
+
1е →NO
+ H2
O
(Согласно табличным данным, Е0(NO2-/NO)
= +1.2 B
А(+) 2Br - -2e → Br20 (E0(2Br-/Br2) = +1.087 В)
Вычислим значение ЭДС по формуле:
Е = Ек-Еа = 1.2 – 1.087 = +0.113 (В). Так как ЭДС больше 0, то реакция самопроизвольно протекает, то есть идёт в прямом направлении. Значит, бромид-ион может окисляться до свободного брома.
К(-) NO
 + 2H+
+
1е →NO
+ H2
O
(Согласно табличным данным, Е0(NO2-/NO)
= +1.2 B
+ 2H+
+
1е →NO
+ H2
O
(Согласно табличным данным, Е0(NO2-/NO)
= +1.2 B
А(+) 2I - -2e → I20 (E0(2I-/I2) = +0.536 В)
Вычислим значение ЭДС по формуле:
Е = Ек-Еа = 1.2 – 0.536 = +0.664 (В). Так как ЭДС больше 0, то реакция самопроизвольно протекает, то есть идёт в прямом направлении. Значит, йодид-ион может окисляться до свободного йода (процесс окисления проходит быстрее, чем окисление брома).
47. Гальванические элементы составлены по схемам:
а) Fe3+/Fe2+ || Ag+/Ag;
б)
ClO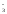 + 6H+/Cl–
+ 3H2O
|| 2J–/J2.
+ 6H+/Cl–
+ 3H2O
|| 2J–/J2.
Рассчитайте ЭДС этих элементов при стандартных условиях и найдите изменение энергии Гиббса протекающих в них реакций, уравнения которых напишите в ионно-молекулярной и молекулярной формах.
Ответ:
а)Запишем процессы, протекающие на электродах:
К(-) Ag+1 +1e → Ag0 (Е0 = +0.799 В)
A(+) Fe+2 - 1e → Fe+3 (Е0 = +0.77 В)
Для расчёта ЭДС воспользуемся формулой:
Е = Ек-Еа = 0.799 – 0.77 = 0.029 (В)
Для вычисления изменения энергии Гиббса запишем уравнения в ионно-молекулярной и молекулярной формах:
Fe+2 + Ag+1 → Ag0 + Fe+3
Fe(NO3)2 + AgNO3 → Ag + Fe(NO3)3
Согласно справочным данным, ΔG°298 (Ag) = 0 ккал/моль; ΔG°298 (Fe(NO3)2) = -72.2 ккал/моль; ΔG°298 (Fe(NO3)3) = -81.09 ккал/моль; ΔG°298 (AgNO3) = -8.24 ккал/моль.
Тогда ΔG реакции равен:
ΔGр-ции = ΣΔGпрод. – ΣΔGреаг. = (ΔG°298 (Ag) + ΔG°298 (Fe(NO3)3) – (ΔG°298 (Fe(NO3)2) + ΔG°298 (AgNO3)) = (0+(-81.09)) – (-72.2 + (-8.24)) = -0.65 (ккал).
Так как ΔGр-ции<0, значит реакция протекает самопроизвольно (в прямом направлении).
б) Запишем процессы, протекающие на электродах:
К(-)
ClO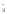 + 6H+
+
6е →
Cl–
+ 3H2O
(Е0
=
+1.45 В)
+ 6H+
+
6е →
Cl–
+ 3H2O
(Е0
=
+1.45 В)
A(+) 2I- - 2e → I20 (Е0 = +0.536 В)
Для расчёта ЭДС воспользуемся формулой:
Е = Ек-Еа = 1.45 – 0.536 = 0.914 (В)
Для вычисления изменения энергии Гиббса запишем уравнения в ионно-молекулярной и молекулярной формах:
ClO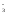 + 6H+
+
2I-→
I20
+ Cl–
+ 3H2O
+ 6H+
+
2I-→
I20
+ Cl–
+ 3H2O
KClO + 3H2SO4
+
6KI→
3I20
+ KCl
+ 3H2O
+ 3K2SO4
+ 3H2SO4
+
6KI→
3I20
+ KCl
+ 3H2O
+ 3K2SO4
Согласно
справочным
данным,
ΔG°298
(I2)
= 0 ккал/моль;
ΔG°298
(KCl)
= -98.9 ккал/моль;
ΔG°298
(H2O)
= -56.7 ккал/моль;
ΔG°298
(K2SO4)
= -313.3 ккал/моль;
ΔG°298
(KClO )
= -67.7 ккал/моль;
ΔG°298
(H2SO4)
= -217.3 ккал/моль;
ΔG°298
(KI)
= -79.9 ккал/моль.
)
= -67.7 ккал/моль;
ΔG°298
(H2SO4)
= -217.3 ккал/моль;
ΔG°298
(KI)
= -79.9 ккал/моль.
Тогда ΔG реакции равен:
ΔGр-ции
= ΣΔGпрод.
– ΣΔGреаг.
= (3· ΔG°298
(I2)
+ ΔG°298
(KCl)
+ 3· ΔG°298
(H2O)
+ 3· ΔG°298
(K2SO4))
– (ΔG°298
(KClO ))
+ 3· ΔG°298
(H2SO4)
+ 6· ΔG°298
(KI))
= (3· 0 + (-98.9) + 3· (-56.7) + 3· (-313.3)) – (-67.7) + 3·
(-217.3) + 6· (-79.9)) = -9.9 (ккал).
))
+ 3· ΔG°298
(H2SO4)
+ 6· ΔG°298
(KI))
= (3· 0 + (-98.9) + 3· (-56.7) + 3· (-313.3)) – (-67.7) + 3·
(-217.3) + 6· (-79.9)) = -9.9 (ккал).
Так как ΔGр-ции<0, значит реакция протекает самопроизвольно (в прямом направлении).
