
- •Цель и задачи курса
- •Содержание курса и рабочая программа
- •Выполнение контрольной работы
- •Требования к оформлению контрольной работы:
- •Лабораторный практикум
- •Методические указания.
- •Основные понятии и определения [ 1 ] Введение, § 3
- •Раздел 1. Основы химической термодинамики [ 1 ] Глава 5
- •1.1. Основные понятия и определения
- •1.2. Характеристики термодинамической системы
- •1.3. Первое начало термодинамики. Энтальпия.
- •1.4. Теплота (тепловой эффект) реакции. Закон Гесса.
- •1.5. Второе начало термодинамики. Энтропия.
- •1.6. Возможность, направление и предел самопроизвольного протекания процесса
- •Раздел 2. Основы химической кинетики и равновесия. [ 1 ], Глава 6,7
- •Химическая кинетика.
- •2.2. Химическое равновесие
- •Раздел 3. Растворы [ 1 ] Глава 8
- •3.1 Равновесия в водных растворах электролитов.
- •Водородный показатель.
- •Реакция нейтрализации
- •Гидролиз солей
- •Раздел 4. Строение атома и учение о периодичности свойств химических элементов и соединений. [ 1 ] Главы 1,2
- •Основы современных представлений о строении атома
- •Построение периодической системы элементов и периодический закон
- •Валентные возможности элементов
- •Раздел 5. Основы электрохимии. Окислительно-восстановительные реакции. [ 1 ] Главы 9,10
- •Основные понятия, определения и соотношения
- •Составление уравнений реакций окисления-восстановления
- •Коррозия металлов.
- •Стандартные окислительно-восстановительные потенциалы
- •Стандартные окислительно-восстановительные потенциалы
- •Задачи 2.10-2.19
- •Задачи 3.30-3.39
- •Задачи 4.10-4.19.
- •Задачи5.20-5.29.
- •Приложения термодинамические свойства веществ в стандартном состоянии
Построение периодической системы элементов и периодический закон
Именно «послойное» строение электронных оболочек атомов и объясняет периодическое изменение физических и химических свойств химических элементов.
Пользуясь правилами квантовой механики, легко понять построение периодической системы элементов. Так, номер периода, в котором расположен элемент, соответствует значению главного квантового числа n. Номер группы – количеству элементов электронов во внешнем (валентном) слое (уровне), которое определяет валентные возможности атомов элементов. Номер элемента в таблице Д.И.Менделева – это заряд его атомного ядра и соответственно общее число электронов в атоме.
Таблица 4
|
№ периода |
Квантовые числа |
Строение внешнего электронного слоя (валентного) |
Электронные формулы элементов периода | |||
|
n |
1 |
m | ||||
|
|
|
|
Число значений m=2n+1 |
значения | ||
|
I |
1 |
0 |
1 |
0 |
1S □ |
H: 1S1 He: 1S2 |
|
II |
2 |
0 1 |
1 3 |
0 -1;0;+1 |
2S □ 2p □□□ |
Li: 1S22S1 Be: 1S22S2 B: 1S22S22p1 C: 1S22S22p2 N: 1S22S22p3 F: 1S22S22p5 Ne: 1S22S22p5 |
|
III |
3 |
0 1 2 |
1 3 5 |
0 -1;0;+1 -2;-1;0;+1;+2 |
3S □ 3p □□□ 3d □□□□□ |
Na: 1S22S22p63S1 Mg: 1S22S22p63S2 Al: 1S22S22p63S23p1………..Ar: 1S22S22p63S23p6 заполняетсяв 4 периоде |
|
IV |
4 |
0 1 2 3 |
1 3 5 7 |
0 -1;0;+1 -2;-1;0;+1;+2 -3;-2;-1;0;+1;+2;+3 |
4S □ 4p □□□ 4d □□□□□ 4f □□□□□□□ |
K: 1S22S22p63S23p64S1 Ca: ………………….3p64S2 Sc: …. 4S23d1 ………………… Zn: …………………4S23d10 Ga: ….4S23d104p1 ………….. Kr: …………………. 4S23d104p6 заполняется в 5 периоде заполняется в 6 периоде |
В таблице 4 показано строение внешнего внешнего электронного слоя для элементов с I по IV период периодической системы элементов (Η-Кг). В III периоде возникший разрешенный подуровень 3d остается не заполненным, а электроны начинают заселять его лишь после заполнения подуровня 4S.Происходит это в полном соответствии с правилами Клечковского. Так, сумма (n+1) для 3d и 4S n+1=4+0=4. В этом случае первым заселяется подуровень с большим значением n , т.е. 4S. По той же причине подуровень 4f начинает заселяться лишь в VI периоде (лантаноиды).
Валентные возможности элементов
Валентность – количество химических связей, которые образует данный элемент с другими, входящими в состав рассматриваемого химического соеденения.
Вопрос об оценке валентных возможностей атомов, т.е. количества электронов в атоме, способных принять участие в образовании химических связей, является весьма сложным и лежит в области квантовой механики, связанной с расчетами энергии электронов и межуровневых переходов.
 В
настоящее время считается, что валентные
возможности атомов определяются числом
неспаренных электронов, которые могут
образоваться на валентном энергетическом
уровне. Образование неспаренных
электронов связано с переводом атома
в так называемое «возбужденное» состояние
из «основного», в котором электроны
распределены по атомным орбиталям в
соответствии с принципом наименьшей
энергии и правилом Гунда.
В
настоящее время считается, что валентные
возможности атомов определяются числом
неспаренных электронов, которые могут
образоваться на валентном энергетическом
уровне. Образование неспаренных
электронов связано с переводом атома
в так называемое «возбужденное» состояние
из «основного», в котором электроны
распределены по атомным орбиталям в
соответствии с принципом наименьшей
энергии и правилом Гунда.
![]()
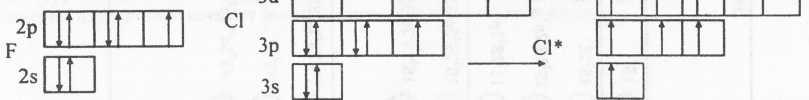
Такой переход возможен не для всех атомов, так как он требует наличия свободныхразрешенных квантовых состояний (или орбиталей). Сравним валентныевозможностиэлектронных аналогов фтора и хлора. Строение их внешнего электронного слоя в невозбужденном (основном) состоянии совершенно одинаково. Разница лишь в том, что во внешнем слое у фтора существует только2разрешенных подуровня (n= 2;I= 0,1):2sи2р , а хлора - -3 (n=3;I=0,1,2) :3s, Зpи 3d:
У атома фтора валентный уровень содержит один неспаренный электрон и иная электронная конфигурация невозможна из-за отсутствия свободных орбиталей. Поэтому фтор проявляет только одну валентность, равную I. Наличие во внешнем слое хлора свободного 3d-подуровня дает возможность перехода электронов с 3s и Зр на 3d. Это создает дополнительные валентные возможности для атома. Хлор проявляет кроме 1 еще и валентности 3, 5 и 7.
Обобщая многочисленные экспериментальные данные и результаты квантовомеханических расчетов, можно предложить некоторые рекомендации, облегчающие оценку валентных возможностей различных элементов (таблица 5).
Таблица 5
|
№ группы |
Валентные электроны |
Значения валентности |
Элементы, проявляющие данные значения валентности |
Примеры химических соединений |
|
I |
s |
1 |
Все элементы группы I |
NaCl; K2SО4; AgCl; AuCl |
|
|
s, d |
2,3 |
Сu, Ag, Аu |
CuSО4; AgO; AuCI3 |
|
II |
s |
2 |
Все элементы группы II |
MgCl2; Hg2Cl2(Cl-Hg-Hg-CI) |
|
III |
P |
1 |
In; Т1 |
InCl; TINO3 |
|
|
s,p |
3 |
В; Al; Ga; In; Τl |
AlCl3; Ga2O3 |
|
|
s,d |
3 |
Sc, Y, лантаноиды |
Sc2O3 |
|
|
s |
2 |
лантаноиды |
CeO |
|
|
s, f |
4,5,6,7 |
актиноиды |
vo3 |
|
IV |
P |
2 |
Все элементы главной подгруппы |
CO; SiO; PbO |
|
|
s,p |
4 |
|
CO2; SiO2; GeO2 |
|
|
s |
2 |
Ti; Zr; Hf |
TiO |
|
|
s, d |
4 |
|
ТiO2 |
|
V |
P |
1,2,3 3 |
N Все элементы главной подгруппы |
N2O; NO; N2O3 P2O3 |
|
|
s,p |
4,5 5 |
N Все элементы главной подгруппы |
no2 HNO3; KBiO3 |
|
|
s |
2 |
V |
VO |
|
|
s, d |
3.4 3.5 5 |
V Nb Та |
V2O3; VO2 Nb2O3;Nb2O5 Ta2O5 |
|
VI |
Р |
2 |
O, S, Se, Те |
H20; H2S |
|
|
|
4 |
S, Se, Те |
SO2 |
|
|
s,p |
6 |
S, Se, Те |
H2SO4 |
|
|
S |
2 |
Cr, Mo, W |
|
|
|
s, d |
3 |
Cr, Mo |
Cr2O5 |
|
|
|
4,5 |
Mo, W |
MoO2; W2O5 |
|
|
|
6 |
Cr, Mo, W |
K2Cr2O7; M0O3 |
|
VII |
Р |
1 |
F, Cl, Br, I |
HCl; HF |
|
|
s,p |
3, 5,7 |
Cl, Br, I |
HClO2; HBrO3; HClO4 |
|
|
s |
2 |
Mn |
MnO |
|
|
s. d |
3,4,6,7 |
Mn, Re |
Mn2O3; MnO2; H2MnO4 |
|
|
|
|
|
KMnO4 |
|
VIII |
s |
2 |
Fe, Co, Ni, Pd, Pt |
FeO; CoCl2 |
|
|
s, d |
3 |
Fe, Co, Ni |
Ni2O3; FeCl3 |
|
|
|
4 |
Pd, Pt |
PtCl4 |
|
|
|
6 |
Fe, Pt |
K2Fe04; PtF6 |
|
|
|
8 |
Os |
OsO4 |
|
|
P |
2,4 |
Kr, Xe |
KrF2; XeF4 |
|
|
|
6 |
Xe |
XeF6; Xe03 |
