
Журнал неврологии и психиатрии / 2010 / NEV_2010_06_012
.pdf
КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Наследственная спастическая параплегия типа 4 (SPG4): клинические и молекулярно-генетические характеристики
Д.м.н. Г.Е. РУДЕНСКАЯ1, И.Г. СЕРМЯГИНА1, д.м.н., проф. С.Н. ИЛЛАРИОШКИН2, д.м.н. О.П. СИДОРОВА3, к.м.н. В.П. ФЕДОТОВ4, д.м.н., проф. А.В. ПОЛЯКОВ1
Hereditary spastic paraplegia type 4 (SPG4): clinical and molecular-genetic characteristics
G.E. RUDENSKAYA, I.G. SERMYAGINA, S.N. ILLARIOSHKIN, O.P. SIDOROVA, V.P. FEDOTOV, A.V. POLYAKOV
1Медико-генетический научный центр РАМН; 2Научный центр неврологии РАМН; 3Московский областной научно-исследовательский
клинический институт; 4Воронежская межобластная медико-генетическая консультация
Наиболее частая форма наследственных спастических параплегий (НСП) — тип 4 (SPG4), обусловленная мутациями в гене спастина (SPAST). Представлены первые российские случаи SPG4, верифицированные анализом ДНК. Поиск мутаций SPAST проведен в 26 семьях с аутосомно-доминантной НСП из различных российских регионов; использован метод SSCP с последующим секвенированием экзонов с измененной электрофоретической подвижностью. В трех больших семьях проведен также анализ сцепления с локусом SPAST с использованием маркеров D2S352 и D2S367, в двух семьях сцепление подтвердилось. В шести семьях найдены различные мутации SPAST; 3 мутации — Arg431Stop, Gln280Arg FsX9 и Asn386Ser — известны, 3 другие — Asp555Tyr, Thr369Thr и Asn184Thr — ранее не описаны. В семье с мутацией Arg431Stop имелось сцепление с локусом SPG4 (lod-баллы 1,66 для D2S352 и 1,51 для D2S367). В другой семье со сцеплением (lod-баллы 1,68 и 2,17 соответственно) мутация не найдена, что не противоречит диагнозу SPG4, так как существуют атипичные мутации SPAST (крупные делеции и др.), не выявляемые рутинными методами ДНК-анализа. С учетом этой семьи доля SPG4 в выборке составила 27%, что меньше средних данных литературы (40—45%). Большинство обследованных больных имели характерную клиническую картину: «неосложненная» параплегия с относительно поздним началом. В ряде семей отмечено значительное внутрисемейное разнообразие болезни по возрасту начала; «омоложение» в младших поколениях; 1 больной с очень ранним началом SPG4 страдал также эпилепсией. В двух семьях, где были обследованы все доступные родственники, выявлен ряд случаев SPG4 c субклиническим течением даже в пожилом возрасте.
Ключевые слова: наследственная спастическая параплегия, SPG4, ДНК-диагностика, мутации гена SPAST, фенотип.
Hereditary spastic paraplegia (HSP), type 4, or SPG4, caused by various mutations in the spastin gene (SPAST) is the most common disorder in a heterogeneous group of autosomal dominant HSP’s. We performed a search of SPAST mutations by routine methods (SSCP and subsequent direct sequencing of fragments with modified electrophoretic mobility) in a sample of 26 families with autosomal dominant HSP from different Russian regions. In six families, five of Russian and one of Tatar ethnicity, different SPAST mutations were detected. Three of the mutations, Arg431Stop, Gln280Arg FsX9 and Asn386Ser, were reported previously; the remaining three, Asp555Tyr, Thr369Thr and Asn184Thr, were novel. In the family with the Arg431Stop mutation, a linkage to SPG4 locus was also established, lod scores were 1,66 for D2S352 marker and 1,51 for D2S367. Another large family also showed a linkage to the SPG4 locus (lod scores 1,68 for D2S352 и 2,17 for D2S367) but the mutation was not found which may be due to atypical SPAST mutations (large deletions etc) undetectable by routine methods of DNA analysis. Including this family, the proportion of the SPG4 in the sample is 27%, which is less than average literature data (40—45%). Most of our patients presented relatively late-onset “uncompicated” HSP, which was typical for SPG4, though different additional features in SPG4 patients were also known. One of our patients had very early-onset HSP and concomitant epilepsy. In two pedigrees, in which all available relatives were examined, some patients had mild signs of SPG4, even late in life.
Key words: hereditary spastic paraplegia, SPG4, DNA diagnostics, SPAST mutations, phenotype.
Наследственные спастические параплегии (НСП) — нейродегенеративные болезни с преимущественным поражением пирамидного тракта. Их ведущий и часто единственный клинический признак — нижний спастический парапарез, как правило, прогрессирующий. Выраженное разнообразие этой группы давно известно по клиникогенеалогическим данным. В настоящее время представления о спектре НСП принципиально расширились благодаря развитию молекулярно-генетических исследований:
число картированных генов приближается к 50, более 20 из них идентифицированы. В современной номенклатуре для локусов и соответствующих форм болезни принято обозначение SPG (Spastic Paraplegia Gene) с порядковыми номерами по хронологии картирования. Самой частой в неинбредных популяциях является SPG4 — аутосомнодоминантная (АД) форма, обусловленная мутациями в гене спастина (SPAST). Для SPG4 типичны относительно позднее начало и отсутствие сопутствующих симптомов
© Коллектив авторов, 2010 |
e-mail: gerud@ihome.ru; info@dnalab.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:6:12
12 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
|
ГЕНЕТИКА СПАСТИЧЕСКОЙ ПАРАПЛЕГИИ SPG4 |
(«неосложненная» НСП), однако накапливается все боль- |
пользовали маркеры D2S352 и D2S367. В семье Р. в анализ |
ше данных о ее клиническом разнообразии. Активно изу- |
сцепления были включены образцы ДНК 15 человек (7 |
чаются также молекулярно-генетические аспекты SPG4: |
больных, 6 здоровых кровных родственников и 2 супругов |
спектр и механизмы действия мутаций, взаимодействие |
больных), в семье К. — 22 (8 больных, 11 родственников, 3 |
спастина с другими белками, генофенотипические корре- |
супругов), в семье Я. — 9 (5 больных, 3 родственников, 1 |
ляции. ДНК-диагностика SPG4 впервые была начата в |
супруга). |
Медико-генетическом научном центре (МГНЦ) несколь- |
Результаты |
ко лет назад. |
|
Цель работы — проанализировать верифицирован- |
Сцепление с локусом SPG4 установили в семьях Р. |
ные анализом ДНК наблюдения SPG4. |
|
Материал и методы |
(рис. 1) и К. (рис. 2). В семье Р. lod-балл составил 1,66 для |
маркера D2S352 и 1,51 для D2S367, в семье К. — 1,68 и 2,17 |
|
|
соответственно; полученные величины lod-балла являют- |
Проведено клинико-генеалогическое и молекулярно- |
ся максимально возможными для данных родословных. В |
генетическое обследование группы больных с НСП и их |
семье Я. с 8 больными в 3 поколениях сцепление не най- |
семей. Выборку составили из нескольких источников: |
дено. Мутации SPAST обнаружены в 6 семьях: семье Р. и |
медико-генетическая консультация Московского област- |
5 семьях (4 русских и 1 татарской), где анализ сцепления |
ного научно-исследовательского клинического института |
не проводился из-за их недостаточного размера. Как вид- |
(МОНИКИ) предоставила учетные сведения о больных из |
но из табл. 1, все мутации встретились однократно и были |
Московской области, которые затем были обследованы в |
разнообразны по характеру: нонсенс-мутация (семья Р.), |
МГНЦ; Научный центр неврологии предоставил образцы |
три миссенс-мутации (семьи П., В. и Х.), делеция, веду- |
ДНК больных НСП из разных регионов; ряд больных или |
щая к сдвигу рамки считывания (семья Ч.), однонуклео- |
образцов ДНК направлен из региональных медико- |
тидная замена, приводящая к потере акцепторного сайта |
генетических консультаций, часть семей обратилась в |
сплайсинга и не вызывающая аминокислотной замены |
МГНЦ самостоятельно. |
(семья У.). 3 мутации известны [20], 3 ранее не описаны. В |
Для ДНК-диагностики были отобраны только семей- |
семье К. мы не обнаружили мутацию и диагностировали |
ные случаи АД. |
SPG4 на основании анализа сцепления, учитывая ограни- |
В 26 семьях был проведен поиск мутаций SPAST стан- |
ченную чувствительность метода SSCP (80—90%), а также |
дартным методом SSCP с последующим прямым секвени- |
существование атипичных мутаций SPAST, не выявляе- |
рованием в случае измененной электрофоретической |
мых использованными методами. |
подвижности. |
Таким образом, доля SPG4 в выборке семей с АД |
В 3 семьях предварительно провели анализ сцепления |
НСП составила 27% (7 из 26). Родословные соответствуют |
с локусом SPG4; эти большие русские семьи из Москов- |
АД-наследованию с полной пенетрантностью гена. Кли- |
ской области обследовались по месту проживания. Ис- |
ническая картина у большинства больных типична для |
|
|
|
|
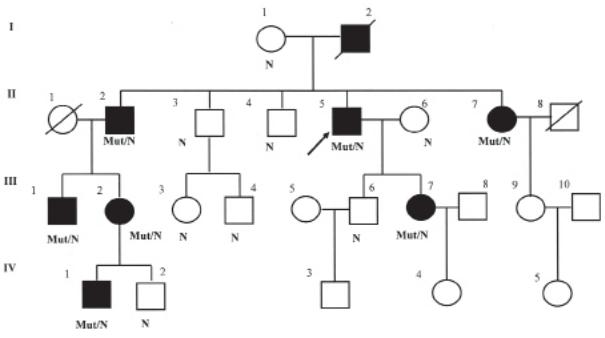
Рис. 1. Родословная семьи Р. с данными мутационного анализа.
Изображены поколения, включенные в молекулярно-генетические исследования.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
13 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Рис. 2. Родословная семьи К. с результатами анализа сцепления.
Гаплотип 9/6, выявленный у всех больных членов семьи, выделен жирным шрифтом.
Таблица 1. Мутации гена SPAST в шести семьях
Семья |
Нуклеотидная замена |
Аминокислотная замена |
Экзон |
Число тестированных больных |
Р. |
c.1291C>T |
р.Arg431Stop |
10 |
7 |
У. |
c.1107A>G |
p. Thr369Thr* |
8 |
2 |
П. |
c.1663G>T |
р.Asp555Tyr* |
15 |
1 |
Ч. |
c.839-840delAG |
p.Gln280Arg FsX9 |
5 |
2 |
В. |
c.1157A>G |
p.Asn386Ser |
8 |
2 |
Х. |
c.551A>C |
р.Asn184Thr* |
3 |
1 |
Примечание. * — мутация ранее не описана.
SPG4: «неосложненная» параплегия с относительно позд- |
сторонней опорой; беспокоят императивные позывы к |
ним началом и медленным течением (табл. 2). Вместе с тем |
мочеиспусканию. Брат 73 лет (II-2) болен с 36 лет (начал |
в 4 семьях (П., Ч., У. и К.) возраст больных к периоду на- |
ходить на носках), после 45 лет ходил с палкой, в послед- |
чала заболевания значительно варьирует внутрисемейно. |
ние годы с трудом передвигается в пределах квартиры; ин- |
У младших больных в семьях К. и У. имелась атипичная |
валид I группы. У 4 членов семьи, считавших себя здоро- |
клиническая картина болезни с началом в раннем детстве |
выми (III-1 44 лет, III-2 49 лет, III-7 30 лет и IV-1 23 лет), |
и сопутствующими симптомами. |
при осмотре выявлены множественные пирамидные сим- |
В семье Р. (см. рис.1) до обследования насчитывалось |
птомы, свидетельствующие о начальной стадии либо |
6 больных в старших поколениях (2 из них не отображены |
«стертой» форме НСП. Таким образом, дополненная ро- |
на рисунке). У 62-летнего пробанда (II-5) НСП диагно- |
дословная включает 10 больных. Результаты прямой ДНК- |
стирована в 26 лет при профилактическом осмотре, но жа- |
диагностики полностью совпали с распределением боль- |
лобы появились только в 40 лет; пациент работает, ездит |
ных и здоровых родственников по анализу сцепления и |
на велосипеде, палкой пользуется непостоянно вне дома. |
клиническому обследованию. |
Его 67-летняя сестра (II-7) с детства плохо бегала, отчет- |
Родословная семьи К. (см. рис. 2) первоначально на- |
ливые жалобы возникли в 35 лет, справлялась только с си- |
считывала 9 больных, при обследовании дополнительно |
дячей работой; инвалид II группы, ходит с трудом, с дву- |
выявлены 3 случая (III-8, IV-7, V-2). Возраст начала в |
14 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |

ГЕНЕТИКА СПАСТИЧЕСКОЙ ПАРАПЛЕГИИ SPG4
Таблица 2. Основные клинико-генеалогические характеристики SPG4 в семи семьях
Семья |
|
Генеалогические данные |
Возраст |
Прогрессирование, тяжесть |
Сопутствующие |
|
появления жалоб |
симптомы (n) |
|||
|
|
|
|
||
Р. |
10 больных в 5 поколениях; умерли 3; об- |
35—40 лет |
Медленное; тяжесть варьи- |
— |
|
|
следованы 7 |
|
рующая; есть субклиниче- |
|
|
|
|
|
|
ские случаи |
|
К. |
12 больных в 5 поколениях; умерли 4, об- |
2 года — 70 лет |
Медленное; тяжесть значи- |
Глухота и легкая |
|
|
следованы 8 |
|
тельная; есть субклиниче- |
дебильность (1)#; |
|
|
|
|
|
ские случаи |
деменция (1) |
У. |
2 |
больных в 2 поколениях; оба обследованы |
50 лет; 2 года |
Медленное; ходьба без опо- |
Эпилепсия (1) |
|
|
|
|
ры |
|
П. |
4 |
больных в 3 поколениях; умер 1; обследо- |
15—45 лет |
Медленное; ходьба без опо- |
— |
|
ван 1 |
|
ры |
|
|
Ч. |
4 |
больных в 2 поколениях; умерли 2; обсле- |
12—50 лет |
Медленное; ходьба без опо- |
— |
|
дованы 2 |
|
ры |
|
|
В.* |
5 |
больных в 4 поколениях; умер 1; обследо- |
40 лет; 30 лет |
Медленное; ходьба без опо- |
— |
|
ваны 2 |
|
ры |
|
|
Х.* |
6 |
больных в 3 поколениях; умерли 2, обсле- |
17 лет |
? (малый срок болезни) |
— |
|
дован 1 |
|
|
|
|
Примечание. n — число больных с данным признаком; * — клинические сведения есть только об обследованных; # — больной перенес гемолитическую болезнь новорожденных.
большинстве случаев — 35—50 лет, один из умерших боль- |
зволили предположить у больного НСП и расценить его |
ных (II-2) заболел до 30 лет. Пробанд 49 лет (IV-2), забо- |
патологию как смешанную. Анализ сцепления подтвер- |
левший в 35 лет, пользуется палкой вне дома, остальные |
дил это предположение: больной — носитель основного |
даже с двусторонней опорой ходят с трудом, только в пре- |
мутантного гаплотипа 9/6. |
делах дома; больная, умершая в 75 лет (III-10), в послед- |
В семье У. из Воронежской области больны мать и |
ние годы жизни была лежачей, были нарушены функции |
один из двух сыновей. Мать, 68 лет, считает себя больной |
тазовых органов. Недержанием мочи страдает также ее |
с 50 лет, когда появились скованность и утомляемость в |
54-летний сын (IV-10), у остальных тазовые функции не |
ногах, изменилась походка. Несмотря на прогрессирова- |
нарушены. Со стороны рук жалоб у больных нет, почти у |
ние болезни, до 65 лет работала участковым терапевтом, |
всех выявлена гиперрефлексия в руках, у 2 — также мы- |
включая вызовы на дом; изменения походки выражены, |
шечный гипертонус. Тетка пробанда 72 лет (III-8) замети- |
но ходит без опоры. Сын 37 лет, инвалид I группы, с 2 лет |
ла трудности ходьбы только в 70 лет и не связывала их с |
страдает спастической диплегией, ставился диагноз ДЦП; |
семейной болезнью, на момент обследования она ходит |
до 20—22 лет спастичность нарастала, затем стабилизиро- |
без опоры (единственная из больных); также отмечены |
валась; с 14 лет наблюдаются эпилептические припадки, |
признаки парциальной деменции. У считающих себя здо- |
интеллект высокий; КТ головного мозга: очаговых изме- |
ровыми 16-летнего сына (V-2) и 50-летнего двоюродного |
нений мозга нет, нерезко расширены боковые желудочки |
брата пробанда (IV-7) выявлены умеренная деформация |
и субарахноидальные пространства больших полушарий и |
стоп, гиперрефлексия, стопные патологические знаки, |
мозжечка. В статусе у обоих больных нижний спастиче- |
вялость брюшных рефлексов, указывающие на доклини- |
ский парапарез (гораздо более выраженный у сына), ги- |
ческую стадию или субклиническую форму НСП. Особую |
перрефлексия в руках. |
клиническую картину имеет другой двоюродный брат 34 |
Таким образом, в 7 семьях наряду со сходством имеет- |
лет (IV-5). Со слов родителей, он перенес вызванную |
ся меж- и внутрисемейное разнообразие по возрасту на- |
резус-конфликтом гемолитическую болезнь новорожден- |
чала и темпам течения болезни, сопутствующим симпто- |
ных с несвоевременным обменным переливанием крови. |
мам, причем в 4 семьях (К., П., В. и У.) прослеживается |
Начал ходить в 2 года, походка была спастической, но без |
тенденция «омоложения» и утяжеления болезни в нисхо- |
опоры; в 7 лет после миотомии приводящих мышц бедер |
дящих поколениях. Субклинические случаи, выявленные |
началось ухудшение, с 10 лет ходит с опорой, в дальней- |
в семьях Р. и К., не исключены и в других семьях, где здо- |
шем состояние было стабильным. С рождения страдает |
ровые родственники обследованы не были. |
нейросенсорной тугоухостью III степени, к слуховому ап- |
По данным обследования в семьях проводилось |
парату не адаптировался. Интеллект негрубо снижен, |
медико-генетическое консультирование. |
учился в специализированной школе, читает, чинит |
Обсуждение |
радиоаппаратуру. В неврологическом статусе: обуслов- |
|
ленная тугоухостью дислалия, умеренный верхний и гру- |
SPG4 была одной из первых НСП с картированным (в |
бый нижний спастический парапарез, походка резко спа- |
|
стическая, с опорой; негативное аутичное поведение, за- |
1994 г.) и идентифицированным (в 1999 г.) геном. С тех |
труднившее осмотр и оценку интеллекта. Анамнез и на- |
пор спектр генетических форм НСП резко расширился |
личие тугоухости указывали на детский церебральный |
(табл. 3) и продолжает расти. Такие формы, как SPG3, |
паралич (ДЦП), вызванный гемолитической болезнью, |
SPG4, SPG11, SPG7, относительно часты, тогда как не- |
однако отсутствие гиперкинезов, типичных для ДЦП этой |
которые другие описаны в единичных семьях или генети- |
этиологии, и период прогрессирования спастичности по- |
ческих изолятах. В табл. 4 суммированы данные послед- |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
15 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 3. Локусы и гены наследственных спастических параплегий
Форма НСП |
Локус |
Ген |
|
Аутосомно-доминантные |
|
SPG3 |
14q11-q21 |
ATL1 (атластин) |
SPG4 |
2p22-p21 |
SPAST (cпастин) |
SPG6 |
15q11.1 |
NIPA1 |
SPG8 |
8q23-q24 |
KIAA0196 |
SPG9 |
10q23.3-q24.2 |
? |
SPG10 |
12q13 |
KIF5A |
SPG12 |
19q13 |
? |
SPG13 |
2q24 |
HSPD1 |
SPG17 (cиндром Сильвера-1) |
11q13 |
BSCL2 (cейпин) |
SPG19 |
9q33-q34 |
? |
SPG29 |
1р31-р21 |
? |
SPG31 |
2p11.2 |
REEP1 |
SPG33 |
10q24.2 |
ZFYVE27(протрудин) |
SPG36 |
12q23-q24 |
? |
SPG37 |
8p21.1-q13.3 |
? |
SPG38 (синдром Сильвера-2) |
4p16-p15 |
? |
SPG41 |
11p14.1-p11.2 |
? |
SPG42 |
3q24-q26 |
SLC33A1 |
НСП+дистония |
2q24-q31 |
? |
|
Аутосомно-рецессивные |
|
SPG5 |
8q21.3 |
CYP7B1 |
SPG7 |
16q24.3 |
PGN (параплегин) |
SPG11 |
15q13-q15 |
KIAA1840 (cпатаксин) |
SPG14 |
3q27-q28 |
? |
SPG15 (синдром Къеллина) |
14q22-q24 |
ZFYVE26 (спастицин) |
SPG18 |
8p12-p11.21 |
? |
SPG20 (синдром Тройер) |
13q12.3 |
KIAA0610 (cпартин) |
SPG21 (синдром Мэст) |
15q21-q22 |
ACP33 (маспардин) |
SPG23 |
1q24-q32 |
? |
SPG24 |
13q14 |
? |
SPG25 |
6q23-q24 |
? |
SPG26 |
12p11.1-q14 |
? |
SPG27 |
10q22-q24 |
? |
SPG28 |
14q21-q22 |
? |
SPG30 |
2q37.3 |
? |
SPG32 |
14q12-q21 |
? |
SPG35 |
16q21-q23 |
? |
SPG39 |
19p13.3 |
PNPLA6 |
SPG45 |
10q24.3-q25.1 |
? |
SPOAN |
11q13 |
? |
Ранний восходящий парапарез |
2q33 |
ALS2 (алсин) |
CPSQ1 |
2q31 |
GAD1 |
CPSQ2 |
9q24.3 |
KANK1 |
CPSQ3 |
7q22.1 |
AP4M1 |
|
Х-сцепленные |
|
SPG1 и синдром MASA |
Хq28 |
L1 CAM |
SPG2 |
Xq22 |
PLP1 |
SPG16 |
Xq11.2 |
? |
SPG34 |
Xq25 |
? |
Примечание. SPOAN — Spastic Paraplegia, Optic Atrophy, Neuropathy (спастическая параплегия, атрофия зрительных нервов, нейропатия); СPSQ — Сerebral Palsy, Spastic Quadriplegic (ДЦП, спастический тетрапарез) — врожденные непрогрессирующие формы, «имитирующие» ДЦП.
них лет о вкладе SPG4 в структуру НСП. Показано, что |
и не столько с межпопуляционными различиями, сколько |
SPG4 диагностируется повсеместно, ее доля в большин- |
с методами ДНК-анализа и отбором больных. Наш пока- |
стве исследований составляет 15—40% всех НСП, а среди |
затель — 27% в группе случаев АД — ниже средних цифр, |
случаев АД — 40—60%. Различия цифр связаны не только |
небольшой размер выборки не позволяет судить о досто- |
16 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |

ГЕНЕТИКА СПАСТИЧЕСКОЙ ПАРАПЛЕГИИ SPG4
Таблица 4. SPG4 в структуре наследственных спастических параплегий
|
|
|
Доля SPG4 в структуре НСП |
|
|
|
||
Страна, источник |
|
вся выборка |
|
|
тип наследования |
|
|
|
|
АД |
|
спорадический |
|
не уточнен |
|||
|
|
|
|
|
||||
|
% |
n/N |
% |
n/N |
% |
n/N |
% |
n/N |
Болгария [21] |
17 |
6/36 |
35 |
6/17 |
— |
0/19 |
|
|
Германия [48] |
17 |
27/161 |
38 |
24/63 |
2 |
3/95 |
|
|
Германия [52] |
27 |
57/200 |
36 |
36/99 |
7 |
3/46 |
33 |
18/55 |
Голландия [8] |
|
|
|
|
13 |
6/47 |
|
|
Италия [11] |
22 |
13/60 |
|
|
|
|
|
|
Италия [25] |
26 |
9/34 |
44 |
8/18 |
6 |
1/16 |
|
|
Италия [26] |
37 |
14/38 |
46 |
11/24 |
21 |
11/14 |
|
|
Италия [42] |
32 |
|
47 |
|
|
|
|
|
Норвегия [17] |
29 |
17/59 |
46 |
16/35 |
7 |
1/18 |
— |
0/6 |
Португалия [23] |
15 |
12/80 |
20 |
12/61 |
— |
0/19 |
|
|
Эстония [7] |
22 |
11/59 |
|
|
|
|
|
|
США [31] |
20 |
15/76 |
30 |
|
|
|
|
|
Объединенные [12] |
30 |
164/543 |
|
|
|
|
|
|
Объединенные [15] |
|
|
|
|
12 |
18/146 |
|
|
Китай [56] |
|
|
18 |
4/22 |
|
|
|
|
Корея [40] |
44 |
8/18 |
64 |
7/11 |
14 |
1/7 |
|
|
Наши данные |
|
|
27 |
7/26 |
|
|
|
|
Примечание. [12] и [15] — международные данные, преимущественно европейские.
верности этого отличия. SPG4 не столь редко диагностируется и в спорадических случаях [8, 15, 26]. Поэтому скрининг на мутации SPAST считают эффективным не только в семейных, но и в несемейных случаях АД — после исключения фенокопий.
Ген SPAST экспрессируется в нейронах (но не в глиальных клетках), а также за пределами нервной системы. Белок спастин принадлежит к семейству ААА-белков — АТФаз c множественными видами клеточной активности (ATPases associated with diverse cellular activities). Действие SPAST, как и ряда других генов НСП (KIF5A, ATL1, KIAA0), связано с аксональным транспортом; ведущую роль в функционировании нормального спастина и в патогенезе SPG4 придают связи спастина с микротрубочками цитоскелета нейронов [1, 47]. Мутации SPAST, очевидно, оказывают прямое повреждающее действие на нейроны, вызывая дегенерацию аксонов.
Характеристики мутаций у наших больных соответствуют накопленным в мире данным. Действительно, эти мутации многообразны и в большинстве семей уникальны. В настоящее время зарегистрировано более 200 мутаций, из них 43% составляют миссенс- и нонсенс-мутации, 21% — мутации сайта сплайсинга, 23% — небольшие делеции, 9% — небольшие инсерции, 4—5% — атипичные мутации [20]. Есть единичные примеры накопления общей мутации вследствие эффекта родоначальника — у франкоканадцев Квебека [30], в семьях, эмигрировавших из Шотландии в Италию и Канаду [38], — но в целом частых мутаций SPAST нет, а большинство описаны однократно. Отсутствие частых мутаций и большой размер гена (17 экзонов) затрудняют ДНК-диагностику.
В последние годы мутационный спектр SPG4 еще более расширился за счет атипичных мутаций, в частности протяженных делеций, не обнаруживаемых рутинными методами ДНК-анализа [4, 5, 14, 22, 26, 34]. Для их выявления применяют такие методы, как денатурирующая вы-
сокоэффективная жидкостная хроматография (DHPLC) и мультиплексная лигазозависимая амплификация (MLPA). С помощью этих методов удалось найти мутации в ряде семей с АД НСП без типичных мутаций SPAST, особенно в семьях, где имелось сцепление с локусом SPG4, как в семье К. Одной из первых стала японская семья, где нашли мутацию в нетранслируемой области гена — делецию 2307 нуклеотидов от 5’-конца до первого интрона [22].
С.Beetz и соавт. [4] обнаружили различные крупные делеции SPAST у 12 из 65 пробандов (18%), у которых ранее мутация не была найдена. Сходные данные получены
С.Depienne и соавт. [14]: в группе 120 неродственных больных без «обычных» мутаций у 24 (20%) были найдены 16 видов крупных делеций SPAST, захватывающих от одного экзона до всей кодирующей последовательности гена. В большой международной выборке крупные делеции составили 19% всех мутаций SPAST [12]; авторы считают, что делеции экзонов при SPG4 не менее часты, чем точечные мутации. Редкий вариант атипичной мутации описан в бразильской семье: дупликация 3 экзонов, ведущая к образованию преждевременного стоп-кодона [32]. Благодаря обнаружению не учтенных ранее мутаций доля SPG4 в некоторых выборках со временем увеличивается: 26 — 38% [25, 26]; 17 — 27% [48, 52].
Пенетрантность мутаций SPAST высокая, но не 100%: описаны семьи, где у очень пожилых несомненных носителей (по родословной или анализу ДНК) отсутствовали не только жалобы, но и какие-либо объективные признаки НСП [3].
Как и у большинства наших больных, SPG4 чаще проявляется на 3—5-м десятилетиях жизни, средний возраст начала — 25—35 лет, но вариабельность, в частности внутрисемейная, очень широка — от врожденного начала до 75 лет. Варьирует также тяжесть болезни, но большинство больных способны ходить, нередко даже без опоры, до конца жизни, лишь немногие обездвижены. Субкли-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
17 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
нические случаи составляют до 20%. Типичной SPG4 считается «неосложненная» параплегия (как в большинстве наших наблюдений). Вместе с тем накапливается все больше данных литературы о сопутствующих симптомах.
Были отмечены следующие сопутствующие клинические симптомы: умственная отсталость [2, 12, 37, 45]; поздние когнитивные расстройства, деменция [6, 9, 12, 16, 19, 34, 35, 37, 44, 52, 55, 58]; эпилепсия [6, 19, 29, 57]; психоз [28]; атаксия [35, 52]; полинейропатия [12, 27, 37, 52]; амиотрофия кистей [39, 46]; бульбарный синдром [8, 27]; сколиоз [21]. Сопутствующими были также следующие КТ- и МРТ-признаки: гипоплазия или дисплазия мозолистого тела [2, 38]; атрофия мозжечка; аномалия Денди— Уокера [38, 51]; врожденные арахноидальные кисты [36]; атрофия коры; поражение белого вещества [16, 29, 35, 45].
Чаще эти симптомы имеются не у всех больных членов семьи, а у одного или нескольких. Многократно наблюдавшиеся поздние когнитивные расстройства и деменцию (часто парциальную, как у больной из семьи К.), считают характерными именно для SPG4 и расценивают как эффект мутаций SPAST [1]. Так, в семье, описанной S.Murphy и соавт. [34], деменция или когнитивные расстройства имелись у 6 из 13 больных SPG4, в том числе у всех старше 60 лет, а лиц с психическими расстройствами без SPG4 не было.
Вместе с тем в отдельных случаях без углубленного обследования нельзя исключить наличие деменции другой этиологии; связь парциальной деменции c SPG4 у больной К. вероятна, но не доказана. Эпилепсия при SPG4 также описана неоднократно. Сходство с семьей У. имеет итальянская семья, где у матери была неосложненная SPG4, а у сына — очень ранняя, с сопутствующей эпилепсией и, в отличие от больного У., умеренными изменениями высших психических функций [6]. Случаи SPG4 c психозами найдены в ходе ирландского клиникоэпидемиологического исследования НСП; еще одной формой с повышенной частотой психозов оказалась SPG15 [28]. Случаи SPG4 c изменениями КТ/МРТ мозга немногочисленны, но, возможно, недоучитываются, поскольку в семейных случаях, не вызывающих диагностических сомнений, нейровизуализация проводится не всегда (из наших больных МРТ проведена только больному У. в связи с эпилепсией). Нейроанатомическим обоснованием эпилепсии и других психоневрологических расстройств при SPG4 служат экспериментальные данные об экспрессии SPAST, полученные на «мышиной» модели [24]. Описаны атипичные случаи SPG4, клинически имитирующие другие болезни: рассеянный склероз с ремиттирующим течением и характерными изменениями МРТ [16, 29]; быстро прогрессирующий боковой амиотрофический склероз с бульбарными расстройствами [8]. Осложненные и атипичные фенотипы надо учитывать при отборе больных для поиска мутаций SPAST [27].
ЛИТЕРАТУРА
1.Иллариошкин С.Н., Руденская Г.Е., Иванова-Смоленская И.А. и др. Наследственные атаксии и параплегии. М 2006; 415.
2.Alber B., Pernauer M., Schwan A. et al. Spastin related hereditary spastic paraplegia with dysplastic corpus callosum. J Neurol Sci 2005; 236: 9—12.
3.Aridon P., Ragonese P., De Fusco M. et al. Autosomal dominant hereditary spastic paraplegia: report of a large Italian family with R581X spastin mutation. J Neurol Sci 2007; 28:171—174.
Активно изучается взаимосвязь гено- и фенотипа при SPG4. Многообразие мутаций SPAST затрудняет эти исследования: нет возможности сравнить представительные группы семей с одинаковой мутацией. Четкая зависимость фенотипа от характера мутации не установлена [1], но ряд работ указывает на взаимосвязь: так, отмечена тенденция более раннего начала при миссенс-мутациях [52]. Некоторые результаты противоречивы: одни авторы выявили более раннее начало при крупных делециях, чем при точечных мутациях [14], другие не нашли таких различий [4], а семья с протяженной делецией, описанная H.Iwanaga и соавт. [22], напротив, отличалась поздним началом и мягким течением SPG4.
Вряде семей с SPG4, как и в части наших наблюдений, имеет место значительное «омоложение» болезни в нисходящих поколениях — антиципация. В связи с этим до идентификации гена SPAST предполагали принадлежность SPG4 к «болезням тринуклеотидных повторов», что не подтвердилось. Обсуждаются другие возможные механизмы антиципации [43]. В наблюдении С.Depienne и соавт. [13] пробанд c соматическим мозаицизмом по возникшей de novo мутации SPAST заболел в 55 лет, его дочь
ивнук — в 18 и 5 лет соответственно; авторы предполагают связь антиципации с соматическим мозаицизмом. Этот случай также подтверждает возможность возникновения мутаций SPAST de novo.
Одним из модифицирующих факторов при SPG4 считается пол: ряд данных свидетельствует о более раннем начале и более тяжелом течении SPG4 у мужчин [32, 37].
Впоследние годы обнаружена модифицирующая роль генных полиморфизмов SPAST, а также гена HSPD1, ответственного за SPG13 [18, 27, 33, 41, 49, 50, 53, 54]. Некоторые полиморфизмы SPAST (Ser441Leu, Glu563Lys, Pro45Gln) предрасполагают к более раннему началу и тяжелому течению SPG4. Замена Glu563Lys сама по себе не вызывает болезнь, но в сочетании с полиморфизмом Ser441Leu ведет к развитию клинической картины [41]. Возможно, полиморфизм Ser441Leu предрасполагает к более широкому спектру болезней мотонейрона, включая боковой амиотрофический склероз [33]. Необычные молекулярно-генетические и клинические характеристики имеет наблюдение P.Chinnery [10]: у маленького ребенка с тяжелым спастическим парапарезом были найдены две кодоминатные мутации SPAST. Учитывая возможность сочетанных мутаций, а также наличие внутригенных модификаторов, необходимо проводить полный анализ гена даже после обнаружения мутации — особенно при необычном фенотипе [10, 27].
Наряду с прикладным значением для диагностики и особенно для медико-генетического консультирования молекулярно-генетические исследования SPG4 и других НСП играют важнейшую роль в изучении клеточных механизмов спастичности и регуляции мышечного тонуса.
4.Beetz C., Nygren A., Schickel J. et al. High frequency of partial SPAST deletions in autosomal dominant hereditary spastic paraplegia. Neurology 2006; 67:1926—1930.
5.Beetz C., Zuchner S., Ashley-Koch A. et al. Linkage to a known gene but no mutation identified: comprehensive reanalysis of SPG4 HSP pedigrees reveals large deletions as the sole cause. Hum Mutat 2007; 28: 739—740.
18 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |

ГЕНЕТИКА СПАСТИЧЕСКОЙ ПАРАПЛЕГИИ SPG4
6.Bertelli M., Cecchin S., Lorusso L. et al. Identification of a novel mutation in the spastin gene (SPG4) in an Italian family with hereditary spastic paresis. Panminerva Med 2006; 48: 193—197.
33.Münch C., Rolfs A., Meyer T. Heterozygous S44L missense change of the spastin gene in amyotrophic lateral sclerosis. Amyotroph Lateral Scler 2008; 9:251—253.
7.Braschinsky M., Lüüs S., Gross-Paju K., Haldre S. The prevalence of he34. Murphy S., Gorman G., Beetz C. et al. Dementia in SPG4 hereditary spastic
reditary spastic paraplegia and the occurrence of SPG4 mutations in Estonia. Neuroepidemiology 2008; 32: 89—93.
8.Brugman F., Wokke J., Scheffer H. et al. Spastin mutations in sporadic adultonset upper motor neuron syndromes. Ann Neurol 2005; 58: 865—869.
9.Byrne P., McMonagle P., Webb S. et al. Age-related cognitive decline in hereditary spastic paraplegia linked to chromosome 2p. Neurology 2000; 54: 1510—1517.
10.Chinnery P., Keers S., Holden M. et al. Infantile hereditary spastic paraparesis due to codominant mutations in the spastin gene. Neurology 2004; 63: 710—712.
11.Crippa F., Panzeri C., Martinuzzi A. et al. Eight novel mutations in SPG4 in a large sample of patients with hereditary spastic paraplegia. Arch Neurol 2006; 63: 750—755.
12.Depienne C., Fedirko E., Bricka B. et al. Mutation spectrum and clinical features pf SPG4 HSP. Eur J Hum Genet 2007; 15: Suppl 1: 90.
13.Depienne C., Fedirko E., Faucheux J. et al. A de novo SPAST mutation leading to somatic mosaicism is associated with a later age at onset in HSP. Neurogenetics 2007; 8: 231—233.
14.Depienne C., Fedirko E., Forlani S. et al. Exon deletions of SPG4 are a frequent cause of hereditary spastic paraplegia. J Med Genet 2007; 44: 281—284.
15.Depienne C., Tallaksen C., Lephay J. et al. Spastin mutations are frequent in sporadic spastic paraparesis and their spectrum is different from that observed in familial cases. J Med Genet 2006; 43: 259—265.
16.Dürr A., Davoine C., Paternotte C. et al. Phenotype of autosomal dominant spastic paraplegia linked to chromosome 2. Brain 1996; 119: 1487—1496.
17.Erichsen A., Inderhaug E., Mattingsdal M. et al. Seven novel mutations and four exon deletions in a collection of Norwegian patients with SPG4 hereditary spastic paraplegia. Eur J Neurol 2007; 14: 809—814.
18.Gal A., Mede K., Remenyi V. et al. Synergistic effect of spastin gene mutations in a Hungarian patient with hereditary spastic paraplegia (HSP). Eupop J Hum Genet 2009; 17: Suppl 2: 327.
19.Heinzlef O., Paternotte C., Mahieux F. et al. Mapping of a complicated familial spastic paraplegia to a locus SPG4 on chromosome 2p. J Med Genet 1998; 35: 89—93.
paraplegia: clinical, genetic, and neuropathologic evidence. Neurology 2009; 73:378—384.
35.Nielsen J., Johnsen B., Koefoed P. et al. Hereditary spastic paraplegia with cerebellar ataxia: a complex phenotype associated with a new SPG4 gene mutation. Eur J Neurol 2004; 11: 817—824.
36.Orlacchio A., Gaudiello F., Totaro A. et al. A new SPG4 mutation in a variant form of spastic paraplegia with congenital arachnoid cysts. Neurology 2004; 62: 1875—1878.
37.Orlacchio A., Kawarai T., Gaudiello F. et al. Clinical and genetic study of a large SPG4 Italian family. Mov Disord 2005; 20: 1055—1059.
38.Orlacchio A., Kawarai T., Totaro A. et al. Hereditary spastic paraplegia: clinical genetic study of 15 families. Arch Neurol 2004; 61: 830—833.
39.Orlacchio A., Patrono C., Gaudiello F. et al. Silver syndrome variant of hereditary spastic paraplegia: A locus to 4p and allelism with SPG4. Neurology 2008; 70: 1959—1966.
40.Pak S., Ki C., Kim H. et al. Mutation analysis of SPG4 and SPG3A genes and its implication in molecular diagnosis of Korean patients with hereditary spastic paraplegia. Arch Neurol 2005; 62: 1118—1121.
41.Pantakani D., Zechner U., Arygriou L. et al. Compound heterozygosity in the SPG4 gene causes hereditary spastic paraplegia. Clin Genet 2008; 73: 268—272.
42.Patrono C., Scarano V., Cricchi F. et al. Autosomal dominant hereditary spastic paraplegia: DHPLC-based mutation analysis of SPG4 reveals eleven novel mutations. Hum Mutat 2005; 25: 506.
43.Reddy P., Seltzer W., Grewal R. Possible anticipation in hereditary spastic paraplegia type 4 (SPG4). Can J Neurol Sci 2007; 34: 208—210.
44.Reid E., Grayson C., Rubinsztein D. et al. Subclinical cognitive impairment in autosomal dominant ‘pure’ hereditary spastic paraplegia. J Med Genet 1999; 36: 797—798.
45.Ribaï P., Depienne C., Fedirko E. et al. Mental deficiency in three families with SPG4 spastic paraplegia. Eur J Hum Genet 2008; 16: 97—104.
46.Salameh J., Shenoy A., David W. Novel SPG3A and SPG4 mutations in two patients with Silver syndrome. J Clin Neuromuscul Dis 2009; 11: 57—59.
20.Human Gene Mutation Database, Cardiff (HGMD) http://www.hgmd. 47. Salinas S., Carazo-Salas R., Proukakis C. et al. Spastin and microtubules: cf.ac.uk Functions in health and disease. J Neurosci Res 2007; 85: 2778—2882.
21.Ivanova N., Lofgren A., Tournev I. et al. Spastin gene mutations in Bulgarian patients with hereditary spastic paraplegia. Clin Genet 2006; 70: 490—495.
22.Iwanaga H., Tsujino A., Shirabe S. et al. Large deletion involving the 5’- UTR in the spastin gene caused mild phenotype of autosomal dominant hereditary spastic paraplegia. Am J Med Genet 2005; 133A: 13—17.
23.Loureiro J., Miller-Fleming L., Thieleke-Matos C. et al. Novel SPG3A and SPG4 mutations in dominant spastic paraplegia families. Acta Neurol Scand 2009; 119: 113—118.
24.Ma D., Chia S., Tang Y. et al. Spastin in the human and mouse central nervous system with special reference to its expression in the hippocampus of mouse pilocarpine model of status epilepticus and temporal lobe epilepsy. Neurochem Int 2006; 49: 651—664.
25.Magariello A., Muglia M., Patitucci A. et al. Novel spastin (SPG4) mutations in Italian patients with hereditary spastic paraplegia. Neuromusc Disord 2006; 16:387—390
26.Magariello A., Muglia M., Patitucci A. et al. Mutation analysis of the SPG4 gene in Italian patients with pure and complicated forms of spastic paraplegia. J Neurol Sci 2009.
27.McDermott C., Burness C., Kirby J. et al. Clinical features of hereditary spastic paraplegia due to spastin mutation. Neurology 2006; 67: 45—51.
28.McMonagle P., Hutchinson M., Lawlor B. Hereditary spastic paraparesis and psychosis. Eur J Neurol 2006; 13: 874—879.
29.Mead S., Proukakis C., Wood N. et al. A large family with hereditary spastic paraparesis due to a frame shift mutation of the spastin (SPG4) gene: association with multiple sclerosis in two affected siblings and epilepsy in other affected family members. J Neurol Neurosurg Psychiat 2001; 71: 788—791.
30.Meijer I., Dupré N., Brais B. et al. SPG4 founder effect in French Canadians with hereditary spastic paraplegia. Can J Neurol Sci 2007; 34: 211—214.
31.Meijer I., Hand C., Cossette P. Spectrum of SPG4 mutations in a large collection of North American families with hereditary spastic paraplegia. Arch Neurol 2002; 59: 281—286.
32.Mitne-Neto M., Kok F., Beetz C. et al. A multi-exonic SPG4 duplication underlies sex-dependent penetrance of hereditary spastic paraplegia in a large Brazilian pedigree. Eur J Hum Genet 2007; 15: 1276—1279.
48.Sauter S., Miterski B., Klimpe S. et al. Mutation analysis of the spastin gene (SPG4) in patients in Germany with autosomal dominant hereditary spastic paraplegia. Hum Mutat 2002; 20:127—132.
49.Schickel J., Beetz C., Frömmel C. et al. Unexpected pathogenic mechanism of a novel mutation in the coding sequence of SPG4 (spastin). Neurology 2006; 66: 421—423.
50.Schickel J., Pamminger T., Ehrsam A. et al. Isoform-specific increase of spastin stability by N-terminal missense variants including intragenic modifiers of SPG4 hereditary spastic paraplegia. Eur J Neurol 2007; 14: 1322— 1328.
51.Scuderi C., Fichera M., Calabrese G. et al. Posterior fossa abnormalities in hereditary spastic paraparesis with spastin mutations. J Neurol Neurosurg Psychiat 2009; 80: 440—443.
52.Shoukier M., Neesen J., Sauter S. et al. Expansion of mutation spectrum, determination of mutation cluster region and predictive structural classification on SPAST mutations in hereditary spastic paraplegia. Eur J Hum Genet 2009; 17: 187—194.
53.Svenson I., Kloos M., Gaskell P. et al. Intragenic modifiers of hereditary spastic paraplegia due to spastin gene mutations. Neurogenetics 2004; 5: 157—164.
54.Svenstrup K., Bross P., Koefoed P. et al. Sequence variants in SPAST, SPG3A and HSPD1 in hereditary spastic paraplegia. J Neurol Sci 2009; 284:90— 95.
55.Tallaksen C., Guichart-Gomez E., Verpillat P. Subtle cognitive impairment but no dementia in patients with spastin mutations. Arch Neurol 2003; 60: 1113—1118.
56.Tang B., Zhao G., Xia K. et al. Three novel mutations of the spastin gene in Chinese patients with hereditary spastic paraplegia. Arch Neurol 2004; 61: 49—55.
57.Webb S., Flanagan N., Callaghan N., Hutchinson M. A family with hereditary spastic paraparesis and epilepsy. Epilepsia 1997; 38: 495—499.
58.White K., Ince P., Lusher M. et al. Clinical and pathological findings in hereditary spastic paraplegia with spastin mutation. Neurology 2000; 55: 89—94.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
19 |
