
- •Кто спал, когда
- •Протолитическая теория кислот и оснований.
- •Синквейн
- •Основная литература
- •Основная литература
- •Основная литература
- •Основная литература
- •Основная литература
- •Дополнительная
- •Дополнительная
- •Дополнительная
- •Дополнительная
- •Дополнительная
- •Дополнительная
- •Введение
- •Тогда протолитическое равновесие может быть выражено схемой:
- •Типы кислот и оснований Б-Л
- •Типы протолитических реакций
- •Физиологические механизмы поддержания рН крови
- •Физико-химические механизмы поддержания рН крови
- •Буферные системы – …
- •Состав буферных систем
- •Типы буферных систем
- •Расчёт рН буферных систем. Уравнение Гендерсона – Гассельбаха
- •Выводы
- •Механизм действия буферной системы …
- •Механизм действия буферной системы
- •Механизм действия бикарбонатного буфера
- •Основные характеристики буферной системы
- •Факторы, влияющие на β
- •Основные характеристики буферной системы
- •рН биожидкостей в норме
- •Совмещённые протолитические равновесия …
- •Совмещённое протолитическое равновесие
- •Спасибо за внимание!

Основные характеристики буферной системы
Буферная ёмкость (В, β) ‒
количество вещества эквивалента сильного протолита Х, которое нужно добавить к 1 дм3 буферной системы, чтобы изменить её рН на единицу.
|
1 |
|
|
|
1 |
|
Vx |
|
|
|
|
|
n |
x |
|
c |
z |
x |
моль |
|
3 |
||
|
z |
|
|
|
|
|
дм |
||||
pH |
pH VБ.С. |
||||||||||
|
|
|
|
||||||||

Факторы, влияющие на β
Концентрации компонентов буферной системы: чем выше концентрации, тем выше β.
Соотношение концентраций компонентов буферной системы: чем ближе к 1, тем выше β.
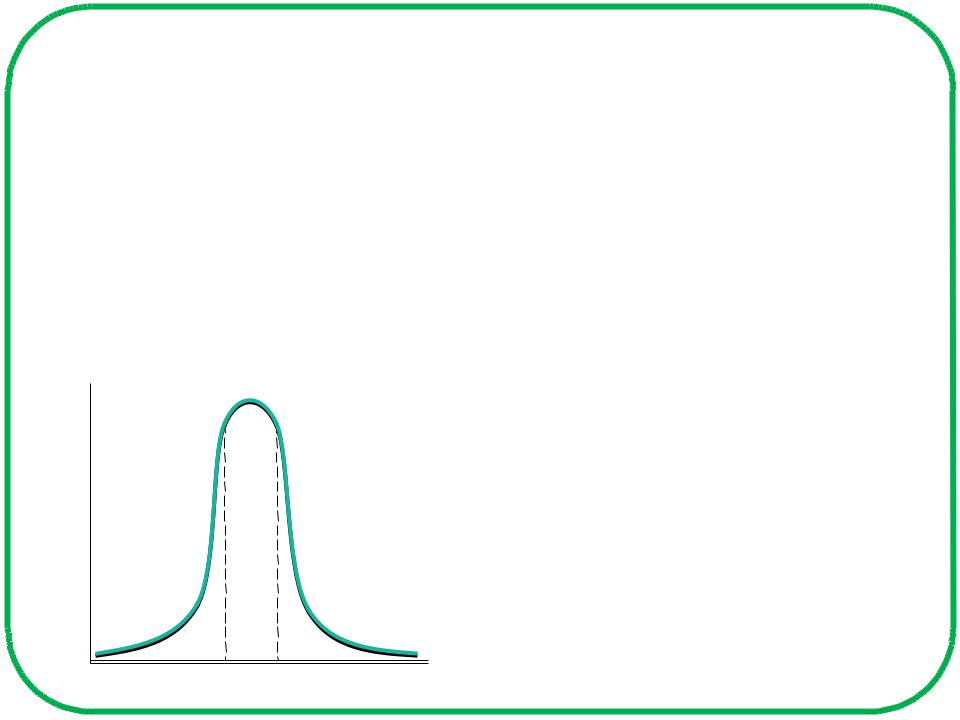
Основные характеристики буферной системы
Зона буферного действия ‒
интервал значений рН, в котором сохраняется буферное действие данной буферной системы.
β
3,8 5,8 |
рН |
Зона буферного действия определяется по рК слабого протолита буферной системы.
рК ± 1

рН биожидкостей в норме
Внутриклеточный рН
Внутри эритроцита рН ~ 7,20 –
Внеклеточный рН
Нормальный рН плазмы 7,35 – 7,45
Совместимый с жизнью рН плазмы ~ 7,00 – 7,70
рН экскретируемых жидкостей
Диапазон значений рН мочи 4,50 – 8,00

Совмещённые протолитические равновесия …
… в буферной системе имеют место при одновременном присутствии в ней нескольких буферных систем.
НА  МеА
МеА 
НВ МеВ 
Условия совмещённого равновесия:
1.оба основания (А–, В–) буф. системы связывают Н+ в другой компонент – кислоту;
. «работает» буфер,  образующий более прочный
образующий более прочный
протолит (более слабую кислоту);
. Ка (НА) < Ка (НВ).

Совмещённое протолитическое равновесие
|
В–Вывод: в совмещённом |
Н+ |
протолитическом равновесии |
доминирует тот процесс, в |
|
|
результате которого |
|
образуется более прочный |
|
протолит. |
А– |
H2PO4– |
HHb |
HPO42– |
Hb– |
|
|
Ka = 6,2 10–8 |
Ка=6,31 10– |
9

