
- •Методические рекомендации для студентов
- •3.Цели занятия:
- •3.2.Конкретные цели и задачи.
- •4.Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
- •5.Задания для самостоятельной подготовки к лабораторному занятию.
- •6. Этапы проведения лабораторного занятия.
- •7.Ориентировочная основа действия (оод) для проведения самостоятельной работы студентов в учебное время.
- •1. Определение теплоты растворения соли.
- •2. Определение константы калориметра.
- •8.Задания для контроля уровня сформированности компетенций в учебное время.
- •9.Учебно – материальное обеспечение.
- •9.1. Литература:
- •10. Материальное обеспечение:
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Тихоокеанский государственный медицинский университет»
Министерства здравоохранения России
Кафедра химии
Утверждено
на заседании кафедры
Протокол № ___ от ______________ 2013 года
Заведующая кафедрой ________________
_________________Иванова Н.С.
Методические рекомендации для студентов
к лабораторным занятиям
модуль № 2 «Элементы химической термодинамики.
Элементы химической кинетики».
учебной дисциплины Химия
для специальности 060101 «Лечебное дело»
курс I семестр I
Составитель Иванова Н.С.
к.х.н., доцент, зав. кафедрой
Рецензент __________________
___________________________
Владивосток, 2013
1.Тема занятия: Элементы химической термодинамики. Определение энтальпии растворения соли
2.Мотивация изучения темы: термохимические исследования позволяют раскрыть возможности для решения теоретических и практических проблем в
физиологии: оценка уровня основного обмена в живых организмах, изучение энергетики мышечного сокращения;
биохимии: оценка энергетики биохимических процессов, изучение конформационных переходов белков и нуклеиновых кислот;
микробиологии: идентификация и оценка цитоксичности растущих микроорганизмов по теплопродукции;
клинических исследованиях: изучение теплопродукции эритроцитов, гранулоцитов, лимфоцитов, лейкоцитов при различных заболеваниях и действии лекарственных препаратов;
санитарно – гигиенических исследованиях: составление энергоменю для различных групп населения.
3.Цели занятия:
3.1.Общая цель: изучение темы направлено на формирование компетенций ПК – 2 и ПК – 3 по ФГОС специальности 060101 Лечебное дело.
3.2.Конкретные цели и задачи.
После изучения темы студент должен:
«знать» - преимущества и ограничения термодинамики, формулировки и математические выражения I – ого начала термодинамики, закона Гесса и его следствий. Знать способы определения энтальпии реакций;
«уметь» - решать типовые и ситуационные задачи, опираясь на теоретические положения. Ориентироваться в справочных данных. Представлять данные эксперимента в виде графиков и обсчитывать их. Делать выводы с учётом достоверности полученного результата;
«владеть» - навыками экспериментального определения тепловых эффектов: собрать установку, пользоваться физическим и химическим оборудованием, измерять термодинамические переменные и функции. Навыками использования обучающей программы «Measure» в химическом эксперименте и навыками безопасной работы в химической лаборатории.
4.Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
Тепловые эффекты химических реакций.
Классификация химических реакций по тепловому эффекту.
Термохимические уравнения химических реакций.
Формулировки I – ого начала термодинамики.
Знания получены при изучении курса химии и физики общеобразовательных учебных заведений.
5.Задания для самостоятельной подготовки к лабораторному занятию.
5.1. Перечень контрольных вопросов для самоконтроля знаний.
Преимущества и ограничения термодинамики.
Термодинамические переменные и термодинамические функции состояния.
Первое начало термодинамики.
Энтальпия. Стандартная энтальпия.
Способы вычисления энтальпии реакции:
закон Гесса,
следствия из закона Гесса.
6.Калориметрическое определение энтальпии процессов растворения, нейтрализации и др.
5.2.Задания для СРС во внеучебное время.
Опираясь на теоретические положения, решить задачи:
Задача № 1
Вычислить стандартную энтальпию реакции
S(T)+O2(г)↔SO2(г), используя данные:
2S(T)+3O2(г),↔ 2SO3(г) ΔΗ0= -790 кДж/моль
2SО2 (г)+O2(г),↔ 2SO3(г) ΔΗ0= -196 кДж/моль
Ответ: ΔΗ0= -297 кДж/моль
Задача на закон Гесса.
Задача № 2
Вычислить стандартную энтальпию хемосинтеза, протекающего в автотропных бактериях, по стадиям и суммарно:
а) 2Н2S(г)+О2(г)→2Н2О(ж)+2S(т)
б) 2S(т)+3О2(г)+2Н2О (ж)→2H2SO4(ж)
в) 2Н2S(г)+4О2(г)→2Н2SО4(ж)
Ответ: ΔΗ0(а)= -523 кДж/моль
ΔΗ0(б)= -1056 кДж/моль
ΔΗ0(в)= -1588 кДж/моль
Задача на 1 – ое следствие из закона Гесса.
Задача № 3
Вычислить стандартную энтальпию реакции
2С2Н5ОН(ж)→ С2Н5 – О - С2Н5(ж)+Н2О(ж), используя значения
ΔΗ0 сгорания веществ.
Ответ: ΔΗ0= -9кДж/моль
Задача на 2 – ое следствие из закона Гесса.
Задача № 4 (расчётно - графическая работа)
На основании экспериментальных данных определите тепловой эффект растворения 4,28 г NН4Cl в 800 мл воды, если для нагрева системы было затрачено 60 кДж/моль.
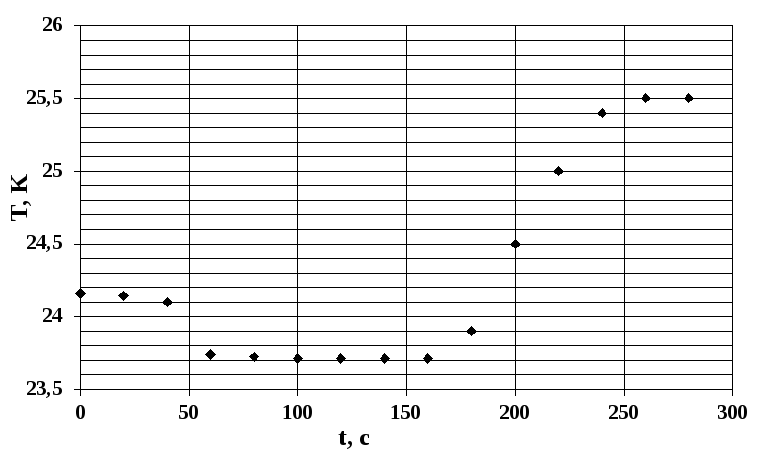
5.3.Задания для самоконтроля подготовки к лабораторному занятию.
Вариант теста № 1
Функцией состояния является:
а) давление
б) энтальпия
в) температура.
Вариант теста № 2
Стандартная энтальпия реакции С6Н12О6 →2С2Н5ОН+2СО2
составляет - 74 кДж/моль, на основании этого можно сделать вывод:
а) скорость реакции велика
б) скорость реакции мала
в) скорость реакции определить нельзя.
Вариант теста № 3
Реакция С6Н12О6 →2С2Н5ОН+2СО2 относится к экзотермическим. Реакция протекает:
а) только в прямом направлении
б) реакция обратима
в) направление реакции определить нельзя.
