
- •1.Классификация органических соединений. Важнейшие функциональные группы. Примеры.
- •2. Понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
- •3. Классификация органических реакций (по механизму и по конечному результату). Гомолитический и гетеролитический способы разрыва связей. Электрофильные и нуклеофильные реакции. Примеры.
- •5.Особенности многоатомных спиртов. Биологическая роль этиленгликоля и глицерина.
- •6.Химические свойства фенолов: кислотно-основные, окислительно-восстановительные.
- •7. Карбонильные соединения: альдегиды, кетоны. Строение, классификация. Примеры.
- •8.Тип гибридизации атомных орбиталей карбонильного атома углерода. Распределение электронной плотности в молекулах. Реакционные центры альдегидов и кетонов: электрофильный, основный, сн-кислотный.
- •10.Взаимодействие альдегидов а) со спиртами (образование ацеталей и полуацеталей); б) с водой; в) с аммиаком, аминами (образование иминов-оснований Шиффа); г) с циановодородной кислотой.
- •11. Окислительно-восстановительные свойства альдегидов и кетонов: реакции альдольной и кротоновой конденсации, окисление альдегидов, кетонов, биологическое окисление.
- •14.Образование сложных эфиров, тиоэфиров, амидов, ангидридов, галогенгидридов карбоновых кислот. Ацетилкофермент а in vivo как переносчик ацильных групп на нуклеофильные субстраты.
- •16.Гетерофункциональные органические соединения (кетокислоты, гидроксикислоты, аминокислоты, аминофенолы, аминоспирты. Привести примеры.
- •17. Α-Аминокислоты. Строение, классификация α-Аминокислот по природе радикала: алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты. Привести примеры.
- •18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
- •21. Липиды как сложная по составу группа органических веществ. Классификация липидов: химическая и функциональная. Биологическая роль липидов.
- •22. Высшие жирные кислоты (вжк): строение, конфигурация двойных связей, биологическая роль.
- •23. Омыляемые простые липиды: а) воски (спермацет, пчелиный воск); б) жиры, масла. Триаглицерины: общая структура, твердые, жидкие. Примеры. Свойства липидов: гидролиз, реакция
- •24. Омыляемые сложные липиды. Фосфолипиды, классификация. Фосфатидные кислоты. Фосфатидилэтаноламин, фосфатидилхолин, фосфатидилсерины, фосфатидилинозиты, плазмагены.
11. Окислительно-восстановительные свойства альдегидов и кетонов: реакции альдольной и кротоновой конденсации, окисление альдегидов, кетонов, биологическое окисление.
Конденсацией называют реакцию, приводящую к возникновению новой углерод-углеродной связи, причем из двух или нескольких относительно простых молекул образуется новая, более сложная молекула.
Продукт реакции, содержащий гидроксильную и альдегидную группы, называется альдолем (от слов альдегид и алкоголь), а сама реакция получила название альдольной конденсации, или альдольного присоединения.
Механизм альдольной конденсации
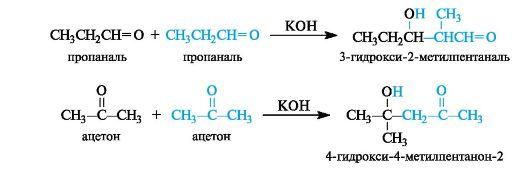
Продукт конденсации - альдоль - способен к отщеплению воды с образованием α,β-ненасыщенного карбонильного соединения. Обычно это происходит при повышенной температуре. В этом случае реакция в целом называется кротоновой конденсацией.
![]()
Окисление альдегидов в карбоновые кислоты осуществляется под действием большинства окислителей, включая кислород воздуха. Кетоны в мягких условиях не окисляются.
![]()
Оксид серебра в виде аммиачного комплекса [Ag(NH3]2OH (реактив Толленса) окисляет альдегиды в карбоновые кислоты, при этом выделяется металлическое серебро. Отсюда происходит название - реакция «серебряного зеркала».
![]()
Так же легко альдегиды окисляются гидроксидом меди(II) в щелочной среде.
![]()


12. Карбоновые кислоты: строение, классификация. Тип гибридизации атомных орбиталей карбоксильного атома углерода. Электронное строение карбоновых кислот: р,п-сопряжение, +М-эффект ОН-группы, +I-эффект бокового радикала.

Карбоновые кислоты благодаря карбоксильной группе полярны и могут участвовать в образовании межмолекулярных водородных связей (см. 2.2.3). Такими связями с молекулами воды объясняется неограниченная растворимость низших кислот (C1-C4). В молекулах карбоновых кислот можно выделить гидрофильную часть (карбоксильную группу СООН) и гидрофобную часть (органический радикал R). По мере возрастания доли гидрофобной части снижается растворимость в воде.
В зависимости от природы органического радикала карбоновые кислоты могут быть алифатическими (насыщенными или ненасыщенными) RCOOH и ароматическими ArCOOH . По числу карбоксильных групп они подразделяются на монокарбоновые, дикарбоновые и трикарбоновые.


Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118-122,5°
П-электроны взаимодействуют с р-электронами кислорода гидро-ксигруппы, а это приводит к сопряжению. Поляризация связи С=0 резко возрастает за счет дополнительного стягивания неподеленной пары электронов (р-электронов) атома кислорода ОН-группы. Вследствие такого смещения электронной плотности связь О—Н в гид-роксигруппе ослабляется, и атом водорода легко отщепляется в виде иона Н-. Поэтому именно гидроксигруппа участвует почти во всех реакциях: она или замещается, или диссоциирует по кислотному типу.
В карбоксилат-ионе происходит перераспределение электронной плотности между двумя атомами кислорода и углеродом. В результате двойная связь практически отсутствует в растворах кислот:

Так как влияние атомов взаимно, карбоксильная группа оказывает влияние на радикал. В результате этого атомы водорода соседнего с функциональной группой отличаются большей подвижностью от других атомов водорода радикала и могут замещаться.
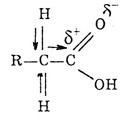
13. Реакционные центры в молекулах карбоновых кислот:ОН-кислотный, СН-кислотный, электрофильный. Изменение кислотных свойств в гомологическом ряду карбоновых кислот и при введении в боковой радикал электроноакцепторного заместителя..
Особенности электронного строения карбоновых кислот обусловливают существование нескольких реакционных центров:
ОН-кислотный центр, обусловленный сильной поляризацией связи О-Н;
• электрофильный центр - атом углерода карбоксильной группы;
• n- основный центр - атом кислорода карбонильной группы с неподеленной парой электронов;
• слабый СН-кислотный центр, проявляющийся только в производных кислот, так как в самих кислотах имеется несравненно более сильный ОН-кислотный центр.

Кислотные свойства карбоновых кислот проявляются в их способности отщеплять протон. Повышенная подвижность водорода обусловлена полярностью связи О-Н за счет р,п-сопряжения.
Длина и разветвленность насыщенного алкильного радикала не оказывает существенного влияния на кислотные свойства карбоновых кислот. В целом алифатические монокарбоновые кислоты обладают практически одинаковой кислотностью (pKa 4,8-5,0), за исключением муравьиной кислоты, у которой кислотность на порядок выше.На кислотность карбоновых кислот значительно влияют заместители, введенные в углеводородный радикал. Независимо от механизма передачи электронного влияния заместителя в радикале (индуктивного или мезомерного), электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анионы и тем самым увеличивают кислотность. Электронодонорные заместители, напротив, ее понижают.
