
- •Термодинамика растворов сильных электролитов. Теория Дебая ‒ Хюккеля
- •Основополагающая концепция для сильных электролитов ‒
- •Понятия теории Дебая ‒ Хюккеля
- •Активность (а) – …
- •Активность
- •Ионная сила раствора
- •Правило ионной силы
- •Зависимость γ ионов от I раствора
- •Средние значения коэффициентов активности ионов
- •Положения теории сильных электролитов
- •Предельный закон Дебая – Хюккеля …
- •Ограниченность теории Дебая – Хюккеля и предельного закона
- •Объяснение хода экспериментальной кривой

Термодинамика растворов сильных электролитов. Теория Дебая ‒ Хюккеля
Лекция №12 курса «Физическая и коллоидная химия»
Лектор: профессор ИВАНОВА Надежда Семёновна
1
Основополагающая концепция для сильных электролитов ‒
высокая концентрация ионов в растворе и, как результат, электростатического взаимодействия между ионами разного заряда.
Теория сильных электролитов
(1923г.) Дебая и Хюккеля имела целью отразить влияние этого взаимодействия на различные свойства растворов электролитов. 2

Понятия теории Дебая ‒ Хюккеля
Активность Ионная сила раствора
3

Активность (а) – …
Гилберт Ньютон
Льюис
(1875-1946)
… концентрационный параметр; определяется как величина, подстановка которой вместо концентрации в термодинамические уравнения делает их применимыми к растворам электролитов.
4

Активность
а= γ · с
а– активность вещества, моль/дм3;
γ– молярный коэффициент (безразмерная величина);
с – молярная концентрация вещества, моль/дм3. Для разбавленных растворов γ = 1, а = с.
γ– мера отклонения свойств реального раствора электролита от идеального
–мера различия поведения электролита в данном растворе и его поведения в идеальном. 5

Ионная сила раствора
(I) – …
… величина, характеризующая силу электростатического воздействия ионов в растворе электролита.
I = ½ (C1Z12 + C2Z22 + C3Z32 + …)
ионная сила равна полу-сумме произведения концентраций всех ионов на квадрат заряда.
γ – мало зависит от природы вещества, определяется лишь ионной силой раствора: один и тот же во всех разбавленных растворах с одинаковой ионной силой.
6

Правило ионной силы
«Коэффициенты активности элемента, а, следовательно, и коэффициенты активности его ионов зависят от ионной силы, но не зависят от вида остальных ионов в данном растворе»;
«Элемента (или его ионов) одинаковы в растворах равной ионной силы независимо от того, какие ещё ионы есть в растворе».
Выполняется в растворах с I ≤ 0,05.
7
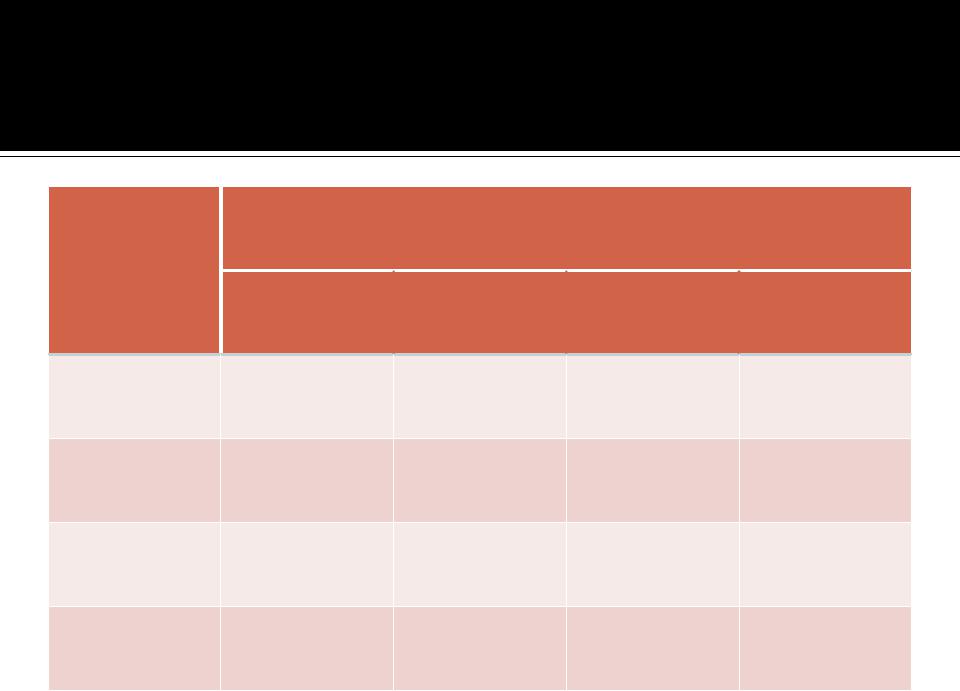
Зависимость γ ионов от I раствора
Ионная сила раствора Ионы  0,001
0,001  0,005
0,005  0,01
0,01  0,05
0,05
OH– |
0,98 |
0,95 |
0,92 |
0,86 |
Na+ |
0,98 |
0,95 |
0,92 |
0,84 |
H+ |
0,98 |
0,95 |
0,92 |
0,88 |
Hal– |
0,98 |
0,95 |
0,92 |
0,84 |
8
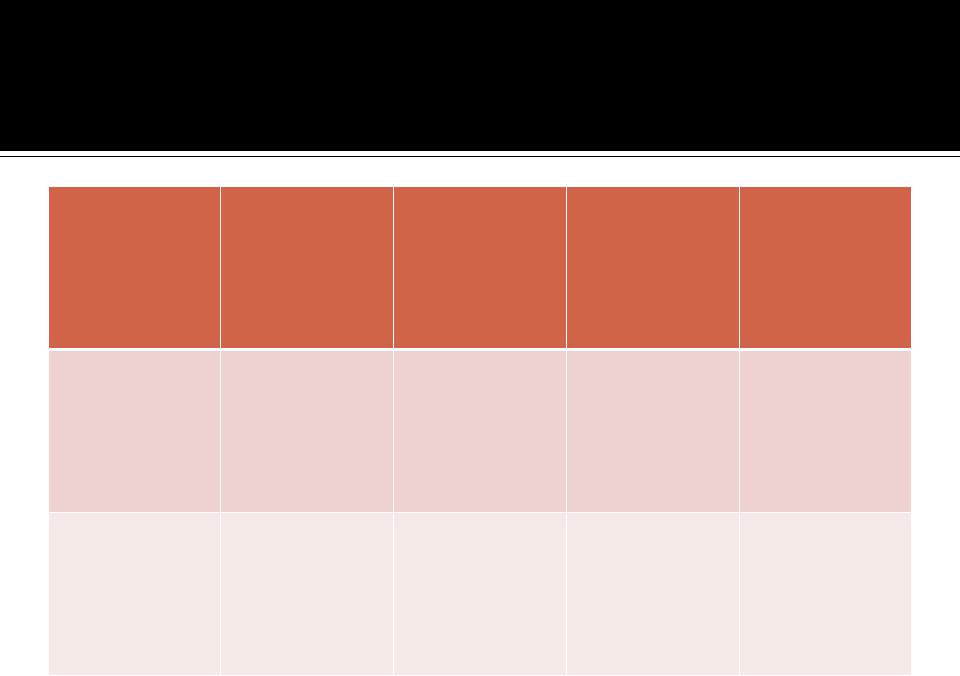
Средние значения коэффициентов активности ионов
I |
0,001 |
0,01 |
0,02 |
0,05 |
Однозар |
0,98 |
0,92 |
0,89 |
0,85 |
ядные |
||||
ионы |
|
|
|
|
Двухзар |
0,77 |
0,58 |
0,50 |
0,40 |
ядные |
||||
ионы |
|
|
|
|
9

Положения теории сильных электролитов
1.Вокруг каждого иона в растворе образуется ионная атмосфера за счёт электростатического притяжения ионов различного заряда. Ионная атмосфера содержит ионы разных знаков, но вокруг катиона больше
аниона и наоборот; 
 +
+  –
– 
2.Плотность ионной атмосферы max у

 центрального иона и уменьшается при удалении от него за счёт теплового движения ионов. На границе ионной атмосферы количество ионов каждого знака становится одинаковым.
центрального иона и уменьшается при удалении от него за счёт теплового движения ионов. На границе ионной атмосферы количество ионов каждого знака становится одинаковым.
10
