

ОБМЕН ЖЕЛЕЗА
Железо в организме находится в составе
•примерно 25% всего железа в запасной форме (в комплексе с белком ферри-
тином) в селезенке, костном мозге, печени;
•в миоглобине и других внутриклеточных гемопротеинах (каталаза, цитохромы и
пр);
•только 0,1% железа находится в плазме крови;
•в составе гемоглобина – около 2/3 всего количества.
Суточная потребность
мужчины |
10 мг |
женщины |
20 мг |
при лактации |
30-40 мг |
при беременности |
40-50 мг |
Пищевые источники (в 100 г)
Растительная пища |
|
Животная пища |
||
Морская капуста |
16 мг |
Печень |
|
11-15 мг |
Какао |
12,5 мг |
Мясо |
|
2-4 мг |
Шиповник |
12 мг |
Яйца |
|
3 мг |
Отрубной хлеб |
11 мг |
|
|
|
Гречка |
8 мг |
|
|
|
Свежие белые грибы |
5 мг |
|
|
|
Яблоки |
0,22 мг |
|
|
|
Всасывание
При попадании в желудок под действием HCl желудочного сока железо высво-
бождается из элементов пищи.
Всасывание происходит в проксимальном отделе тонкого кишечника. При этом железо должно быть в виде двухвалентного иона, в то же время с пищей посту-
пает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+
используется аскорбиновая кислота. Только железо мясных продуктов находится в двухвалентной гемовой форме, и поэтому хорошо всасывается.
Железо мясных продуктов усваивается на 20-30%, из яиц и рыбы - на 10-15%, из растительных продуктов - на 1-5%.
Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина (чай, кофе, напитки), фосфатов, танина (чай), оксалатов (растительные
продукты) ухудшает всасывание железа.
Метаболизм железа
После всасывания железо либо откладывается в клетках кишечника в составе ферритина (Fe3+), либо сразу попадает в кровоток и в комплексе с трансферри-
ном (Fe3+) переносится в печень, костный мозг или другие ткани, где также связывается с ферритином. Вне связи с белками железо очень токсично, так как запускает свободно-радикальные реакции с образованием активных форм кислорода.
10
При недостаточности железа в организме в первую очередь используется:
•железо из депо (ферритин),
•затем в клетке снижается количество гемопротеинов до жизнеспособного минимума,
•далее истощаются запасы сывороточного железа (трансферрин),
•в последнюю очередь страдает синтез гемоглобина.
Таким образом, железодефицитная анемия является проявлением крайнего дефицита железа и концентрация гемоглобина крови не должна быть критерием
обеспеченности организма железом!
Выведение
В сутки обычные потери железа составляют 1-2 мг и происходят несколькими путями:
•с желчью
•вместе со слущивающимся эпителием ЖКТ
•десквамация кожи
•выпадение волос, срезание ногтей
Женщины
Уженщин детородного возраста основные потери вызывают менструальные кровотечения. Известно, что около 20% женщин теряет 20 мл крови, 70% - 40-60 мл крови, 5% - 100 мл, 5% - 200 мл крови за цикл. Учитывая, что в 1 мл крови находится около 0,7 мг железа, потери железа составляют от 14 мг до 140 мг.
Во время беременности мать отдает ребенку 300-500 мг железа, особенно активно это происходит на 28-32 неделях, когда ребенок забирает у матери по 22 мг в неделю.
При лактации потери железа у матери составляют 11-12 мг/сут.
Мужчины
Умужчин основной причиной железодефицитных состояний являются кровопотери через ЖКТ. К сожалению, методы определения скрытой крови в кале низкочувствительны и позволяют обнаружить крови только при ее количестве свыше 15 мл (10,5 мг железа) в суточной порции кала.
Симптомы железодефицита
Недостаточный синтез цитохромов и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспе-
цифических симптомов:
•ухудшение внимания и памяти у детей и взрослых,
•иногда детская гиперактивность,
•уплощение, неровность и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях,
•выпадающий и секущийся волос,
•поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног,
•неинфекционный ларингофаринготрахеит (гиперемия и охриплость), что дез-
ориентирует врача,
•мышечная слабость:
-общая утомляемость,
-недостаточное сокращение сфинктеров мочевого пузыря, при этом характерным признаком является выделение нескольких капель мочи при резком кашле, смехе, чихании,
-недостаточное сокращение сфинктеров пищевода, что позволяет забрасы-
ваться соляной кислоте в пищевод и вызывать изжогу,
10
•атрофический гастрит - может быть как причиной, так и следствием железоде-
фицита, половина больных гастритом имеет недостаток железа,
•обострение ИБС и других сердечно-сосудистых заболеваний, так как усиливает гипоэнергетическое состояние клеток (снижение содержания цитохромов в
миокардиоцитах),
•извращение обонятельных предпочтений - нравится запах краски, бензина, выхлопных газов, резины, мочи,
•извращение вкусовых предпочтений - больные едят мел, штукатурку, уголь,
песок, мясной фарш, лед.
По данным ВОЗ за 2002-2003 г.г. количество больных анемиями на Земле достигло 1.970.300.000 человек, из них 90% составила железодефицитная анемия. в западных странах недостаток железа имеется у 15-20% населе-
ния, в России и развивающихся странах – у более чем 50%.
Дети, страдавшие железодефицитными анемиями в 4 месяца, и получив-
шие ее адекватную коррекцию к 1 году отставали от сверстников в интеллектуальном развитии – IQ=94 балла, против 104 баллов в контроле, физическом развитии – 86 баллов против 96. В пятилетнем возрасте от-
ставание еще сохранялось.
ГЕМОГЛОБИН
Гемоглобин представляет собой белок, включающий 4 гемсодержащие субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водо-
родными связями по принципу комплементарности.
ОБМЕН ГЕМА
Строение
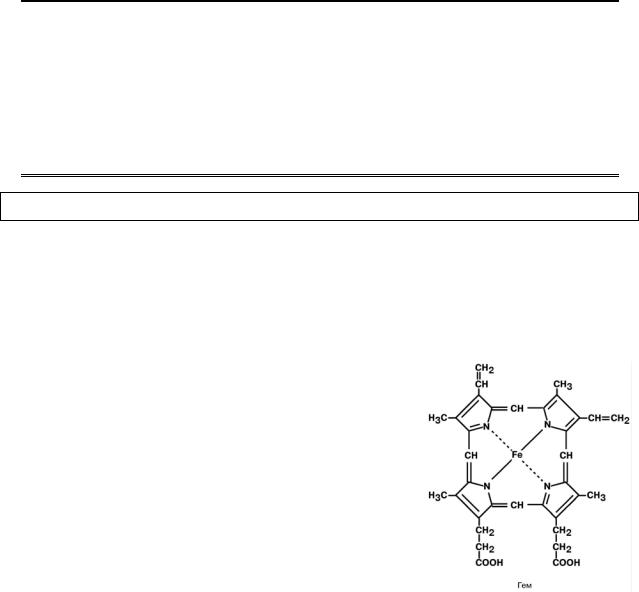
Гем – небелковая часть гемопротеинов:
•гемоглобин (85% общего количества гема) лока-
лизованный в эритроцитах и клетках костного
мозга,
•миоглобин скелетных мышц и миокарда (17%),
•цитохромы, каталаза, пероксидаза и т.д. – менее
1%
10
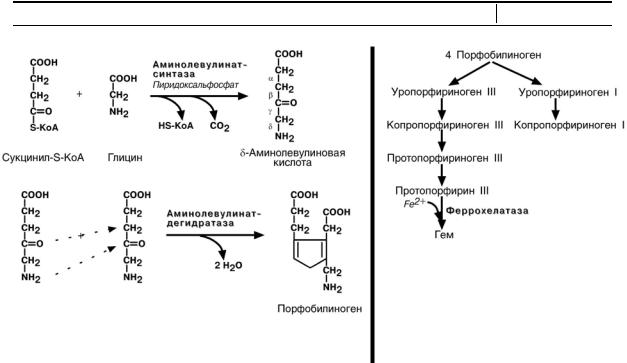
Синтез
Синтез в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с уча-
стием δ-аминолевулинат-синтазы происходит в митохондриях. Следующая ре-
акция при участии аминолевулинат-дегидратазы протекает в цитозоле.
Аминолевулинат-дегидратаза содержит Zn и ингибируется ионами свинца.
Регуляция
Регуляторным ферментом синтеза гема является аминолевулинат-синтаза. Гем после взаимодействия с молекулой апорепрессора формирует активный ре-
прессорный комплекс и подавляет синтез фермента.
Положительным модулятором этого же фермента служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента.
В печени повышение активности аминолевулинат-синтазы вызывают соедине-
ния, усиливающие работу микросомальной системы окисления – при этом возрастает потребление гема для образования цитохрома Р450. Результатом является
снижение внутриклеточной концентрации гема и дерепрессия синтеза фермента. Железо оказывает синергический эффект при индукции аминолевулинат-
синтазы.
БЕЛКОВЫЕ СУБЪЕДИНИЦЫ
Белковые субъединицы в нормальном гемоглобине могут быть представлены
различными типами полипептидных цепей: α (альфа), β (бета), γ (гамма), δ (дельта), ξ (кси). В состав молекулы входят по две цепи двух разных типов.
Гем соединяется со "своей" белковой субъединицей, во-первых, через остаток
гистидина координационной связью железа, во-вторых, через гидрофобные связи
пиррольных колец и гидрофобных аминокислот. Он располагается как бы "в кармане" своей цепи.
Протомеры соединяются благодаря образованию гидрофобных, ионных, водородных связей. При этом они взаимодействуют не произвольно, а определен-
ным участком – контактной поверхностью. Этот процесс высокоспецифичен, од-
10
новременно происходит в десятках точек по принципу комплементарности.
Взаимодействие осуществляют разноименно заряженные группы, гидрофобные
участки, неровности на поверхности.
РЕГУЛЯЦИЯ ПРИСОЕДИНЕНИЯ КИСЛОРОДА
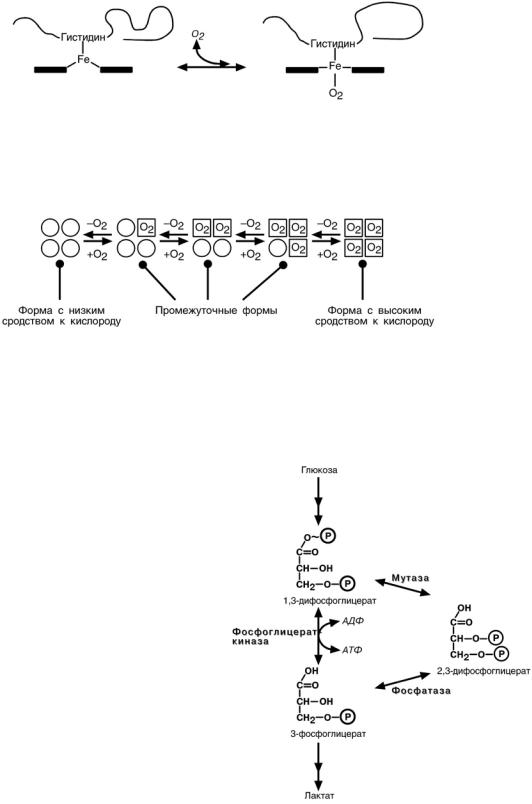
Кооперативное взаимодействие
В легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород ос-
тается вне плоскости.
Это вызывает перемещение участка белковой цепи и изменение конформации
первого протомера и, впоследствии, других протомеров. Взаимовлияние протоме-
ров друг на друга называется кооперативное взаимодействие и ускоряет при-
соединение в легких кислорода к гемоглобину в 300 раз.
В тканях идет обратный процесс и ускорение отдачи кислорода также
300-кратное.
Роль 2,3-дифосфоглицерата
2,3-дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата,
промежуточного метаболита гликолиза, в реакциях получивших название шунт Раппопорта.
При снижении концентрации кислорода в эритроцитах повышается содержание 2.3-дифосфоглицерата. Он рас-
полагается в центральной полости тет-
рамера дезоксигемоглобина и связы-
вается с β-цепями, образуя поперечный
солевой мостик между атомами кисло-
рода 2.3-дифосфоглицерата и концевы-
ми аминогруппами валина, аминогруп-
пами остатков лизина и гистидина.
Функция 2,3-дифосфоглицерата за-
ключается в снижении сродства гемо-
глобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание ки-
10
слорода с гемоглобином в легких не нарушается, так как концентрация его отно-
сительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислоро-
да возрастает в 2 раза.
Изменение рН среды
В тканях при повышении концентрации протонов (закисление среды) возрас-
тает освобождение кислорода из оксигемоглобина, в легких при увеличении концентрации кислорода высвобождаются протоны из гемоглобина. Этот феномен
носит название эффекта Бора.
Датский физиолог Христиан Бор, отец знаменитого Нильса Бора.
Реакция связывания кислорода гемоглобином упрощенно имеет вид:
Это означает, что в легких поступающий кислород будет вытеснять водород из
связи с гемоглобином, а при добавлении протонов водорода начнется реакция
диссоциации оксигемоглобина
НАРУШЕНИЕ СИНТЕЗА ГЕМОГЛОБИНА
Порфирии
Порфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяют наследственные и приобретенные формы порфирии.
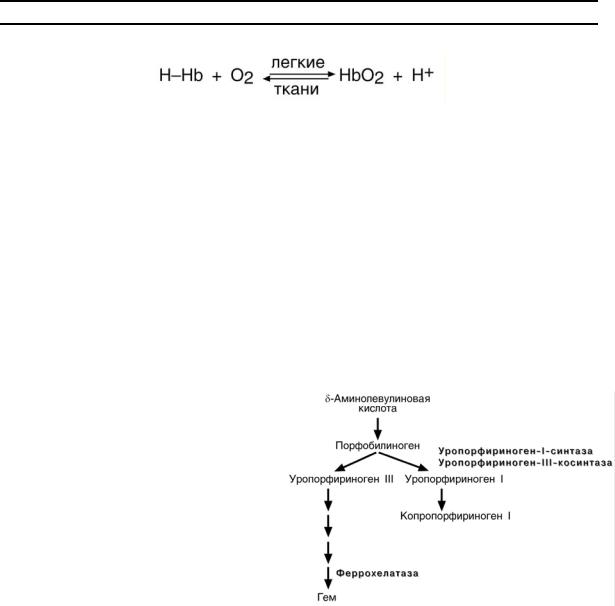
При наследственных формах дефект фермента наблюдается во всех клетках организма, но проявляется только в одном типе клеток. В наследственных формах имеются три большие группы:
1. Печеночные – группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина III. Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, проявляющаяся после достижения половой зрелости. У гетерозигот активность уропор-
фириноген-I-синтазы снижена на
50% и больные экскретируют с мочой
большие количества порфобилиноге-
на и аминолевулиновой кислоты. На свету порфириноген окисляется в ок-
рашенные порфобилин и порфирин, и
это является причиной потемнения мочи при ее стоянии на свету при доступе воздуха.
Провокацией к обострению состояния часто является прием лекарственных
препартов, метаболизм которых требует участия цитохрома Р450, что повышает потребление гема, снижает его концентрацию в гепатоците и активирует амино-
левулинат-синтазу. Симптомами являются острые боли в животе, запоры, сер-
дечно-сосудистые нарушения, нервно-психические расстройства.
10
2.Эритропоэтические – аутосомно-рецессивные нарушения уропорфирино-
ген-I-синтазы или уропорфириноген-III-косинтазы в эритроидных клетках. При
этом смещается баланс реакций образования уропорфириногенов сторону синтеза уропорфириногена I. Симптомы заболевания схожи с предыдущим, но до-
полнительно наблюдается светочувствительность кожи, обусловленная нали-
чием уропорфириногенов, кроме этого отмечаются трещины на коже и гемолитические явления.
3.Смешанные.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингиби-
рование порфобилиноген-синтазы, феррохелатазы и др.), лекарственными препа-
ратами (антигрибковый антибиотик гризеофульфин)
Следует отличать заболевания порфирии от симптома – порфиринурии. Порфиринурия сопровождает приобретенные заболевания и интоксикации (различного генеза) в результате которых происходит повреждение кле-
ток РЭС и гепатоцитов. Порфиринурии могут также иметь место при некоторых аллергических заболеваниях или при авитаминозах фолиевой и ни-
котиновой кислот. В отличие от порфирий, при порфиринурии в моче в повышенном количестве содержится, главным образом, копропорфирин.
Талассемии
Для таласемий характерно снижение синтеза α-цепей гемоглобина (α-
талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза,
гемолизу и тяжелым анемиям.
НОРМАЛЬНЫЕ И ПАТОЛОГИЧЕСКИЕ ФОРМЫ ГЕМОГЛОБИНА
Нормальные формы
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в ле-
гочных венах его 94-98% от всего количества гемоглобина.
Hb-CO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови его 15-20% от всего количества гемоглобина.
Патологические формы
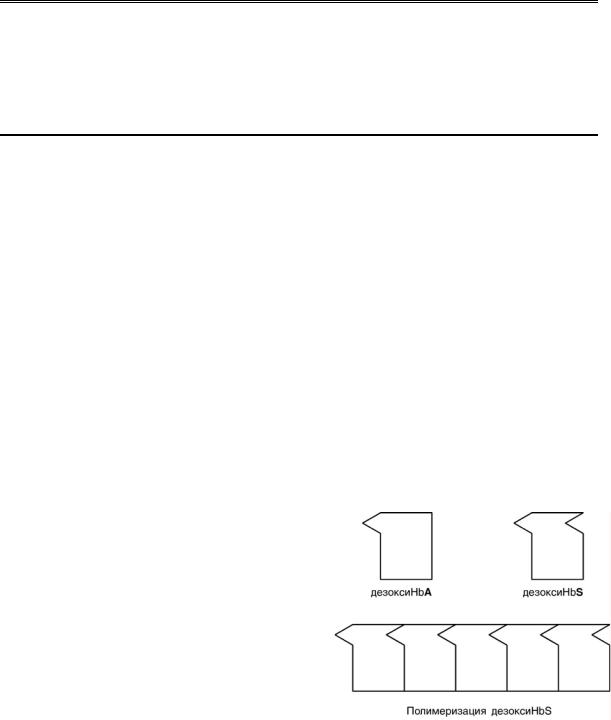
HbS – гемоглобин серповидно-
клеточной анемии. При этом нарушении в
ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за
собой включение в 6-м положении β-цепи
вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет измене-
ние свойств всей молекулы и формирова-
ние на поверхности гемоглобина "липкого"
участка. При дезоксигенации гемоглобина участок "раскрывается" и связывает одну молекулу гемоглобина с другими. Результатом является полимеризация гемоглобино-
вых молекул и образование крупных белко-
10
вых тяжей, вызывающих деформацию эритроцита и гемолиз.
metHb – метгемоглобин, форма гемоглобина, включающая трехвалентный
ион железа вместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление.
При использовании сульфаниламидов, нитритов натрия, потреблении нитратов
ускоряется переход Fe2+ в Fe3+. MetHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа используют аскорбино-
вую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях,
но его доля может колебаться от условий и образа жизни. Так, у если горожан до-
ля Hb-CO составляет около 2%, то у курильщико – до 10% от всего гемоглобина. Опасность наличия такой формы заключается в увеличенном в 200 раз сродстве
гемоглобина к СО по сравнению с O2. Вследствие этого при отравлениях возника-
ет острая гипоксия тканей, усугубляющаяся связыванием СО также и с другими гемопротеинами, например цитохромами дыхательной цепи.
HbA1c – гликозилированный гемоглобин, концентрация его нарастает при хро-
нической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
МИОГЛОБИН
Миоглобин является одиночной полипептидной цепью, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани. Миоглобин обладает более высоким сродством к кислороду по сравнению с гемоглобином. Это свойство обуславливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального
давления О2 в мышце (до 1-2 мм Hg).
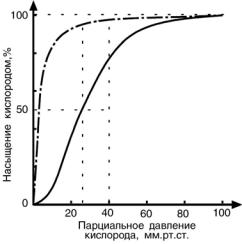
Кривые насыщения кислородом показывают отличия миоглобина и гемоглобина:
•одно и то же 50%-е насыщение достигается при совершенно разных концентрация кислорода – около 26 мм рт ст для гемоглобина и 5 % для миоглобина
•при физиологическом парциальном давле-
нии кислорода от 26 до 40 мм рт ст гемо-
глобин насыщен на 50-80%, тогда как миоглобин – почти на 100%.
Таким образом, миоглобин остается окси-
генированным до того момента, пока количество кислорода в клетке на снизится до предельных величин. Только после этого начинается отдача кислорода для
реакций метаболизма.
КАТАБОЛИЗМ ГЕМА.
За сутки у человека распадается около 9 г гемопротеидов, в основном это гемоглобин эритроцитов. Эритроциты живут около 120 дней, после чего лизируются в кровяном русле или в селезенке.
10
При разрушении эритроцитов в кровяном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция
α2-глобулинов крови) и переносится в клетки селезенки (главным образом), печени и костного мозга.
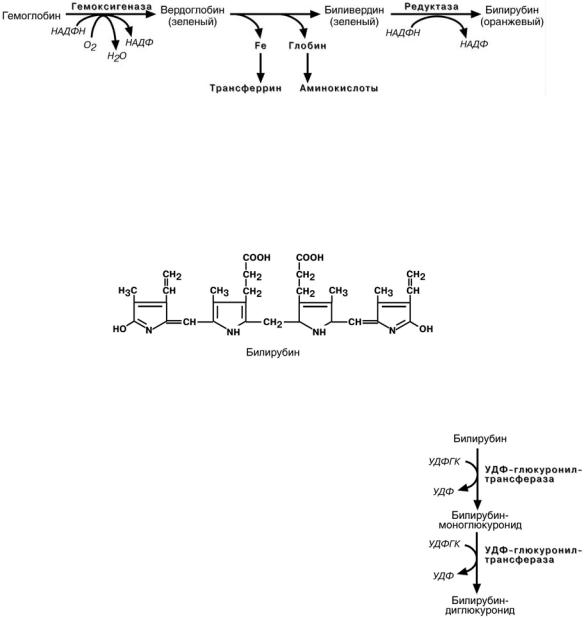
Катаболизм гема представляет собой многоступенчатый процесс
В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами с их восстановлением, отщеплением железа и
белковой части с образованием оранжевого пигмента билирубина. Это токсичное,
жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках, в первую очередь в нервной ткани.
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы (частично в виде альбуминфосфатидного комплекса), в меньшем количестве — в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов предотвращает выделение билирубина с мочой.
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (лигандина). В клетке протекает реакция связывания билирубина с УДФ-
глюкуроновой кислотой, при этом образуются моно- и
диглюкурониды. Кроме глюкуроновой кислоты, в реакцию могут вступать сульфаты, фосфаты, глюкозиды.
После этого билирубин-глюкурониды АТФ-
зависимым переносчиком секретируются в желчные протоки, где. при участии β-глюкуронидазы, вновь превращаются в свободный
билирубин, который с током желчи попадает в тонкий кишечник. Одновременно
некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь
по межклеточным щелям.
10
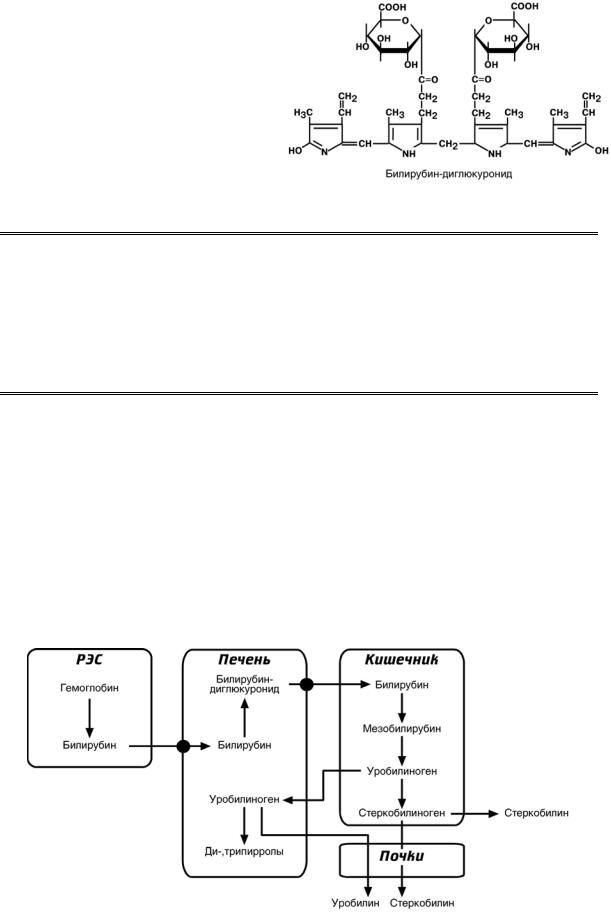
Таким образом, в крови одно-
временно существуют две формы
билирубина: одна является гидрофобной, всегда попадает в кровь
при катаболизме гемоглобина. Эта
форма называется неконъюгиро-
ванный (свободный) или непря-
мой билирубин. Билирубин-
глюкуронид, который в норме может быть в крови, получил назва-
ние связанный (конъюгирован-
ный) или прямой билирубин.
Названия "свободный" или "связанный" определяют строение билирубина, а именно наличие в его структуре глюкуроновой кислоты.
Названия "прямой" или "непрямой" отражают химические свойства разных
форм билирубина – гидрофобный непрямой билирубин плохо реагирует с реактивом Эрлиха, и требует наличия дополнительных веществ (ускори-
телей, акселераторов) для протекания реакции Ван-ден-Берга. Прямой билирубин гидрофилен и с реактивом Эрлиха реагирует прямо, без посредни-
ков.
С током желчи прямой билирубин поступает в кишечник, где подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть последних всасывается и с током крови вновь попадает в печень, где окисляется до ди- и трипирролов. При этом в здоровом организме в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами. Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена и выделяется из организма, окрашивая кал. Незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и выделяется с мочой. На воздухе стеркобилиноген и уробилиноген превращаются, соответственно, в стер-
кобилин и уробилин.
