- •Предмет и задачи биохимии. История биохимии
- •Краткая история развития биохимии
- •Белки как уникальный класс биополимеров
- •Физико-химические свойства белков
- •Элементный состав белков
- •Форма белковых молекул.
- •Функции белков.
- •Физико-химические свойства аминокислот
- •Цвиттер-ион
- •Экспериментальные доказательства полипептидного строения белков
- •Классификация белков
- •Структурная организация белков.
- •Определение первичной структуры белка (псб).
- •Вторичная структура белка (всб).
- •Беспорядочный клубок
- •Денатурация и ренативация белка
- •Гемоглобинозы
- •Методы выделения и очистки белков.
- •Методы определения Mr белков
- •Методы определения гомогенности белков
- •Нуклеиновые кислоты
- •Состав нуклеиновых кислот
- •Углеводная часть
- •Состав нуклеиновых кислот
- •Наиболее распространенные нуклеотиды клетки.
- •Вторичная структура днк. Правила Чаргаффа.
- •Синтез белка
- •1. Образование 40s-комплекса инициации
- •2. Образование 80s-комплекса инициации
- •Ферменты
- •Современная классификация ферментов и их номенклатура
- •Номенклатура ферментов.
- •Механизм действия ферментов
- •Кинетика ферментативных реакций
- •Специфичность действия ферментов
- •Регуляция активности ферментов.
- •Методы регуляции активности ферментов
- •Витамины
- •По механизму действия антивитамины делятся на 2 группы:
- •Пути метаболизма витаминов в организме.
- •Жирорастворимые витамины.
- •Водорастворимые витамины.
- •Витаминоподобные вещества.
- •Введение в метаболизм
- •Современные представления о дыхательной цепи переноса электронов. (эпц).
- •Общие и специфические пути катаболизма
- •Цикл трикарбоновых кислот.
- •1 Мол. Фад·н2 2 мол. Атф
- •Обмен углеводов
- •Амилопектин амилоза
- •Синтез и распад гликогена
- •Гликоген
- •Синтез глюкозы из глицерина
- •Механизм фосфорилитического отщепления остатка глюкозы от гликогена.
- •Гликолиз
- •1 Стадия
- •2 Стадия
Механизм действия ферментов
Большую
роль в развитии представлений о механизме
действия ферментов сыграли классические
работы Михаэлиса
и Ментен,
которые развили положения о Е-S-х
комплексах. Согласно их представлениям
(1915г.), ферменты обратимо соединяются
со своим S,
образуя нестойкий
промежуточный продукт
– Е-S-комплекс,
![]() который
в конце реакции распадается на ферменты
и продукты реакции (Р). Фактически в
природе идет ступенчатое превращение
S
через целый ряд промежуточных реакций:
ES1→
ES2→
ES3
… → E
+ P.
Схематически преобразование S
в Р можно представить таким образом:
который
в конце реакции распадается на ферменты
и продукты реакции (Р). Фактически в
природе идет ступенчатое превращение
S
через целый ряд промежуточных реакций:
ES1→
ES2→
ES3
… → E
+ P.
Схематически преобразование S
в Р можно представить таким образом:
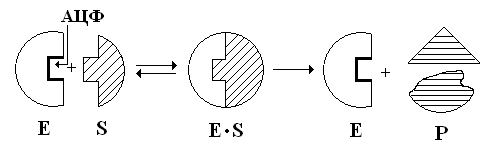
АЦФ, как правило, располагается в глубине молекулы Е.
Математическая обработка реакции образование ЕS-комплекса позволила вывести уравнение, которое называется уравнением Михаэлиса-Ментен:
![]()
где Vфр – наблюдаемая скорость фр;
Vmax – максимальная скорость фр при неполном насыщении фермента S-том;
[S] – концентрация S;
Км – константа Михаэлиса-Ментен.
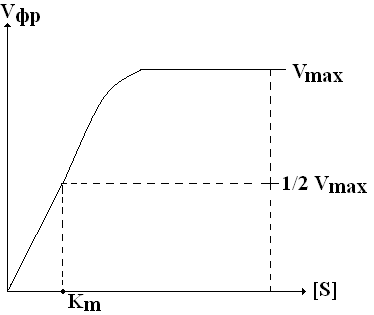
Графически уравнение Михаэлиса-Ментен имеет следующий вид:
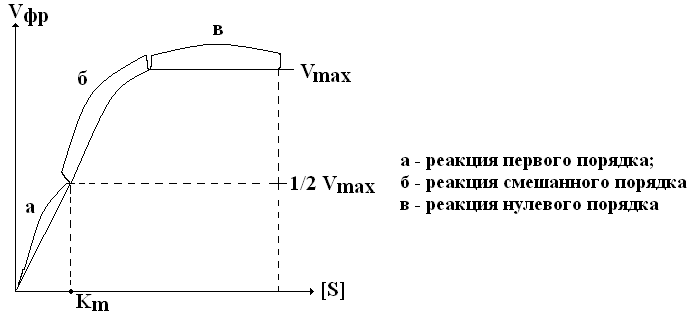
При низкой [S] Vфр прямо пропорциональна [S] в каждый данный момент времени (реакция 1-го порядка).
Из уравнения Михаэлиса-Ментен также следует, что при низком значении Км и высоком значении [S] Vфр является максимальной (в) и не зависит от [S] – это реакция нулевого порядка. Реакция нулевого порядка соответствует явлению, которое называется полным насыщением фермента субстратом.
Гипербола, выражающая зависимость Vфр от [S], называется кривой Михаэлиса. Чтобы правильно определить активность ферментов, нужно добиться реакции нулевого порядка, то есть определять Vфр при насыщающих концентрациях S.
|
|
Км численно равна [S] (моль(л)), при которой V реакции равна половине от максимальной. Для определения численного значения Км находят ту [S], при которой Vфр составляет от ½ от Vmax. Таким образом, определение Км играет важную роль для выяснения МД модификаторов на активность фермента. |
|
|
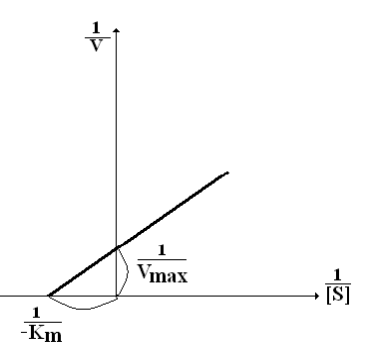
Иногда график строят методом двойных обратных величин – метод Лайнуивера-Бэрка: Значение как Vmax, так и Км более точно определяется методом двойных обратных величин. |
ЛЕКЦИЯ 7
Кинетика ферментативных реакций
Vфр определяется количеством вещества, которое превращается в единицу времени. V этих реакций зависит от влияния внешних факторов (температура, рН, воздействие природных и чужеродных соединений и т.д.).
Vфр является мерой каталитической активности и обозначается просто как активность ферментов.
Измерить активность ферментов можно только косвенно:
1) по количеству превращаемого S;
2) нарастанию концентрации Р в единицу времени.
Для выражения концентрации фермента пользуются:
а) единица измерения ферментов – это то количество фермента, которое катализирует превращение 1 мкмоля S в мин. [мкмоль/мин];
б) 1 катал (кат) – количество ферментов, способное вызывать превращение 1 моля S в Р в 1 сек. [моль/с].
1 кат = 6×107Е; 1Е = 16,67 (н кат)
Для выражения активности ферментов пользуются:
а) удельная активность ферментов – это число ферментов на 1 мг или число кат. на 1 кг белка;
б) молекулярная активность или число оборотов – это число молекул S, подвергающихся превращению одной молекулой Е в 1 мин.
Одна молекула каталазы эритроцитов расщепляет в 1 мин 5×106 молекул Н2О2.