
- •Кафедра биохимии
- •Химический состав печени
- •Особенности энергетического обмена в печени
- •Роль печени в углеводном обмене
- •1. Основная роль печени в углеводном обмене - поддержание гомеостаза глюкозы в крови.
- •2. Печень удаляет из крови излишки фруктозы и галактозы.
- •3. Печень синтезирует глюкуроновую кислоту.
- •4. Печень синтезирует пентозофосфаты.
- •5. Печень синтезирует гепарин. Оценка углеводного обмена в печени
- •Роль печени в липидном обмене
- •Оценка липидного обмена в печени
- •Роль печени в обмене аминокислот, белков и других азотсодержащих соединений
- •Оценка обмена азотсодержащих соединений в печени
- •Роль печени в водно-минеральном обмене
- •Роль печени в пищеварении (биосинтез и циркуляция желчных кислот).
- •Роль печени в пигментном обмене
- •Желтухи
- •1. Гемолитическая желтуха
- •2. Печеночная желтуха
- •3. Абтурационная (механическая) желтуха
- •4. Наследственные желтухи
- •Дифференциальная диагностика желтух
- •Роль печени в обезвреживании ксенобиотиков
- •Выведение ксенобиотиков
- •Синдромы поражения печени
- •Лекция № 27
- •Классификация мышечных волокон
- •Особенности обмена веществ в мышечной ткани
- •Креатинфосфатный челнок
- •Характеристика быстрых и медленных скелетных мышц
- •Миофибрилла
- •Состав миофибриллы
- •Строение миофибриллы
- •Механизмы мышечного сокращения
- •Регуляция сокращения и расслабления мышц
- •Биохимические показатели крови и мочи отражающие функциональное состояние мышечной ткани
- •Тропонин т
- •Основные нарушения обмена веществ различных видов мышечной ткани, причины, последствия, биохимическая диагностика
- •Инфаркт миокарда
- •Факторы риска инфаркта миокарда
- •Лекция № 29 Тема: Биохимия соединительной ткани
- •Клетки соединительной ткани
- •Межклеточный матрикс
- •Химический состав межклеточного матрикса
- •Функция межклеточного матрикса
- •1. Коллаген
- •Строение коллагена
- •Виды коллагена
- •Этапы синтеза и созревания коллагена
- •Коллагеновые волокна. Образование, строение, свойства, биологическое значение
- •Сетеподобные структуры. Строение, свойства биологическое значение
- •Регуляция синтеза коллагена
- •Патологии образования коллагена
- •Катаболизм коллагена
- •Диагностика скорости распада коллагена
- •Особенности обмена коллагена
- •2. Эластин
- •Строение эластина
- •Синтез эластина
- •Нарушения структуры эластина и их последствия
- •Катаболизм эластина
- •3. Гликозаминогликаны и протеогликаны
- •Строение и классы гаг
- •1. D-глюкуроновая кислота (β-1, 3)
- •2. N-ацетил-d-глюкозамин (β-1, 4)
- •1. D-глюкуроновая кислота (β-1, 3)
- •2. N-ацетил-d-галактозамин-6-сульфат (β-1, 4)
- •1. D-глюкуроновая кислота (α-1, 4)
- •2. N-ацетил-d-глюкозозамин- 6-сульфат (β-1, 4)
- •Синтез гаг
- •Регуляция синтеза гаг
- •Катаболизм гаг
- •Мукополисахаридозы
- •Строение и виды протеогликанов
- •Специализированные белки межклеточного матрикса
- •Адгезивные белки
- •Антиадгезивные белки
- •Классификация соединительной ткани
- •1. Волокнистая ткань:
- •2. Скелетные ткани:
- •3. Специальные виды соединительной ткани:
- •4. Кровь
- •Функции соединительной ткани
- •Особенности обмена веществ и энергии в соединительной ткани
- •Лекция № 28 Тема: Биохимия нервной ткани
- •Классификация нервной системы
- •Классификация нервной ткани
- •Клетки нервной ткани Нейрон
- •Глиальные клетки
- •Химический состав нервной ткани
- •Химический состав серого и белого вещества головного мозга человека
- •1. Простые белки
- •2. Сложные белки
- •Содержание (мкмоль/г) свободных аминокислот в мозге, плазме и смж человека
- •Белковый и липидный состав миелина, белого и серого вещества человека
- •Строение нервного волокна. Миелиновая оболочка
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
- •Обмен веществ и энергии в нервной ткани
- •Спиномозговая жидкость – как диагностический показатель состояния нервной ткани
- •Химический состав спинномозговой жидкости
- •Биохимические основы нервной деятельности
- •Аминокислотные медиаторы
- •Глутамат
- •Энкефалины и другие нейропептиды
- •Вещество р
- •Химические основы боли
- •5.1. Болевые рецепторы
- •5.3. Привыкание к лекарствам и лекарственная зависимость.
- •VI.Нейрохимические механизмы пластичности и памяти.
- •Лекция № 24 Тема: Биохимия почек и мочи
- •Особенности метаболизма в почках
- •Мочеобразование
- •1. Клубочковая фильтрация
- •2. Канальциевая реабсорбция
- •3. Канальциевая секреция
- •Общие свойства мочи в норме и при патологии
- •1. Объем
- •3. Плотность
- •4. Прозрачность (Мутность)
- •5. Цвет
- •Химический состав мочи в норме и патологии
Виды коллагена
Коллаген — полиморфный белок, в настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. 95% всего коллагена в организме человека составляют коллагены I, II и III типов.
Гены коллагена называются по типам коллагена и записываются арабскими цифрами, например СОL1 — ген коллагена 1 типа, COL2 — ген коллагена II типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид α-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1, и α2-цепи коллагена I типа.
Этапы синтеза и созревания коллагена
Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе:
1. На полисомах ЭПР синтезируются полипептидные препро-α-цепиколлагена. Они содержит начиная сN-конца: 1). гидрофобный «сигнальный» пептид, содержащий около 100 АК; 2). N-концевой пропептид, содержащий около 100 АК, в том числе цистеин; 3). α-цепь коллагена 4). С-концевой пропептид, содержащий около 250 АК, в том числе цистеин. КонцевыеС- и N-пропептидыформируют глобулярные домены и необходимы для правильного формирования тройной спирали.«Сигнальный» пептид, обеспечивает поступление синтезируемой на рибосоме препро-α-цепи в полость ЭПР.
2. В полости ЭПР при отщеплении сигнального пептида препро-α-цепиколлагена превращаются впро-α-цепи.
3. Поступающие в полости ЭПР про-α-цепи коллагенаподвергаются модификации.
а). Цистеины N-пропептидов образуют внутрицепочечные дисульфидные мостики, формируя наN-конце глобулярную структуру;
б). Пролины и лизины в Y-положении (гли-х-у) про-α-цепей гидроксилируются пролил-4-гидроксилазойилизил-5-гидроксилазойв 4-гидроксипролины (Hyp) и 5-гидроксилизины (Hyl). Некоторые пролины в Х-положениях гидроксилируются в 3-гидроксипролины пролил-3-гидроксилазой. Оксигеназы (гидроксилазы), содержат Fe2+, находятся на мембране ЭПР. Для реакции необходимы а-КГ, О2и витамин С:
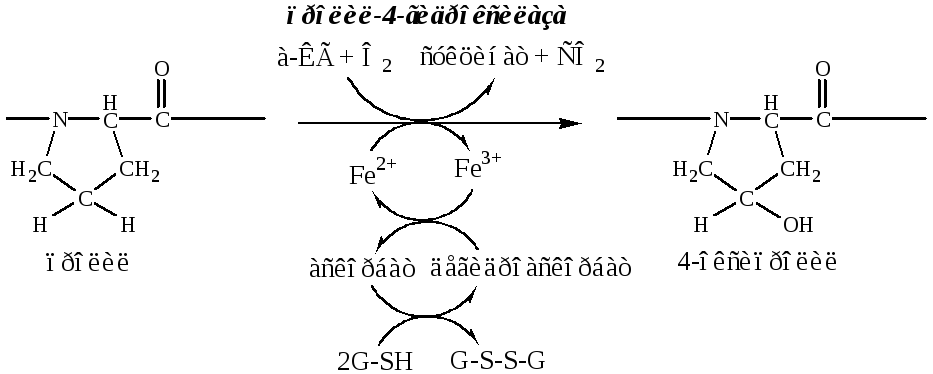
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина участвуют в образовании водородных связей.
Гидроксилирование лизина необходимо для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл.
в). Гидроксилизин про-α-цепей при участии гликозилтрансфераз гликозилируется галактозой или галактозилглюкозой. В молекуле коллагена сухожилий (тип I) количество углеводов равно 6, а в моллекуле коллагена капсулы хрусталика (тип TV) — 110. Роль этих углеводных групп неясна.
4). В просвете ЭПР после отделения от рибосом про-α-цепей, 3 из них с помощью С-концевых пропептидов соединяются между собой дисульфидными мостиками (цистеины С-пропептидов образуют внутри- и межцепочечные дисульфидные мостики) и скручиваются с образованием тройной спирали проколлагена. Тройная спираль проколлагена стабилизируется водородными связями. После этого гидроксилирование и гликозилирование про-α-цепей прекращается.
5). Из ЭПР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
6). В межклеточном матриксе от некоторых проколлагенов(I, II, III, V, XI типов)проколлагенпептидазыотщепляют концевые С- иN-пропептиды, в результате чего образуетсятропоколлагены. У проколлагенов IV, VIII, X типов концевые пропептиды не отщепляются.
Синтезированные молекулы проколлагенов и тропоколлагенов способны образовывать различные структуры. Например, тропоколлагены образуют фибриллы, а проколлагены образуют сети и решетки.
|
Структура |
Тип коллагена |
|
Фибриллы |
I, II, III – основные. V, XI - минорные |
|
Ассоциированные с фибриллами |
IX, XII, XIV, XVI, XIX |
|
Сети |
IV, VIII, X |
|
Микрофибриллы |
VI |
|
«Заякоренные» фибриллы |
VII |
|
Трансмембранные домены |
XIII, XVII |
|
Другие |
XV, XVIII |
