
- •Кафедра биохимии
- •Химический состав печени
- •Особенности энергетического обмена в печени
- •Роль печени в углеводном обмене
- •1. Основная роль печени в углеводном обмене - поддержание гомеостаза глюкозы в крови.
- •2. Печень удаляет из крови излишки фруктозы и галактозы.
- •3. Печень синтезирует глюкуроновую кислоту.
- •4. Печень синтезирует пентозофосфаты.
- •5. Печень синтезирует гепарин. Оценка углеводного обмена в печени
- •Роль печени в липидном обмене
- •Оценка липидного обмена в печени
- •Роль печени в обмене аминокислот, белков и других азотсодержащих соединений
- •Оценка обмена азотсодержащих соединений в печени
- •Роль печени в водно-минеральном обмене
- •Роль печени в пищеварении (биосинтез и циркуляция желчных кислот).
- •Роль печени в пигментном обмене
- •Желтухи
- •1. Гемолитическая желтуха
- •2. Печеночная желтуха
- •3. Абтурационная (механическая) желтуха
- •4. Наследственные желтухи
- •Дифференциальная диагностика желтух
- •Роль печени в обезвреживании ксенобиотиков
- •Выведение ксенобиотиков
- •Синдромы поражения печени
- •Лекция № 27
- •Классификация мышечных волокон
- •Особенности обмена веществ в мышечной ткани
- •Креатинфосфатный челнок
- •Характеристика быстрых и медленных скелетных мышц
- •Миофибрилла
- •Состав миофибриллы
- •Строение миофибриллы
- •Механизмы мышечного сокращения
- •Регуляция сокращения и расслабления мышц
- •Биохимические показатели крови и мочи отражающие функциональное состояние мышечной ткани
- •Тропонин т
- •Основные нарушения обмена веществ различных видов мышечной ткани, причины, последствия, биохимическая диагностика
- •Инфаркт миокарда
- •Факторы риска инфаркта миокарда
- •Лекция № 29 Тема: Биохимия соединительной ткани
- •Клетки соединительной ткани
- •Межклеточный матрикс
- •Химический состав межклеточного матрикса
- •Функция межклеточного матрикса
- •1. Коллаген
- •Строение коллагена
- •Виды коллагена
- •Этапы синтеза и созревания коллагена
- •Коллагеновые волокна. Образование, строение, свойства, биологическое значение
- •Сетеподобные структуры. Строение, свойства биологическое значение
- •Регуляция синтеза коллагена
- •Патологии образования коллагена
- •Катаболизм коллагена
- •Диагностика скорости распада коллагена
- •Особенности обмена коллагена
- •2. Эластин
- •Строение эластина
- •Синтез эластина
- •Нарушения структуры эластина и их последствия
- •Катаболизм эластина
- •3. Гликозаминогликаны и протеогликаны
- •Строение и классы гаг
- •1. D-глюкуроновая кислота (β-1, 3)
- •2. N-ацетил-d-глюкозамин (β-1, 4)
- •1. D-глюкуроновая кислота (β-1, 3)
- •2. N-ацетил-d-галактозамин-6-сульфат (β-1, 4)
- •1. D-глюкуроновая кислота (α-1, 4)
- •2. N-ацетил-d-глюкозозамин- 6-сульфат (β-1, 4)
- •Синтез гаг
- •Регуляция синтеза гаг
- •Катаболизм гаг
- •Мукополисахаридозы
- •Строение и виды протеогликанов
- •Специализированные белки межклеточного матрикса
- •Адгезивные белки
- •Антиадгезивные белки
- •Классификация соединительной ткани
- •1. Волокнистая ткань:
- •2. Скелетные ткани:
- •3. Специальные виды соединительной ткани:
- •4. Кровь
- •Функции соединительной ткани
- •Особенности обмена веществ и энергии в соединительной ткани
- •Лекция № 28 Тема: Биохимия нервной ткани
- •Классификация нервной системы
- •Классификация нервной ткани
- •Клетки нервной ткани Нейрон
- •Глиальные клетки
- •Химический состав нервной ткани
- •Химический состав серого и белого вещества головного мозга человека
- •1. Простые белки
- •2. Сложные белки
- •Содержание (мкмоль/г) свободных аминокислот в мозге, плазме и смж человека
- •Белковый и липидный состав миелина, белого и серого вещества человека
- •Строение нервного волокна. Миелиновая оболочка
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
- •Обмен веществ и энергии в нервной ткани
- •Спиномозговая жидкость – как диагностический показатель состояния нервной ткани
- •Химический состав спинномозговой жидкости
- •Биохимические основы нервной деятельности
- •Аминокислотные медиаторы
- •Глутамат
- •Энкефалины и другие нейропептиды
- •Вещество р
- •Химические основы боли
- •5.1. Болевые рецепторы
- •5.3. Привыкание к лекарствам и лекарственная зависимость.
- •VI.Нейрохимические механизмы пластичности и памяти.
- •Лекция № 24 Тема: Биохимия почек и мочи
- •Особенности метаболизма в почках
- •Мочеобразование
- •1. Клубочковая фильтрация
- •2. Канальциевая реабсорбция
- •3. Канальциевая секреция
- •Общие свойства мочи в норме и при патологии
- •1. Объем
- •3. Плотность
- •4. Прозрачность (Мутность)
- •5. Цвет
- •Химический состав мочи в норме и патологии
Регуляция сокращения и расслабления мышц
Мышечное сокращение находится под сложным регуляторным влиянием со стороны нервной системы. Мышечное сокращение опосредуется Са2+.
Кальциевые насосы постоянно перекачивают Са2+ из саркоплазмы в саркоплазматический ретикулум (у скелетных мышц) или межклеточный матрикс (миокард) (при участии Са-связывающего белка - кальсеквестрина). В результате в саркоплазме покоящейся мышцы концентрация Са2+ составляет всего 10-7-10-8моль/л.
При действии, например, ацетилхолина на ацетилхолиновые рецепторы происходит возбуждение сарколеммы.
Потенциал действия сарколеммы, через Т-систему у скелетных мышц или напрямую у миокарда и гладких мышц,достигает кальциевых каналов саркоплазматического ретикулума (рианодиновые рецепторы).
Кальциевые каналы открываются, выпуская Са2+из саркоплазматического ретикулума в саркоплазму, так что его концентрация в ней возрастает до 10-5моль/л.
Далее механизм регуляции мышечного сокращения в поперечнополосатых и гладких мышцах отличается.
Актиновая регуляция
Актиновая регуляция характерна для поперечнополосатых мышц - скелетных и сердечной.
Мышечное сокращение скелетных мышц ингибирует тропомиозиновая система на 2 стадии сокращения, так как TпIпредотвращает присоединение миозиновой головки к соответствующему связывающему сайту F-актина (TпIили изменяет конформацию F-актина или перемещает тропомиозин в то положение, в котором он блокирует сайты связывания миозиновых головок на F-актине).
Поступающий в саркоплазму Са2+ присоединяется к тропонину ТnС. Комплекс ТnС•Са2+реагирует с TnIи ТnТ, влияя на их взаимодействие с тропомиозином.
Тропомиозин при этом либо отсоединяется, либо изменяет конформацию F-актина таким образом, что появляется возможность присоединения к нему миозиновой головки тяжелой цепи. Начинается сократительный цикл.
Расслабление происходит, когда 1) содержание Са2+в саркоплазме падает ниже 10-7моль/л вследствие его поглощения саркоплазматическим ретикулумом; 2) комплекс ТnС•Са2+утрачивает свой Са2+; 3) тропонин, реагируя с тропомиозином, ингибирует дальнейшее взаимодействие миозиновой головки с F-актином и 4) миозиновые головки в присутствии АТФ отделяются от F-актина, вызывая расслабление.
Так как в сердечной мышце основным источником ионов Са2+для возбуждения служит внеклеточная жидкость, при отсутствии Са2+во внеклеточной жидкости сокращения сердечной мышцы прекращаются в течение одной минуты. Скелетная мышца в таких условиях может сокращаться часами.
Исчезновение АТФ из саркоплазмы приводит к следующим последствиям: 1) Са2+-насос саркоплазматического ретикулума перестает поддерживать низкую концентрацию Са2+в саркоплазме; при этом стимулируется взаимодействие миозиновых головок с F-актином; 2) не происходит зависимого от АТФ отделения миозиновых головок от F-актина, при этом на 5 стадии мышечного сокращения наступает трупное окоченение.
Миозиновая регуляция
Миозиновая регуляция характерна для гладких мышц.
У гладких мышц нет тропониновой системы, а легкая цепь (р-цепь) миозина подавляет его АТФ-азную активность и препятствует присоединению миозина к F-актину.
В саркоплазме гладких мышц присутствует киназа легких цепей миозина, зависимая от Са2+. При повышении в саркоплазме Са2+, он присоединяется к кальмодулину. Комплекс кальмодулин-4Са2+ активирует киназу легких цепей миозина.
Активная киназа легких цепей миозина фосфорилирует легкую цепь р, которая при этом перестает ингибировать АТФ-азную активность миозина и препятствовать взаимодействию миозина с F-актином. В результате начинается сократительный цикл.
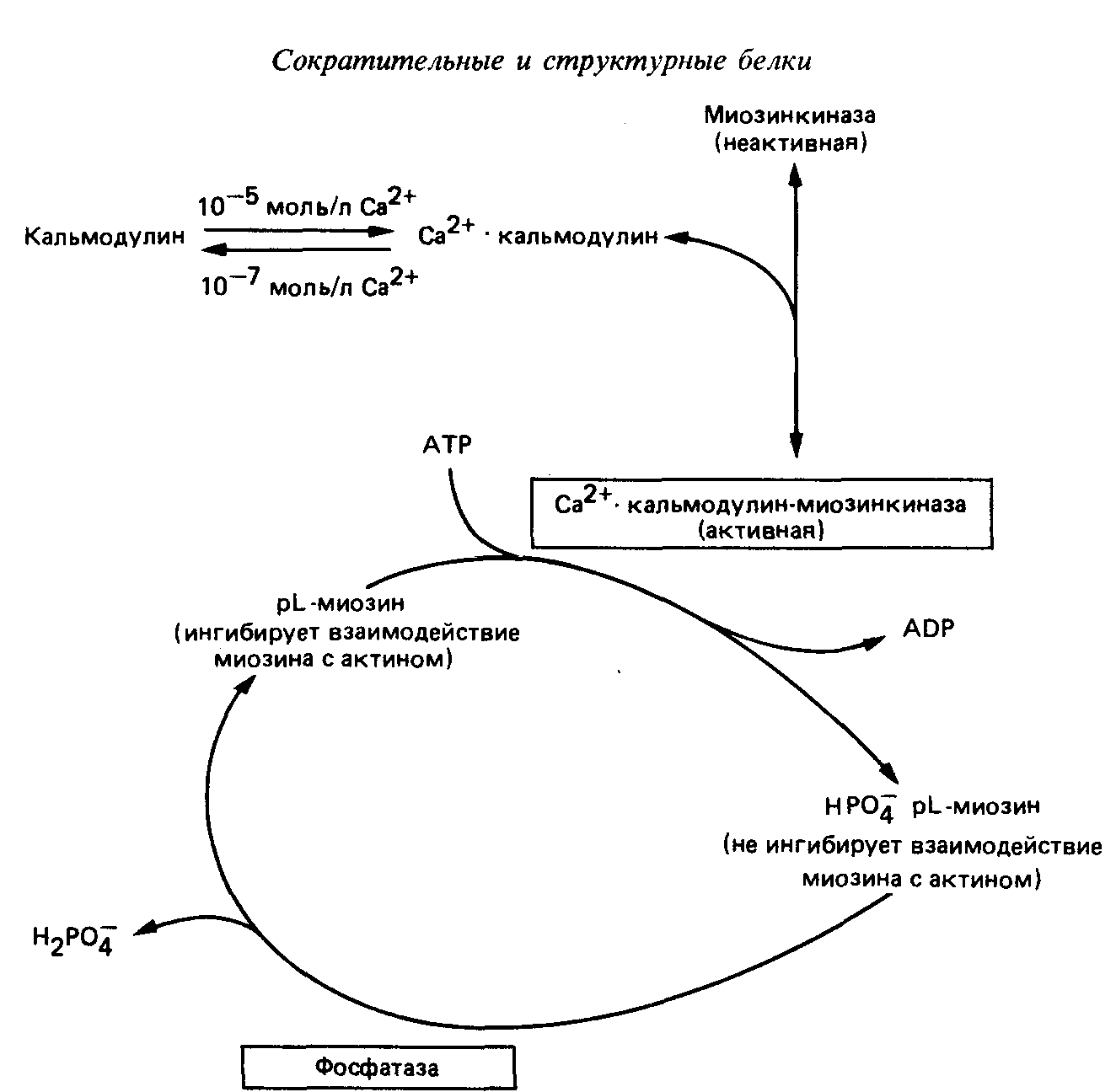
Кальциевая регуляция сокращения гладких мышц (по Р. Марри, 1993).
Расслабление гладких мышц происходит, когда 1) содержание ионов Са2+в саркоплазме падает ниже 10-7моль/л; 2) Са2+отсоединяется от кальмодулина, который в свою очередь отделяется от киназы легкой цепи миозина, вызывая ее инактивацию; 3) нового фосфорилирования легкой цепи р не происходит, и протеинфосфатаза легкой цепи, которая постоянно активна и не зависит от кальция, отщепляет от легкой цепи р ранее присоединившиеся к ней фосфаты; 4) дефосфорилированная легкая цепь р миозина ингибирует связывание миозиновых головок с F-актином и подавляет активность АТФ-азы; 5) миозиновые головки в присутствии ATФ отделяются от F-актина, а повторное их связывание произойти не может из-за присутствия в системе дефосфорилированной легкой цепи р.
