
6 модуль / 12_Obmen_aminokislot
.pdf
Лекция №12.
Тема: «Обмен аминокислот.»
План.
1.Дезаминирование аминокислот.
2.Трансдезаминирование аминокислот.
3.Биологическое значение реакций дезаминирования аминокислот.
4.Восстановительное аминирование.
5.Декарбоксилирование аминокислот.
1. Дезаминирование аминокислот – процесс отщепления аминогруппы от аминокислоты в виде аммиака с образованием α-кетокислоты. Различают прямое и непрямое дезаминирование. Прямое дезаминирование бывает 4-х видов: внутримолекулярное, гидролитическое, восстановительное и окислительное. В тканях человека и животных преобладает окислительное дезаминирование (см. наглядный материал). Образующаяся кетокислота вовлекается в клеточный обмен. Перекись водорода инактивируется каталазой или пероксидазой. Аммиак подвергается детоксикации. Суммарная оксидазная реакция:
Однако активность оксидазы L-аминокислот низкая, т.к. ее оптимум рН=10. Роль оксидаз D- аминокислот невелика, т.к. белки тканей человека и пищи содержат L-аминокислоты.
В связи с этим большинство аминокислот дезаминируются по пути непрямого окислительного дезаминирования (трансдезаминирование аминокислот).
2. Трансдезаминирование аминокислот - непрямое окислительное дезаминирование - происходит в 2 этапа:
1 этап трансаминирование α-кетоглутарата с образованием глутаминовой кислоты, 2 этап – окислительное дезаминирование глутаминовой кислоты.
1 этап трансаминирование – перенос аминогруппы от аминокислоты на α-кетоглутарат с образованием глутаминовой кислоты и соответствующей α-кетокислоты (см. наглядный материал). Процесс катализируют ферменты аминотрансферазы, кофермент - активная форма витамина В6 – пиридоксальфосфат. Клиническое значение имеют 2 аминотрансферазы: аланинаминотрансфераза (АлАТ) и аспартатаминотрансфераза (АсАТ). Определение активности АлАТ и АсАТ в сыворотке крови имеет важное значение в дифференциальной диагностике таких заболеваний, как вирусный гепатит и инфаркт миокарда.
3. Биологическое значение реакций дезаминирования аминокислот.
1.Обеспечивают синтез заменимых аминокислот из α-кетокислот. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты.
2.Обеспечивают протекание реакций непрямого дезаминирования.
2 этап – окислительное дезаминирование глутаминовой кислоты (см. наглядный материал). Фермент, катализирующий окислительное дезаминирование глутаминовой кислоты –
глутаматдегидрогеназа - является НАД-зависимым и обладает высокой активностью. НАДН, образованный в этой реакции передает протоны и электроны по полной цепи митохондриального окисления с образованием трех молекул АТФ. Глутаматдегидрогеназа является регуляторным ферментом - он ингибируется избытком АТФ, ГТФ и НАДН, и активируется избытком АДФ.
Преимущества непрямого дезаминирования перед прямым:
1.При непрямом дезаминировании не образуется токсичная Н2О2, в отличие от прямого дезаминирования, а образуется Н2О и 3 молекулы АТФ.
2.Непрямое дезаминирование обеспечивает более быстрое дезаминирование (благодаря высокой активности фермента глутаматдегидрогеназы и трансаминазы);
3.Скорость непрямого дезаминирования может регулироваться: активатор – АДФ, ингибиторы - АТФ, ГТФ и НАДН2.
4. Восстановительное аминирование. Для постоянного протекания реакций обмена АК, необходимо поддержания постоянства концентрации глутаминовой кислоты в клетке. Образование глутамата происходит в реакции восстановительного аминирования под действием фермента глутаматдегидрогеназы (см. наглядный материал). Глутаминовая кислота также необходима для реакций трансреаминирования – образование заменимых АК из соответствующих α-кетокислот.
Значение восстановительного аминирования:
1.утилизация токсичного аммиака.
2.образование глутамата, который используется в синтезе заменимых АК.
5. Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты в виде СО2. Ферменты декарбоксилазы отщепляют α-декарбоксильную группу от аминокислоты с образованием биогенных аминов гистамина, серотонина, дофамина, норадреналина, ГАМК и др. (см. наглядный материал). Кофермент декарбоксилаз пиридоксальфосфат (витамин В6).
Инактивация биогенных аминов происходит двумя путями:
1)метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина.
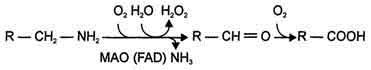
2)окислением ферментами моноаминооксидазами (МАО) с коферментом FAD - таким путем чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками:
Наглядный материал по теме: «Обмен аминокислот».
1. Дезаминирование аминокислот
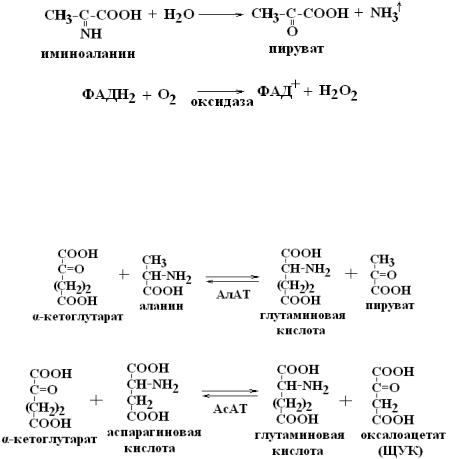
Схема прямого окислительного дезаминирования аланина:
1)
2)
3)
4)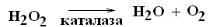
2. Трансдезаминирование аминокислот
Реакции трансаминирования:
АсАТ и АлАТ являются внутриклеточными ферментами. Поэтому в норме их активность в крови очень мала. При вирусном гепатите или при инфаркте миокарда наблюдается разрушение клеток печени или миокарда соответственно. Поэтому в крови будет наблюдаться повышение активности и АлТ, и АсТ, но неодинаковое для каждого из ферментов. (Норма: АлАТ – 0,1-0,7 мкмоль ПВ/1мл/час при 37°С; АсАТ – 0,1-0,55 мкмоль ЩУК/1мл/час при 37°С).
В клетках сердечной мышцы (миокарда) содержится гораздо больше АсАТ, чем АлАТ, а в клетках печени - наоборот: АлАТ намного больше, чем АсАТ. Поэтому при инфаркте миокарда активность АсАТ в крови будет значительно выше, чем алт, а при вирусном гепатите активность АлАТ будет выше, чем АсАТ.
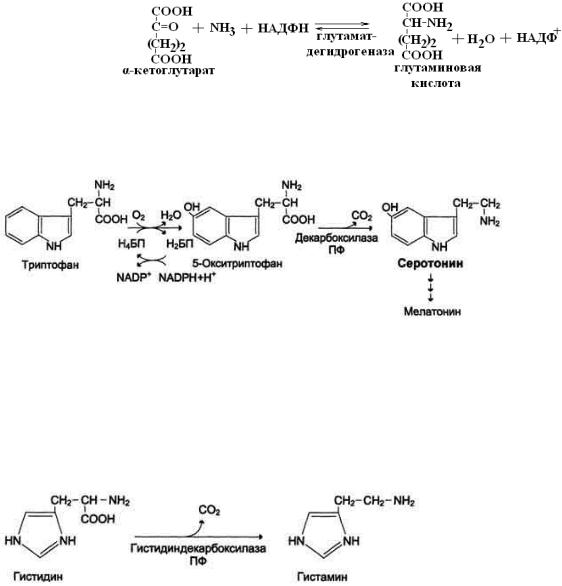
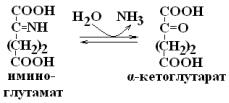
Окислительное дезаминирование глутамата:
1. 
2. 
Восстановительное аминирование:
5. Декарбоксилирование аминокислот
Образование серотонина из триптофана:
Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
Образование гистамина из гистидина:
Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани. Гистамин выполняет в организме человека следующие функции:
стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
сокращает гладкую мускулатуру лёгких, вызывает удушье;
участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани;
вызывает аллергическую реакцию;
выполняет роль нейромедиатора;
является медиатором боли.
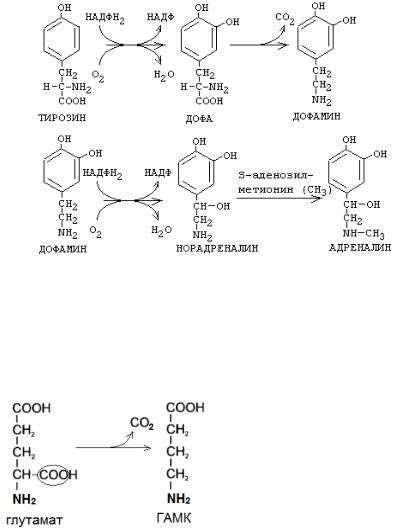
Образование катехоламинов из фенилаланина и тирозина:
Катехоламины (дофамин, норадреналин, адреналин) синтезируются в мозговом слое надпочечников (см. тему «Гормоны»).
Образование γ-аминомасляной кислоты (ГАМК) из глутамата:
В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы) приводит к образованию γ-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга.
