
3 модуль / Lekcija_14_Ruseckaja_Mikrosomal_noe_Okislenie
.pdf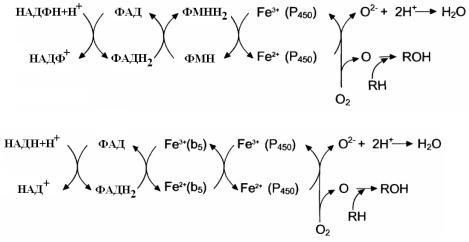
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Лекция № 14.
Тема: «Микросомальное окисление. Свободно-радикальные реакции. Перекисное окисление липидов. Антиоксиданты»
План.
1.Понятие о микросомальном окислении.
2.Строение микросомальных цепей переноса электронов.
3.Ферменты микросомального окисления.
4.Биологическое значение МС окисления
5.Регуляция микросомального окисления
6.Свободно-радикальные реакции. Перекисное окисление липидов.
7.Антиоксиданты
1. Понятие о микросомальном окислении.
При ультрацентрифугировании эндоплазматический ретикуллум (ЭПР) разрывается и превращается в систему везикул, пузырьков (микросом), обладающих ферментативной активностью.
МИКРОСОМАЛЬНОЕ ОКИСЛЕНИЕ – это регулируемый тип биологического окисления, который протекает в микросомах и не сопровождается образованием АТФ. В результате реакций микросомального окисления происходит обезвреживание токсинов в печени, синтез желчных кислот, стероидов и других биологически активных веществ, а выделяющаяся энергия рассеивается в виде тепла.
2. Строение микросомальных цепей переноса электронов.
Известны две микросомальные ц.п.э. Первая включает НАДФН-Р450-редуктазу и цитохром Р450, а вторая – НАДН-цитохром b5-редуктазу и цитозром b5.
Цитохром с может мигрировать с наружной поверхности внутренней мембраны МХ на наружную поверхность МХ мембраны. Цитохром b5 – коллектор электронов, который содержит гемовую группу (Fe-гем), окруженную белком с М=16700 Да. Белок состоит из 141 АК. Железо в цитохроме в5 способно обратимо превращаться Fe2+ ↔ Fe3+ и передавать электрон дальше на Цитохром Р450, который представляет собой белок, в состав которого входит Гем и железо. Железо способно восстанавливаться и окисляться. Железо, входящее в состав гема, может поглощать кванты света с длиной волны 450 нм, это объясняет название цитохрома Р450. От цитохрома Р450 электроны передаются на кислород. Цитохром Р450 имеет специфичный центр связывания: для кислорода – Гем и для субстрата – белковая часть. Для разных субстратов – свои белковые части. Цитохром Р450 активируется под действием амидопирина, бутадиона, фенобарбитала и др.
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
3. Ферменты микросомального окисления.
Основные реакции, протекающие в микросомах, катализируют ферменты оксигеназы и оксидазы.
Оксигеназы бывают двух видов: монооксигеназы и диоксигеназы.
Цитохром Р450-монооксигеназы – это оксидоредуктазы, которые внедряют в молекулу субстрата 1 атом кислорода, а второй – участвует в образовании молекулы воды. Источником протонов для этой реакции служит восстановленный НАДФН.
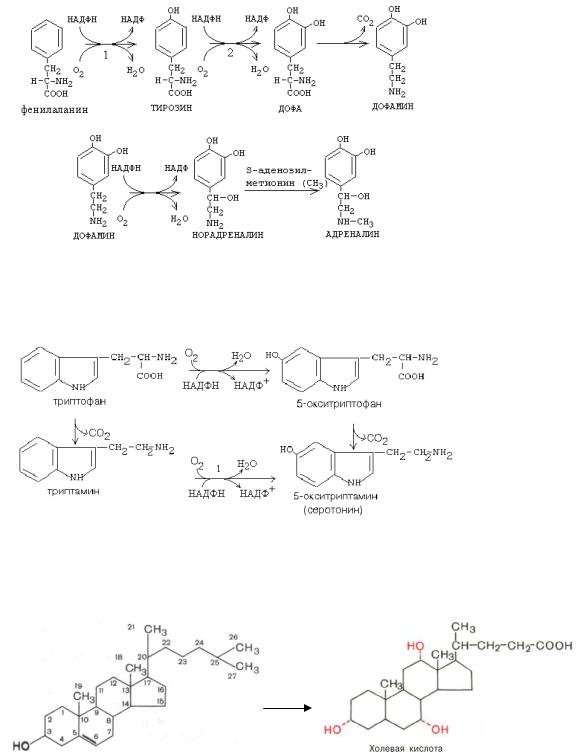
1. Фенилаланинмонооксигеназа, Тирозиноксигеназа (фенилаланингидроксилаза):
Тирозин под действием тирозинмонооксигеназы превращается в ДОФА, который является предшественником адреналина и норадреналина.
2. Триптаминминооксигеназа
3.Пролинмонооксигеназа: пролин → оксипролин
4.Лизинмонооксигеназа: лизин → оксилизин
Оксипролин и оксилизин участвуют в образовании соединительной ткани. 5. Холестерин в желчные кислоты:
холестерин
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Субстратами цитохрома Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения.
В процессе микросомального окисления с участием цитохрома Р450 происходит гидроксилирование гидрофобных субстратов, в результате чего увеличивается их растворимость и выведение из организма через почки.
Суммарная реакция монооксигеназной реакции:
RH + НАДФН +Н+ + О2 → R-OH + Н2О + НАДФ+
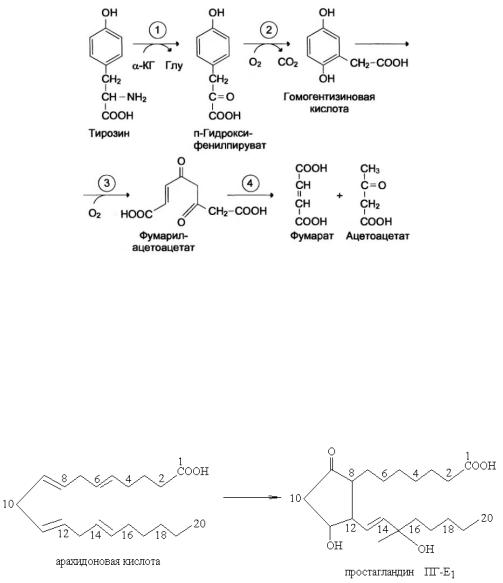
Диоксигеназы 1. Гомогентизинатоксигеназа (диоксигеназа гомогентизиновой кислоты)
Гомогентизиновая кислота + О2 → малеилацетоуксусная кислота (в моче – темного цвета).
Гомогентизиновая кислота образуется в процессе метаболизма АК тирозина. При недостатке фермента диоксигеназы гомогентизиновой кислоты гомогентизиновая кислота накапливается и окисляется в малеилацетоуксусную кислоту, которая выводится с мочой и придается моче темный цвет. Энзимопатия – алкаптонурия (черная моча).
2.β–каротин → ретинол
3.Образование Простагландинов из арахидоновой кислоты. Арахидоновая кислота окисляется в промежуточный продукт – эндоперекись под действием диоксигеназ, из которой образуются простагландин ПГ-Е2 (регулирует тонус и проницаемость сосудов, участвует в воспалительных реакциях и др.) и тромбоксан А2 (стимулирует агрегацию тромбоцитов, суживает сосуды и бронхи).
Суммарная реакция диоксигеназной реакции:
R-H + НАДФН +Н+ + О2 → R-ООН + НАДФ+ + 2 Н+ Оксидазы
Оксидазы внедряют атом кислорода в молекулу субстрата и одновременно «отнимают» 2 протона. Акцептором протонов, как правило, выступают флавины (ФМН и ФАД), которые восстанавливаясь, передают протоны на молекулярный кислород с образованием перекиси водорода.
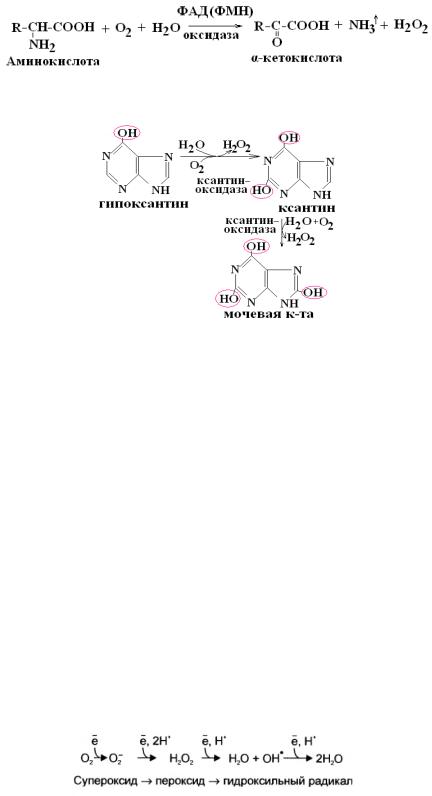
1. Оксидазы L,D-аминокислот.
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
2. Ксантиноксидаза (ФАД, Мо6+)превращает гипоксантин в ксантин и мочевую кислоту.
4.Биологическое значение МС окисления
1.Участвует в утилизации ксенобиотиков, таких как лекарства, пестициды, косметические средства и другие гидрофобные вещества. В молекулу неполярного вещества вводится 1 гидроксильная группа, вследствие чего вещество становится полярным и легче выводится из организма с мочой.
2.Термогенез: энергия, которая выделяется при переносе электронов по микросомальной ц.п.э. рассеивается в виде тепла.
3.Обмен веществ – синтез из ХЛ желчных кислот, стероидных гормонов, витамина D; обмен желчных пигментов, образование витаминов из провитаминов, простагландинов из арахидоновой кислоты, обмен АК и их производных.
5.Регуляция микросомального окисления
Внастоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. К числу этих индукторов относят барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды. Несмотря на разнообразие химического строения, все индукторы имеют ряд общих признаков; их относят к числу липофильных соединений, и они служат субстратами для цитохрома Р450.
6.Свободно-радикальные реакции. Перекисное окисление липидов.
Вреакциях митохондриального и микросомального окисления участвует молекулярный кислород
О2. В невозбуженном состоянии кислород нетоксичен. Образование токсичных форм кислорода связано с особенностями его молекулярной структуры. О2 может принять 4 электрона и 4 протона для полного восстановления до воды:
Супероксид, пероксид и гидроксильный радикал – активные окислители, способные повреждать мембранные структуры клетки за счет окисления остатков жирных кислот фосфолипидов, формирующих бислой мембран. Этот процесс называется перекисное окисление липидов (ПОЛ). ПОЛ – цепные реакции, обеспечивающие воспроизводство новых радикалов, которые инициируют дальнейшее распространение перекисного окисления. Конечными продуктами ПОЛ являются перекиси, альдегиды, кетоны, диеновые конъюгаты, малоновый диальдегид и др. Накопление этих веществ в мембране ведет к лиофилизации мембраны и ее разрушению. Большая часть активных форм кислорода образуется при переносе электронов в ц.п.э., преде всего при функционировании QH2-дегидрогеназного комплекса вследствие «утечки» электронов с QH2 на

СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
кислород. ПОЛ идет по двум механизмам: 1. Действие на насыщенные жирные кислоты (по
принципу цепной реакции):
R:H + O2-. → R. + HO2-; HO2- + H+ → H2O2
R. + O2 → RO2.
R:H + RO2. → R. + R-OOH → R-COOH
R:H + OH. → R. + H2O
R:H + HO2. → R. + H2O2
2. Присоединение супероксидного радикала (О2-.) к остаткам ненасыщенных жирных кислот по месту двойных связей. В результате жирная кислота разрушается до малонового диальдегида (МДА), при этом нарушается целостность мембраны.
Схема образования малонового диальдегида при перекисном окислении полиненасыщенных жирных кислот:
13 12 |
10 |
9 |
радикалы О2 |
|
СН3-(СН2)4-СН=СН-СН2-СН=СН-(СН2)7-СООН |
||||
13 12 |
10 9 |
радикалы О2 |
||
СН3-(СН2)4-СН-СН-СН2-СН-СН-(СН2)7-СООН |
||||
│ |
│ |
│ |
│ |
|
О –О |
О- О |
|
||
СН3-(СН2)4-С=О |
|
+ О=С-СН2-С=О + |
О=С-(СН2)7-СООН |
|
│ |
|
│ |
│ |
│ |
Н |
|
Н |
Н |
Н |
альдегид |
малоновый диальдегид |
альдегидокислота |
||
Интенсивность ПОЛ определяют по количеству образовавшегося малонового диальдегида (МДА).
Следствие повреждения мембран:
1.повреждение лизосом приводит к выходу гидролаз в ЦЗ клетки, которые переваривают все клеточные компоненты (аутолиз).
2.повреждение внутренней мембраны МХ приводит к ослаблению синтеза АТФ.
3.нарушение проницаемости клеточной мембраны для молекул метаболического топлива.
4.действие АФК на ядерную мембрану и хромосомы (происходит нарушение структуры нуклеиновых кислот) – генотоксическое действие.
Все перечисленное может вызвать гибель клетки.
Чтобы предотвратить повреждающее действие ПОЛ, в клетке существуют специальные антиоксидантные (АО) системы.
7. Антиоксиданты (АО).
1. Водорастворимые.
2. Жирорастворимые.
1. Водорастворимые АО (ферменты): 1) утилизирующие супероксидный радикал – супероксиддисмутаза (СОД) (в клетках), церулоплазмин (в сыворотке крови). Эти ферменты содержат ионы меди.
супероксиддисмутаза (СОД): O2-. + O2-. + 2 Н+ → О2 + Н2О2
Церулоплазмин O2-. + O2-. + 4 Н+ → О2 + 2 Н2О
2) утилизирующие перекись водорода – каталаза, пероксидаза, глутатионпероксидаза, аскорбатпероксидаза.
1. Каталаза (гемопротеин) находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода. Каталаза обезвреживает пероксид водорода до воды и молекулярного кислорода:
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
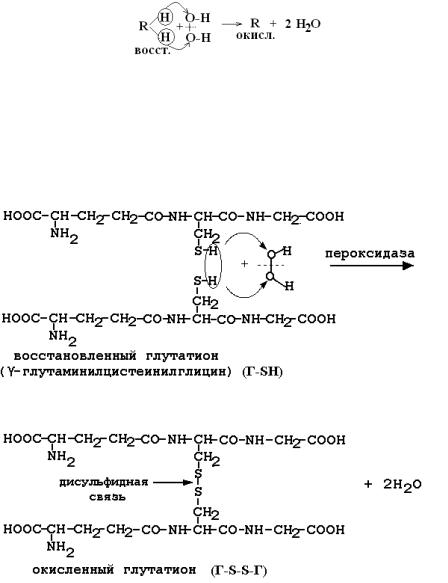
2.Пероксидаза (гемопротеин) защищает Гем гемоглобина от окисления в эритроцитах при участии восстановленного кофермента R-H2 (глутатиона, аскорбата и др.):
3.Глутатионпероксидаза (ГПО) содержит 4 молекулы Se и является важнейшим ферментом, обезвреживающим активные формы кислорода, т.к. ГПО разрушает не только пероксид водорода, но и гидропероксиды липидов. ГПО восстанавливает пероксиды с помощью восстановленного глутатиона Г-SH (γ-глу-цис-гли):
2Н2О2 + 2Г-SH → H2O + Г-S-S-Г
Регенерация глутатиона идёт с участием НАДФН2, катализирует ее фермент глутатионредуктаза. Г-S-S-Г + НАДФН2 → 2Г-SH + НАДФ
4. Аскорбатпероксидаза (содержит ионы меди и витамин С): Аскорбат восст. + Н2О2 → Аскорбат окисл. + 2 Н2О
Водорастворимые АО (неферменты): витамин С, АК цистеин, микроэлементы селен, медь, железо (участвуют в работе ферментов).
Жирорастворимые АО: 1) эстрогены и 2) токоферол (витамин Е). Механизм действия АО: они принимают неспаренные электроны от активных форм кислорода, при этом образуется радикал антиоксиданта, который малоактивен. Таким образом неферментативные компоненты антиоксидантной системы - это перехватчики неспаренных электронов.
