
3 модуль / Lekcija_13_Ruseckaja_Okislitel_noe_Fosforilirovanie
.pdf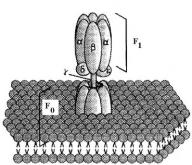
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Лекция № 13.
Тема: «Окислительное фосфорилирование. Разобщители окислительного фосфорилирования»
План.
1.Теория сопряжения П. Митчелла.
2.Показатели энергетического обмена.
3.Разобщение дыхания и фосфорилирования.
4.Патологические состояния энергетического обмена.
1. Теория сопряжения окисления и фосфорилирования П. Митчелла.
Теория сопряжения переноса электронов по цпэ (сопровождающегося «перекачиванием» протонов из матрикса в межмембранное пространство) с синтезом АТФ была предложена в 1961 году Питером Митчеллом. Эта теория называется хемиоосмотическая теория Митчелла.
Как видно из таблицы (ОВП), «звенья» цпэ расположены по мере увеличения редокс-потенциала: min у протона (-0,42 В) и max у кислорода (+0,82 В). При переходе электронов по цепи свободная энергия снижается и выделяется. Скачки потенциала 0,2 В и больше могут быть использованы для синтеза АТФ. Происходит 3 скачка потенциала в комплексах I, III и IV. Поэтому эти комплексы называют точками сопряжения окисления и фосфорилирования. Кроме того, при переносе электронов по цпэ происходит «перекачивание» протонов из матрикса МХ в межмембранное пространство, вследствие чего в матриксе концентрация протонов уменьшается, рН матрикса увеличивается и внутренняя мембрана, обращенная к матриксу, заряжается отрицательно. А мембрана, обращенная к межмембранному пространству, напротив, заряжается положительно из-за избытка протонов, при этом рН межмембранного пространства снижается. В совокупности разность (градиент) концентрации протонов и рН приводят к формированию электрохимического потенциала. Создание электрохимического потенциала на внутренней мембране МХ является источником энергии для синтеза АТФ – окислительного фосфорилирования. Однако синтез АТФ происходит, когда протоны проникают из межмембранного пространства в матрикс МХ по специальному протонному каналу, встроенному в интегральный белок-фермент АТФ-синтазу.
АТФ-синтаза состоит из нескольктх субъединиц (α, β, γ, δ, ε), которые формируют протонный канал. Можно условно разделить АТФ-синтазу на 2 части: F0 – гидрофобную, встроенную во внутреннюю мембрану МХ и F1 – гидрофильную, выступающую в матрикс МХ. F1 –часть содержит активный центр АТФсинтазы (3), к которому присоединяются исходные субстраты АДФ и Фн. Скачок потенциала (освобождение энергии) и электрохимический потенциал приводят к активации фермента и синтезу АТФ. Перенос электронов от НАДН на кислород сопровождается тремя скачками потенциала (в комплексах I, III, IV) и переносом протонов, которые используются для синтеза 3 молекул АТФ.
Электроны от субстратов первой и третьей группы проходят через три комплекса (I, III, IV), поэтому окисление этих субстратов сопровождается
синтезом 3 АТФ.
Субстраты второй группы, окисляемые флавинзависимыми ДГ передают электроны в укороченную цепь переноса электронов сразу на КоQ и далее на комплексы III и IV. В каждом комплексе происходит скачок потенциала и перенос протонов в межмембранное пространство. Поэтому окисление субстратов второй группы сопровождается синтезом 2 АТФ.
Одна пара протонов стимулирует синтез одной молекулы АТФ, а в полной ц.п.э. вырабатывается 3 пары протонов, следовательно, в полной ц.п.э. синтезируется 3 АТФ, в редуцированной – 2 АТФ, в удлиненной – 3 АТФ.
2. Показатели энергетического обмена. 1. Энергетический заряд (ЭЗ) клетки изучал Аткинсон.
ЭЗ = 1 |
( 2 [АТФ] + [АДФ] ) |
2 |
[АТФ] + [АДФ] + [АМФ] |
ЭЗ = 1, если [АТФ] = 100 %. ЭЗ = 0, если [АМФ] = 100 %.
Многие ферменты аллостерически регулируются АТФ, АДФ и АМФ.

СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
2.Коэффициент Р/О (Р/О – это число молекул Фн, перешедших в органическую форму, т.е. в АТФ, в расчете на каждый поглощенный атом кислорода). Блитцер впервые подробно изучил стехиометрические отношения между сопряженным связыванием фосфата и поглощением кислорода. При дыхании Р/О = 3 для окислительных реакций с участием НАД, при окислении сукцината в фумарат (ФАД-зависимая реакция) Р/О = 2., при окислении кетокислот Р/О = 3.
3.Дыхательный контроль – это изменение скорости дыхания МХ (скорости потребления кислорода, скорости переноса электронов, скорости фосфорилирования) при изменении концентрации АДФ. Когда ЭЗ = 1 скорость фосфорилирования равна 5-10 % от максимальной. При добавлении АДФ скорость дыхания возрастает, т.к. МХ чувствительна максимально именно к АДФ и ФН, а не к субстратам (1,2,3 группы).
После синтеза АТФ переносится в цитоплазму путем облегчённой диффузии по градиенту концентраций, поскольку основные процессы, в которых АТФ потребляется, протекают в цитоплазме.
Как происходит транспорт АТФ из митохондрий в цитоплазму? Для этого используется специфический для АТФ транспортный белок - АТФ/АДФ-транслоказа. Это интегральный белок, локализован во внутренней мембране митохондрий. Во внутренней мембране митохондрий есть белокпереносчик - АТФ/АТФ-транслоказа, который имеет 2 центра связывания: со стороны матрикса для АТФ, снаружи - для АДФ. При изменении конформации АТФ/АДФ-транслоказы АДФ переносится в матрикс, а АТФ - в межмембранное пространство, а затем - в цитоплазму, где используется.
Для образования АТФ в матрикс всё время должен поступать неорганический фосфат (Ф). Для этого во внутренней мембране митохондрий есть транспортная система, которая обеспечивает перенос фосфата в матрикс сопряженно с переносом Н+. Это белокпереносчик, который имеет 2 центра связывания: для Ф и Н+. Ф и Н+ вместе переносятся из межмембранного пространства в матрикс.
Система МтО потребляет 90% кислорода, поступающего в клетку. При этом в сутки образуется 62 килограмма АТФ. Но в клетках организма содержится всего 20-30 граммов АТФ. Поэтому молекула АТФ в сутки гидролизуется и снова синтезируется в среднем 2500 раз (средняя продолжительность жизни молекулы АТФ - полминуты).
Основные процессы, для которых используется энергия АТФ:
1.Синтез различных веществ.
2.Активный транспорт (транспорт веществ через мембрану против градиента их концентраций). 30% от общего количества расходуемого АТФ приходится на Na+,К+-АТФазу.
3.Механическое движение (мышечная работа).
3. Разобщение дыхания и фосфорилирования.
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования.
Классификация разобщителей окислительного фосфорилирования. 1. Действующие на ц.п.э.
Ротенон, амитал натрия (производное барбитуровой кислоты, снотворное) препятствует переносу электронов от ФМН на КоQ.
Антимицин А (антибиотик из штамма Streptomyces) препятствует переносу электронов от цитохрома b на Цитохром с1.
Цианиды (KCN) препятствует переносу электронов от цитохромов аа3 на кислород (прочно блокируется Гем в составе цитохромов).
2. Действующие на АТФ-синтетазный комплекс.
Олигомицин действует на δ-частицы, вызывая изменение их конформации, в результате нарушается перекрывание потока протонов внутрь МХ.
3. Действие на мембрану МХ – препятствуют образованию протонного градиента - ИОНОФОРЫ. Валиномицин вызывает выравнивание электрического потенциала (он перекачивает не протоны, а ионы
калия).
Нигерицин вызывает выравнивание концентрационного градиента (способствует транспорту через внутреннюю МХ мембрану протонов и ионов калия).
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Сочетание действия валиномицина и нигерицина вызывает полное подавление окислительного фосфорилирования
Грамицидин стимулирует образование пор в мембранах, через эти поры проходят ионы К+, Na+, H+, Ca2+ (минуя АТФ-синтетазу).
Динитрофенол, жирные кислоты, дикумарин, тироксин вызывают выравнивание электрохимического потенциала, т.е препятствуют созданию градиента конц-ции протонов.
Дикумарин ингибирует витамин К-редуктазу. Используется как антикоагулянт. Действует, препятствуя утилизации печенью витамина К при синтезе протромбина.
Тироксин (гормон щитовидной железы, амин). При гипертиреодизме (тиреотоксикоз, гиперфункция щитовидной железы) нарушается окислительное фосфорилирование, т.е. не происходит синтеза АТФ, а энергия выделяющаяся во время переноса электронов по ц.п.э. рассеивается в виде тепла. Поэтому гипертиреодизм характеризуется: 1) гипертермия, 2) тремор рук (из-за недостатка АТФ в клетках мышечной ткани).
Ненасыщенные жирные кислоты способны проводить протоны через внутреннюю МХ мембрану за счет присоединения протонов по месту двойных связей.
4. Патологические состояния энергетического обмена.
1.Гипоксия. При снижении концентрации кислорода ослабляется скорость переноса электронов по ц.п.э. Снижается синтез АТФ.
2.Гормональные нарушения. А) При сахарном диабете развивается дефицит инсулина, что приводит к снижению концентрации пирувата (и как следствие и ацетил-КоА) в клетках. Б) Гипертиреодизм – избыток тироксина вызывает разобщение окислительного фосфорилирования, в результате 1) повышается температура тела, 2) снижается синтез АТФ и 3) нарушаются процессы мышечного сокращения и расслабления, вследствие чего развивается тремор рук.
3.Гиподинамия. Избыток АТФ вызывает ингибирование по принципу обратной связи ключевых ферментов ЦТК, поэтому в матриксе МХ накапливаются субстраты ЦТК и, как следствие этого, нарушается окислительное фосфорилирование. Снижается синтез АТФ.
4.Лекарства и яды являются разобщителями окислительного фосфорилирования (динитрофенол) или ингибиторами ферментов (валиномицин, грамицидин и др.) ц.п.э. Снижается синтез АТФ.
5.Диета. При голодании гидролизуются жиры в жировых депо и освобождаются ненасыщенные жирные кислоты, которые являются разобщителями окислительного фосфорилирования. Снижается синтез АТФ.
6.Гиповитаминозы РР, В2 приводят к снижению активности НАД и ФМН-зависимых дегидрогеназ в составе ц.п.э. Снижается синтез АТФ.
7.Микроэлементы. Недостаток ионов железа и меди приведет к снижению активности цитохромов и нарушению функции железосерных белков (FeS).
