
- •12. Понятия кислоты и основания в органической химии. Влияние строения молекулы на кислотно-основные свойства органических соединений.
- •18. Алкадиены. Особенности электронного строения алкадиенов с сопряженными двойными связями. Особенности химических свойств сопряженных алкадиенов: 1,2- и 1,4-присоединение.
- •31. Химические свойства аминов и их химическая идентификация. Зависимость основности аминов от строения молекулы.
- •34. Глицериды. Классификация глицеридов. Животные жиры и растительные масла: общая характеристика физических и химических свойств.
- •36. Углеводы. Химические свойства моносахаридов. Дисахариды. Восстанавливающие и невосстанавливающие дисахариды. Полисахариды. Крахмал и целлюлоза: структура, химические свойства.
31. Химические свойства аминов и их химическая идентификация. Зависимость основности аминов от строения молекулы.
Алифатические
амины – более слабые основания ,чем
аммиак так как не поделённая электронная
пара атома азота смещается к бензольному
кольцу, вступая в сопряжения с его
пи-электронами.
Анилин ,в отличие от
алифатических аминов и аммиака, не
образуется с водой гидроксида и
взаимодействует с сильными
кислотами.
Основность ароматических
аминов зависит от характера заместителей
в бензольном кольце: электроноакцепторные
заместители ослабляют основные свойства
амииака, а электронодонорные –
увеличивают.
1. Для аминов характкрны
ярко выраженные основные
свойства.
Алифатические амины
Водные
растворы алифатических аминов проявляют
щелочную рнакцию, так как при их
взаимодействии с водой образуются
гидроксиды алкиламмония, аналогичные
гидроксиду аммония:

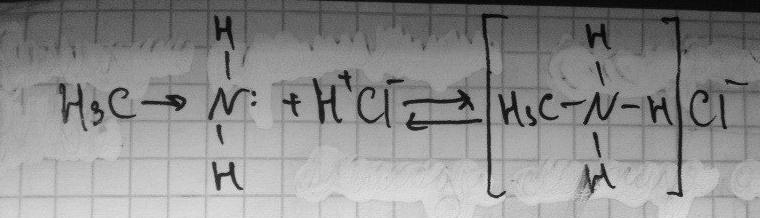 Соли аминов – твердые вещества , хорошо
растворимые в воде ; щелочи (более сильные
основания) легко вытесняют из них
амины:
Соли аминов – твердые вещества , хорошо
растворимые в воде ; щелочи (более сильные
основания) легко вытесняют из них
амины: 2.
Взаимодействие с азотистой
кислотой.
Азотистая кислота –
неустойчивое соединение, поэтому она
используется только в момент
выделения:
2.
Взаимодействие с азотистой
кислотой.
Азотистая кислота –
неустойчивое соединение, поэтому она
используется только в момент
выделения: Строение
продуктов реакции с азотистой кислотой
зависит от структуры амина , поэтому
данная реакция используется для
различения первичных, вторичных и
третичных аминов.
Алифатические и
ароматические амины сHNO2
образуют спирты : характерным признаком
реакции является выделение азота
(ДЕЗАМИНИРОВАНИЕ АМИНОВ):
Строение
продуктов реакции с азотистой кислотой
зависит от структуры амина , поэтому
данная реакция используется для
различения первичных, вторичных и
третичных аминов.
Алифатические и
ароматические амины сHNO2
образуют спирты : характерным признаком
реакции является выделение азота
(ДЕЗАМИНИРОВАНИЕ АМИНОВ):
 Дезаминирование —
процесс удаления аминогрупп от
молекулы
При
взаимодействии первичных ароматических
аминов с HNO2
при пониженной температуре (около 0
градусов) образуются соли диазония
(реакция диазотирования) , которые
используются в синтезе азокрасителей
и ряда других соединений:
Дезаминирование —
процесс удаления аминогрупп от
молекулы
При
взаимодействии первичных ароматических
аминов с HNO2
при пониженной температуре (около 0
градусов) образуются соли диазония
(реакция диазотирования) , которые
используются в синтезе азокрасителей
и ряда других соединений:
 Вторичные амины.
Вторичные амины
при взаимодействии сHNO2
превращаются в N-нитросоединения
(маслообразные вещества желтого цвета)
Вторичные амины.
Вторичные амины
при взаимодействии сHNO2
превращаются в N-нитросоединения
(маслообразные вещества желтого цвета)
 Важнейший
из алифатических аминов сNH2
приводит к образованию неустойчивых
солей и не имеет практического значения.
Третичные жирноароматические амины
при действии HNO2
вступают в реакцию электрофильного
замещения по бензольному кольцу и
превращаются в пара-нитрозопроизвольные
(С-нитропроизводные) – кристаллические
вещества зеленого цвета:
Важнейший
из алифатических аминов сNH2
приводит к образованию неустойчивых
солей и не имеет практического значения.
Третичные жирноароматические амины
при действии HNO2
вступают в реакцию электрофильного
замещения по бензольному кольцу и
превращаются в пара-нитрозопроизвольные
(С-нитропроизводные) – кристаллические
вещества зеленого цвета:
 КАЧЕСТВЕННАЯ
РЕАКЦИЯ НА АНИЛИН:
анилин взаимодействует
с бромной водой с образованием белого
осадка.
КАЧЕСТВЕННАЯ
РЕАКЦИЯ НА АНИЛИН:
анилин взаимодействует
с бромной водой с образованием белого
осадка. 3.
Восстановление нитросоединений
Наиболее
общий метод получения первичных аминов.
3.
Восстановление нитросоединений
Наиболее
общий метод получения первичных аминов.
 4.Алкинирование
Используется
для получения вторичных и третичных
аминов из первичных аминов.
4.Алкинирование
Используется
для получения вторичных и третичных
аминов из первичных аминов. 32. Аминокислоты.
-органические
бифункциональные соединения, в состав
которых входят карбоксильные группы
–COOH
и аминогруппы –NH2.
Твердые
кристаллические вещества с высокой
температурой плавления, хорошо растворимы
в воде, их водные растворы
электропроводны.
Классификация
и номенклатура аминокислот.
В
зависимости от числа функциональных
групп различают
-Моноаминомонокарбоновые
-Моноаминодикарбоновые
-Диаминомонокарбоновые
32. Аминокислоты.
-органические
бифункциональные соединения, в состав
которых входят карбоксильные группы
–COOH
и аминогруппы –NH2.
Твердые
кристаллические вещества с высокой
температурой плавления, хорошо растворимы
в воде, их водные растворы
электропроводны.
Классификация
и номенклатура аминокислот.
В
зависимости от числа функциональных
групп различают
-Моноаминомонокарбоновые
-Моноаминодикарбоновые
-Диаминомонокарбоновые

Кислотно-основные
свойства аминокислот.
Аминокислоты
– органические амфотерные соединения
они содержат в составе молекулы двух
функциональных групп противоположного
характера: аминогруппу, проявляющую
основные свойства и карбоксильную
группу , проявляющую кислотные
свойства.
Реакции
комплексообразования α-аминокарбоновых
кислот.
С
ионами тяжелых металлов альфа аминокислоты
образуют внутрикомплексные соли:
 Комплексы
меди 2 , имеющие глубокую синюю окраску,
используют для обнаружения
альфа-аминокислот.
Реакции
комплексообразования составляют основу
комплексонометрического анализа.
Комплексоны
– особая группа альфа-аминокислот; в
молекулах которых с атомом азота связано
несолько алкилкарбоксильных групп
–CH2COOH.
Комплексоны
образуют прочные, растворимые в воде
соединения с большинством катионов
кальция,магния,бария.
Одним из наиболее
эффективных комплексонов является
динатриевая соль этилендиамин
тетрауксусной кислоты (ЭДТА) – трилон
Б.
Комплексы
меди 2 , имеющие глубокую синюю окраску,
используют для обнаружения
альфа-аминокислот.
Реакции
комплексообразования составляют основу
комплексонометрического анализа.
Комплексоны
– особая группа альфа-аминокислот; в
молекулах которых с атомом азота связано
несолько алкилкарбоксильных групп
–CH2COOH.
Комплексоны
образуют прочные, растворимые в воде
соединения с большинством катионов
кальция,магния,бария.
Одним из наиболее
эффективных комплексонов является
динатриевая соль этилендиамин
тетрауксусной кислоты (ЭДТА) – трилон
Б.
Поликонденсация
аминокислот.
Межмолекулярное
взаимодействие
альфа-аминокислот
приводит к образованию пептидов:
 Аналогичным
образом происходит образование
полипептидов.
Условно принято ,что
полипептиды содержат не более 100-150
аминокислотных остатков, при большем
их количестве соединение относят к
белкам.
Нингидриновая
реакция.
Характерна
для аминогрупп в альфа-положении ,
присутствующих в природных аминокислотах
и белках.
Бесцветный нингирдрин
(2,2-дигидроксиндандион 1,3) конденсируется
в виде димера через атом азота, отщепляется
от аминогруппы альфа-аминоксилоты,
давая сине-фиолетовое окрашивание:
одновременно происходит декарбоксилирование
аминокислоты , что приводит к образованию
CO2
и
соответствующего альдегида.
Так как
интенсивность окраска пропорциональна
содержанию альфа-аминокислот в растворе
, эту реакцию используют не только для
качественного , но и для количественного
анализа.
33. Пептиды
и белки.
Белки
– биополимеры, построенные из остатков
альфа-аминокислот ,соединенных пептидными
(амидными) связями.
Пептиды — это
молекулы, состоящие из двух и более
аминокислот, соединенных между собой
пептидной связью.
Природа
пептидной связи.
Аналогичным
образом происходит образование
полипептидов.
Условно принято ,что
полипептиды содержат не более 100-150
аминокислотных остатков, при большем
их количестве соединение относят к
белкам.
Нингидриновая
реакция.
Характерна
для аминогрупп в альфа-положении ,
присутствующих в природных аминокислотах
и белках.
Бесцветный нингирдрин
(2,2-дигидроксиндандион 1,3) конденсируется
в виде димера через атом азота, отщепляется
от аминогруппы альфа-аминоксилоты,
давая сине-фиолетовое окрашивание:
одновременно происходит декарбоксилирование
аминокислоты , что приводит к образованию
CO2
и
соответствующего альдегида.
Так как
интенсивность окраска пропорциональна
содержанию альфа-аминокислот в растворе
, эту реакцию используют не только для
качественного , но и для количественного
анализа.
33. Пептиды
и белки.
Белки
– биополимеры, построенные из остатков
альфа-аминокислот ,соединенных пептидными
(амидными) связями.
Пептиды — это
молекулы, состоящие из двух и более
аминокислот, соединенных между собой
пептидной связью.
Природа
пептидной связи.
 Протеины
и протеиды.
Протеины
– простые белки ,состоящие только из
остатков аминокислот.
Протеиды –
сложные белковые образования, в состав
которых кроме белковых веществ входят
небелковые соединения.
Небелковая
часть молекул протеида называется
простетической группой; они выполняют
роль кислотно-основных,
окислительно-восстановительных;
транспортных, комплексообразующих или
каталитических циклов.
Простейшие
группы располагаются в складках, полостях
,карманах и других стерических образованиях
молекул сложных белков.
Параметрические
группы могут быть органическими
(витамины,углеводы,липиды,хлорофилл,гем)
и неогранические (ионы металлов железа,
медь,цинк и другие производные фосфорной
кислоты).
Первичная,
вторичная, третичная и четвертичная
структуры белка.
-первичная
– определенная последовательность
альфа-аминокислот остатков в полипептидной
цепи.
-вторичная – конформация
полипептидной цепи, закрепленная
множеством водородных связей между N-H
и С=О.
Наиболее распространенный
элемент вторичной структуры альфа
спираль.
На каждый виток спирали
приходится 3,6 аминокислотного остатка,
шаг спирали составляет 0,54 нм.
Иногда
водородные связи образуются между
разными полипептидными цепями, образуя
«складчатый лист» - бетта спираль.
-Третичная
– форма закрученной спирали в пространстве
,образованная главным образом за счет
дисульфидных мостиков S-S
водородных связей, гидрофобных и ионных
взаимодействий.
-Четвертичная – способ
укладки в пространстве отдельных
полипептидных цепей , обладающих
одинаковой или разной первичной
,вторичной или третичной структурой и
формирование единого в структурном и
функциональном отношениях макромолекулярного
образования.
В стабилизации четвертичной
структуры принимают участие не же типы
взаимодействий ,что и в стабилизации
третичной структуры.
Каждая отдельно
взятая полипептидная цепь-протомер
(мономер,субъединица) ,образоваавшайся
молекула –олигомер (мультимер)
Олигомерные
белки обычно построены из четного числа
протомеров от 2 до 4, реже от 6 до
8.
Гидрофобные взаимодействия – силы
притяжения между неполярными молекулами
или между неполярными участками молекулы
в водной среде.
В процессе образования
третичной структуры боковые спирали
могут как свиваться в клубок, образуя
глобулы (глобулярные белки) так и
располагаться вдоль координатных осей,
образуя нитевидные структуры – фибриллы
(фибриллярные белки)
Форма глобул
эллипсовидная; отношение ширины к длине
составляет 1:3 или 1:4
Фибриллярные белки
имеют форму волокон , их молекулярные
массы выше , чем у глобулярных
белков.
Денатурация.
Под
денатурацией понимают явления ,связанные
с последовательными изменениями
четвертичной,третичной и вторичной
структур белков под воздействием
различных агентов: при нагревании ,
действии кислот ,щелочей, солей ,уф-лучей,
ионизирующей радиации,ультразвука.
Обычно
сопровождается уменьшением их
растворимости ,увеличением вязкости
,потерей биологической активности.
Ренатурация
- процесс, обратный денатурации при
котором белки возвращают свою природную
структуру; не все белки способны
ренатурированить , у большинства белков
денатурация необратима.
Химические свойства белков.
Гидролиз
белков.
Протекает
при нагревании белков и пептидов с
растворами кислот,щелочей или при
действии ферментов; сводится к расщеплению
полипептидных связей.
Цветные
реакции белков.
Протеины
и протеиды.
Протеины
– простые белки ,состоящие только из
остатков аминокислот.
Протеиды –
сложные белковые образования, в состав
которых кроме белковых веществ входят
небелковые соединения.
Небелковая
часть молекул протеида называется
простетической группой; они выполняют
роль кислотно-основных,
окислительно-восстановительных;
транспортных, комплексообразующих или
каталитических циклов.
Простейшие
группы располагаются в складках, полостях
,карманах и других стерических образованиях
молекул сложных белков.
Параметрические
группы могут быть органическими
(витамины,углеводы,липиды,хлорофилл,гем)
и неогранические (ионы металлов железа,
медь,цинк и другие производные фосфорной
кислоты).
Первичная,
вторичная, третичная и четвертичная
структуры белка.
-первичная
– определенная последовательность
альфа-аминокислот остатков в полипептидной
цепи.
-вторичная – конформация
полипептидной цепи, закрепленная
множеством водородных связей между N-H
и С=О.
Наиболее распространенный
элемент вторичной структуры альфа
спираль.
На каждый виток спирали
приходится 3,6 аминокислотного остатка,
шаг спирали составляет 0,54 нм.
Иногда
водородные связи образуются между
разными полипептидными цепями, образуя
«складчатый лист» - бетта спираль.
-Третичная
– форма закрученной спирали в пространстве
,образованная главным образом за счет
дисульфидных мостиков S-S
водородных связей, гидрофобных и ионных
взаимодействий.
-Четвертичная – способ
укладки в пространстве отдельных
полипептидных цепей , обладающих
одинаковой или разной первичной
,вторичной или третичной структурой и
формирование единого в структурном и
функциональном отношениях макромолекулярного
образования.
В стабилизации четвертичной
структуры принимают участие не же типы
взаимодействий ,что и в стабилизации
третичной структуры.
Каждая отдельно
взятая полипептидная цепь-протомер
(мономер,субъединица) ,образоваавшайся
молекула –олигомер (мультимер)
Олигомерные
белки обычно построены из четного числа
протомеров от 2 до 4, реже от 6 до
8.
Гидрофобные взаимодействия – силы
притяжения между неполярными молекулами
или между неполярными участками молекулы
в водной среде.
В процессе образования
третичной структуры боковые спирали
могут как свиваться в клубок, образуя
глобулы (глобулярные белки) так и
располагаться вдоль координатных осей,
образуя нитевидные структуры – фибриллы
(фибриллярные белки)
Форма глобул
эллипсовидная; отношение ширины к длине
составляет 1:3 или 1:4
Фибриллярные белки
имеют форму волокон , их молекулярные
массы выше , чем у глобулярных
белков.
Денатурация.
Под
денатурацией понимают явления ,связанные
с последовательными изменениями
четвертичной,третичной и вторичной
структур белков под воздействием
различных агентов: при нагревании ,
действии кислот ,щелочей, солей ,уф-лучей,
ионизирующей радиации,ультразвука.
Обычно
сопровождается уменьшением их
растворимости ,увеличением вязкости
,потерей биологической активности.
Ренатурация
- процесс, обратный денатурации при
котором белки возвращают свою природную
структуру; не все белки способны
ренатурированить , у большинства белков
денатурация необратима.
Химические свойства белков.
Гидролиз
белков.
Протекает
при нагревании белков и пептидов с
растворами кислот,щелочей или при
действии ферментов; сводится к расщеплению
полипептидных связей.
Цветные
реакции белков.
Применяются для установления белковой природы веществ, идентификации белков и определения их аминокислотного состава.
