
1 семестр МП / РПК / Молекулярная физика / lect15_m3_of_tks_fizika1_231000.62
.docДисциплина. Физика 1. Механика. Термодинамика
Модуль 1.3. Молекулярная физика
Лекция 15. Термодинамическое описание процессов. Первое начало термодинамики
Основные понятия: термодинамическое описание макросистем, тепловое движение атомов и молекул, идеальный газ, давление и температура, внутренняя энергия, работа и количество тепла в термодинамике.
План лекции
1. Тепловое движение атомов и молекул в газах, жидкостях и твёрдых телах. Тепловое равновесие. Флуктуации. Стационарные и нестационарные процессы. Квазиравновесные процессы.
2. Идеальный газ. Основное уравнение кинетической теории газов. Уравнение состояния идеального газа Клапейрона-Менделеева. Границы его применения.
3. Внутренняя энергия как функция состояния макросистемы. Теорема о равнораспределении энергии по степеням свободы.
4. Работа и количество тепла как функции процесса, совершаемого макросистемой.
5. Тепловые двигатели. Вечный двигатель первого и второго рода.
6. Различные формулировки первого начала термодинамики.
Краткое содержание
-
Если в макросистеме наблюдается неодинаковая степень нагретости отдельных её частей, то говорят, что в ней отсутствует тепловое равновесие. В этом случае эти части системы начинают обмениваться энергией. После завершения этого процесса в системе наступает тепловое равновесие. При этом везде устанавливается одно и то же значение температуры. Доказать это утверждение на конкретном примере. Температура – количественная характеристика степени нагретости тел. В кинетической теории газов температура
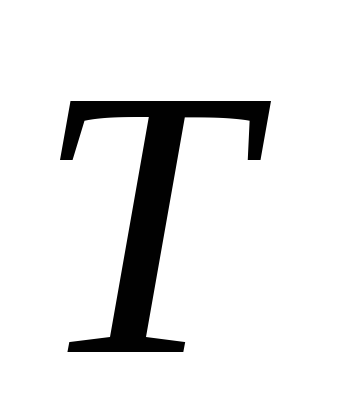 определяется соотношением
определяется соотношением
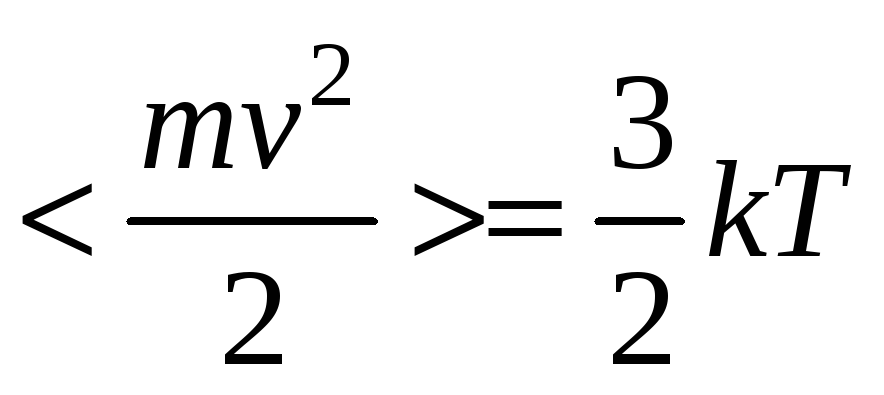 ,
где k
– постоянная Больцмана.
Здесь в левой части уравнения стоит
средняя по всем молекулам кинетическая
энергия хаотического теплового движения
молекул.
,
где k
– постоянная Больцмана.
Здесь в левой части уравнения стоит
средняя по всем молекулам кинетическая
энергия хаотического теплового движения
молекул.
Согласно теореме
о равнораспределении энергии по степеням
свободы (на
одну поступательную и вращательную
степень свободы приходится ![]() энергии, на одну колебательную степень
свободы –
энергии, на одну колебательную степень
свободы –
![]() энергии). Для одноатомного газа
энергии). Для одноатомного газа
![]() =3
(3 поступательные степени свободы).
Обычно при не слишком высоких температурах
для двухатомного газа
=3
(3 поступательные степени свободы).
Обычно при не слишком высоких температурах
для двухатомного газа
![]() =3+2=5
(3 поступательные степени свободы и 2
вращательные). Для многоатомного газа,
молекулы которого состоят из атомов,
не лежащих на одной прямой, и если
колебательные степени “заморожены”,
=3+2=5
(3 поступательные степени свободы и 2
вращательные). Для многоатомного газа,
молекулы которого состоят из атомов,
не лежащих на одной прямой, и если
колебательные степени “заморожены”,
![]() =3+3=6
(3 поступательные степени свободы и 3
вращательные).
=3+3=6
(3 поступательные степени свободы и 3
вращательные).
2. Под идеальным
газом понимают газ, в котором расстояния
между атомами или молекулами настолько
велики, что потенциальной энергией
взаимодействия их друг с другом можно
пренебречь. Опытным путем было получено,
что идеальные газы с хорошей точностью
подчиняются уравнению Клапейрона-Менделеева
![]() .
Некоторые газы, такие как воздух, азот,
кислород при обычных условиях, т.е.
комнатной температуре и атмосферном
давлении, мало отличаются от идеального
газа.
.
Некоторые газы, такие как воздух, азот,
кислород при обычных условиях, т.е.
комнатной температуре и атмосферном
давлении, мало отличаются от идеального
газа.
Давление
газа
![]() на стенку обусловлено величиной импульса,
передаваемого стенке соударяющимися
с ней молекулами. Согласно основному
уравнению
кинетической
теории газов
на стенку обусловлено величиной импульса,
передаваемого стенке соударяющимися
с ней молекулами. Согласно основному
уравнению
кинетической
теории газов
![]() ,
где
,
где
![]() -
концентрация
молекул газа. Вывести это уравнение с
помощью некоторых упрощающих предположений.
Подставляя в это уравнение приведенное
выше определение температуры, получим
-
концентрация
молекул газа. Вывести это уравнение с
помощью некоторых упрощающих предположений.
Подставляя в это уравнение приведенное
выше определение температуры, получим
![]() .
Это и есть локальная форма уравнения
состояния идеального газа. Так как
.
Это и есть локальная форма уравнения
состояния идеального газа. Так как
![]() ,
то для уравнения состояния идеального
газа получаются также следующие выражения
,
то для уравнения состояния идеального
газа получаются также следующие выражения
![]() и
и
![]() ,
где
,
где
![]() ,
,
![]() и
и
![]() - общее число частиц в газе и занимаемый
им объём. Если газ состоит из нескольких
компонент (например, в воздухе есть
азот, кислород, углекислый газ и т.д.),
то полное давление газа складывается
из парциальных давлений отдельных
компонент
- общее число частиц в газе и занимаемый
им объём. Если газ состоит из нескольких
компонент (например, в воздухе есть
азот, кислород, углекислый газ и т.д.),
то полное давление газа складывается
из парциальных давлений отдельных
компонент
![]() (закон Дальтона), а для каждого
(закон Дальтона), а для каждого
![]() справедлив закон Клапейрона-Менделеева,
как если бы других компонент в газе не
было.
справедлив закон Клапейрона-Менделеева,
как если бы других компонент в газе не
было.
3.
Внутреннюю энергию одного моля идеального
газа (под внутренней энергией понимают
полную энергию газа за вычетом кинетической
энергии газа, как целого, и потенциальной
энергии газа во внешних полях) можно
записать в виде![]()
![]() ,
где
,
где
![]() – универсальная газовая постоянная.
Таким
образом, внутренняя энергия состоит из
кинетической энергии хаотического
теплового движения молекул, из которых
состоит газ, и вращательной и колебательной
энергии атомов внутри этих молекул.
– универсальная газовая постоянная.
Таким
образом, внутренняя энергия состоит из
кинетической энергии хаотического
теплового движения молекул, из которых
состоит газ, и вращательной и колебательной
энергии атомов внутри этих молекул.
4. Изменить внутреннюю
энергию некоторой макросистемы можно
двумя способами: 1) совершая над системой
механическую работу, которую можно
рассчитывать по следующей формуле
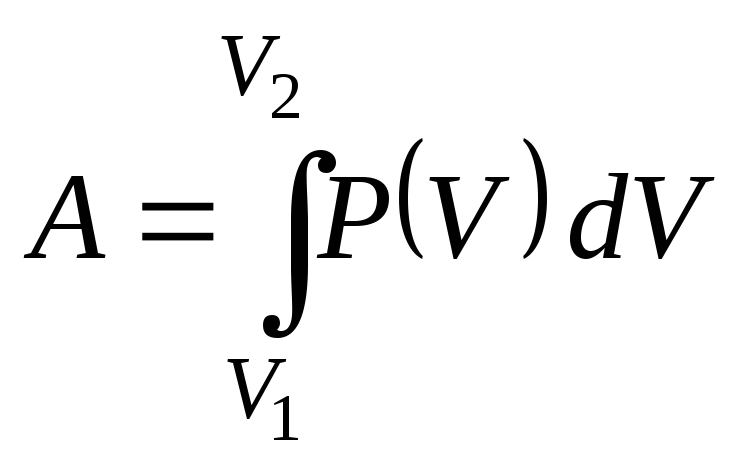 (видно, что при этом должна быть известна
зависимость давления от объема), 2)
нагревать или охлаждать систему, подводя
к ней некоторое количество тепла Q,
как например, это делают, когда нагревают
что-то на обычной плите. Практически
величина Q
может быть
рассчитана по формуле
(видно, что при этом должна быть известна
зависимость давления от объема), 2)
нагревать или охлаждать систему, подводя
к ней некоторое количество тепла Q,
как например, это делают, когда нагревают
что-то на обычной плите. Практически
величина Q
может быть
рассчитана по формуле
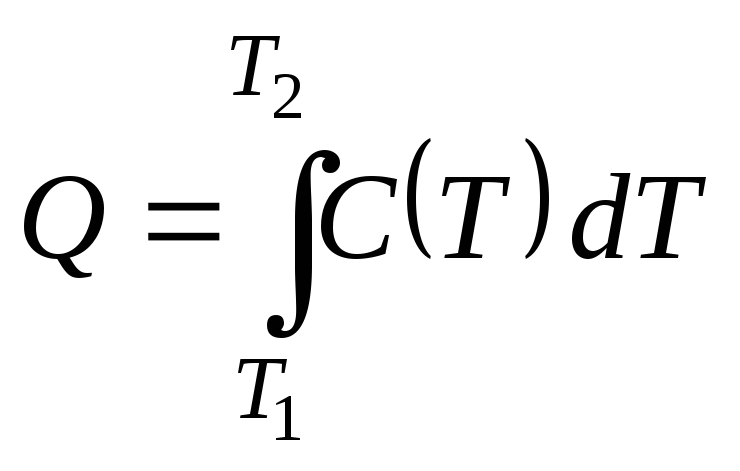 ,
если известна зависимость теплоемкости
тела от температуры
,
если известна зависимость теплоемкости
тела от температуры
![]() .
При таких процессах должен выполняться
закон сохранения энергии, который в
термодинамике называется первым началом
термодинамики. Этот закон формулируется
следующим образом: количество тепла,
сообщённое системе, идёт на увеличение
её внутренней энергии и совершение
системой работы, т.е.:
.
При таких процессах должен выполняться
закон сохранения энергии, который в
термодинамике называется первым началом
термодинамики. Этот закон формулируется
следующим образом: количество тепла,
сообщённое системе, идёт на увеличение
её внутренней энергии и совершение
системой работы, т.е.:
![]() .
Здесь
.
Здесь
![]() - элементарная работа, совершаемая при
элементарном изменении объёма газа,
- элементарная работа, совершаемая при
элементарном изменении объёма газа,
![]() - элементарное количество тепла. Наконец,
элементарное количество внутренней
энергии может быть представлено как:
- элементарное количество тепла. Наконец,
элементарное количество внутренней
энергии может быть представлено как:
![]() ,
где
,
где
![]() – число молей вещества,
– число молей вещества,
![]() – молярная теплоёмкость при постоянном
объёме. С учётом записанного выше
выражения для внутренней энергии
идеального газа для величины
– молярная теплоёмкость при постоянном
объёме. С учётом записанного выше
выражения для внутренней энергии
идеального газа для величины
![]() такого газа имеет место следующая
формула
такого газа имеет место следующая
формула
![]() =
=
![]() .
Подчеркнём, что в отличие от количества
тепла Q
и работы А,
зависящих от процесса перехода системы
из одного состояния в другое, внутренняя
энергия является функцией состояния.
То есть,
.
Подчеркнём, что в отличие от количества
тепла Q
и работы А,
зависящих от процесса перехода системы
из одного состояния в другое, внутренняя
энергия является функцией состояния.
То есть,
![]() и
и
![]() – это бесконечно малые величины, не
являющиеся полными дифференциалами, а
– это бесконечно малые величины, не
являющиеся полными дифференциалами, а
![]() – полный дифференциал.
– полный дифференциал.
5. Исторически термодинамика возникла при попытках объяснить теоретически работу тепловых двигателей. Долгое время имели место попытки создания вечного двигателя. Говоря современным языком, вечный двигатель первого рода – это такой, в котором количество затраченной энергии больше, чем количество полученной при работе двигателя. Термодинамическое описание основывается на постулировании небольшого числа начал термодинамики, из которых затем выводится большое количество следствий, позволяющих решать различные практические задачи. После многих безуспешных попыток создать вечный двигатель первого рода, было сформулировано первое начало термодинамики, согласно которому в любом тепловом процессе не должен нарушаться закон сохранения энергии. Статистическая физика в значительной степени позволяет обосновать начала термодинамики.
6.
Одна из формулировок первого начала
уже была дана выше. Можно дать и такую
формулировку. Внутреннюю энергию
макросистемы можно изменить, совершая
над системой механическую работу (![]() - элементарная работа, совершаемая
внешними телами над системой), сообщая
или отнимая у системы некоторое количество
тепла (
- элементарная работа, совершаемая
внешними телами над системой), сообщая
или отнимая у системы некоторое количество
тепла (![]() - элементарное количество тепла,
полученное системой) или делая и то и
другое. Тогда
- элементарное количество тепла,
полученное системой) или делая и то и
другое. Тогда
![]() .
Таким образом, приращение внутренней
энергии макросистемы равно сумме
количества тепла, полученного системой,
и работы, совершённой системой над
окружающими телами.
.
Таким образом, приращение внутренней
энергии макросистемы равно сумме
количества тепла, полученного системой,
и работы, совершённой системой над
окружающими телами.
Лекционные демонстрации
-
Закон Менделеева – Клапейрона
-
Закон Бойля-Мариотта.
-
Закон Шарля.
Учебно-методические материалы
Основная литература
1. Савельев И. В. Курс общей физики, кн. 3. – М.: ООО «Издательство Астрель», ООО «Издательство АСТ», 2007, §§1.3-1.9
2. Иродов И. Е. Физика макросистем. Основные законы: Учеб. пособие для вузов. – М.: Бином. Лаборатория знаний, 2006, §§1.1-1.3, 1.5-1.6.
3. Сивухин Д. В. Общий курс физики. т. 2. М.: ФИЗМАТЛИТ, 2009, §§ 7-19.
