
1 семестр МП / РПК / Молекулярная физика / lect14_m3_of_tks_fizika1_231000.62
.docДисциплина. Физика 1. Механика. Термодинамика
Модуль 1.3. Молекулярная физика
Лекция 14. Молекулярно-кинетическая теория строения вещества. Статистические распределения молекул газа по скоростям и энергиям
Основные понятия: микросистемы и макросистемы, молекулярно-кинетическое и термодинамическое описание макросистем, вероятность, средние значения, средние значения случайных величин, функции распределения, плотность вероятности, условие нормировки, флуктуации, распределение частиц в поле тяжести, наиболее вероятная скорость, средняя скорость, среднеквадратичная скорость, распределение молекул по скоростям, распределение по энергиям.
План лекции
1. Особенности механического и молекулярно-кинетического и термодинамического описаний.
2. Атомы и молекулы. Их размеры. Молярная масса. Число Авогадро.
3. Микро- и макропараметры. Давление и температура как величины, усреднённые по огромному числу микрообъектов.
-
Основные сведения из теории вероятностей.
-
Распределение Больцмана
5.1. Барометрическая формула
-
Распределение Максвелла
-
. Распределение молекул по модулю скорости
-
Характерные скорости
Краткое содержание
1. Если в механике при описании объектов можно задавать скорости и координаты точек или небольшое количество параметров, описывающих положение и динамику твёрдого тела, то при описании макросистем надо использовать макропараметры (температуру, давление и т.д.), которые получаются усреднением по огромному числу молекул и атомов. Термодинамическое описание основывается на постулировании небольшого числа начал термодинамики, из которых затем выводится большое количество следствий, позволяющих решать различные практические задачи. Статистическая физика в значительной степени позволяет обосновать начала термодинамики.
2.
Все тела состоят из огромного количества
атомов и молекул, которые находятся в
состоянии беспрерывного хаотического
движения. Количество вещества в
молекулярной физике измеряют в молях.
Моль
вещества содержит
определённое число молекул, равное
числу
Авогадро (![]() ).
Масса одной молекулы равна
).
Масса одной молекулы равна
![]() ,
где
,
где
![]() - масса моля данного вещества. Размеры
одной молекулы обычно лежат в диапазоне
0,2-0,4 нм.
- масса моля данного вещества. Размеры
одной молекулы обычно лежат в диапазоне
0,2-0,4 нм.
3. Под идеальным газом понимают газ, в котором расстояния между атомами или молекулами настолько велики, что потенциальной энергией взаимодействия их друг с другом можно пренебречь.
Вообще,
состояние некоторой макросистемы
определяется значениями трех (а иногда
и более) макроскопических параметров:
давления
![]() объема
объема
![]() и температуры
и температуры
![]() В состоянии термодинамического равновесия
эти параметры находятся в функциональной
зависимости, которую можно выразить
уравнением
В состоянии термодинамического равновесия
эти параметры находятся в функциональной
зависимости, которую можно выразить
уравнением
![]() ,
которое называют
уравнением
состояния.
Для идеальных и реальных газов вид этой
зависимости различен.
,
которое называют
уравнением
состояния.
Для идеальных и реальных газов вид этой
зависимости различен.
Небольшие отклонения от среднего значения некоторого макропараметра, наблюдающиеся в небольшом объёме, называются флуктуациями.
Если на границах системы поддерживать фиксированные значения температуры, то через какое-то время в системе установится стационарное (не зависящее от времени) распределение температуры. При этом в системе происходит стационарный процесс теплопередачи от более нагретых участков системы к менее нагретым. Если температура зависит как от координат, так и от времени, то в системе будет происходить нестационарный процесс теплопередачи. Если этот процесс настолько медленный, что в небольшом объёме данной системы около каждой точки будет успевать устанавливаться тепловое равновесие, то такой процесс называется квазиравновесным. Процессы, при которых не меняется некоторый параметр, называются изопроцессами. Бывают изотермические, изобарические, изохорические процессы.
4. Теория вероятности изучает явления, которые имеют случайный характер. Случайным называется событие, которое нельзя предсказать с определенностью. Этим оно отличается от достоверного события. Пример случайного события — приход определенной молекулы в заданную точку в результате беспорядочного теплового движения в газе частиц. Пример достоверного события — приход той же молекулы в заданную точку в результате движения по траектории с заданной скоростью без столкновений. В первом случае появления меченой молекулы в заданной точке можно ожидать с некоторой вероятностью.
Вероятностью P(A) некоторого события A называется частота появления данного события A в общем числе событий A. Ясно, что вероятность есть положительная величина. Из ее определения следует, что 0 <= P <= 1. Если событие достоверно, то P = 1. Если событие не может произойти вообще, то P = 0.
Вероятность сложного события, состоящего из двух независимых событий, равна произведению вероятностей каждого из независимых событий.
Случайное событие, в частности, может состоять в том, что какая-либо физическая величина имеет определенное, но произвольное значение. Такие величины называются случайными. Случайные величины могут принимать как дискретные, так и непрерывные значения.
Объектом нашего изучения продолжают оставаться макросистемы.
Очень большое количество частиц в системе привело к разработке нового метода изучения макросистем- молекулярной (статистической) физики.
Один из разделов статистической физики, посвященный описанию равновесных состояний и, соответственно, равновесных процессов описывающих движение микрочастиц основывается на определении статистических закономерностей случайного (теплового) движения отдельных микрочастиц.
В качестве основной функции, применяемой при статистическом методе описания, выступает функция распределения, которая определяет статистические характеристики рассматриваемой системы. Знание её изменения с течением времени позволяет описывать поведение системы со временем. Функция распределения дает возможность рассчитывать все наблюдаемые термодинамические параметры системы (температура, давление и т.д.) определяются как средние значения соответствующих функций.
системы.
5.
Рассмотрим статистическое описание,
применимое для случая, когда измеренный
параметр x
может иметь любые значения в некотором
интервале
![]() .
Причем, указанный интервал может быть
и не ограниченным какими либо конечными
значениями a
и b.
.
Причем, указанный интервал может быть
и не ограниченным какими либо конечными
значениями a
и b.
Пусть
в результате измерений было установлено,
что величина
![]() с
вероятностью
с
вероятностью
![]() попадает в интервал значений от
попадает в интервал значений от
![]() до
до
![]() .
Тогда можно ввести функцию
.
Тогда можно ввести функцию![]() ,
характеризующую плотность распределения
вероятностей:
,
характеризующую плотность распределения
вероятностей:
![]()
Эта функция называется функцией плотности вероятности.
Свойства функции плотности вероятности (на примере распределения частиц по скоростям в интервале скоростей):
-
Доля частиц в конечном интервале
 :
:
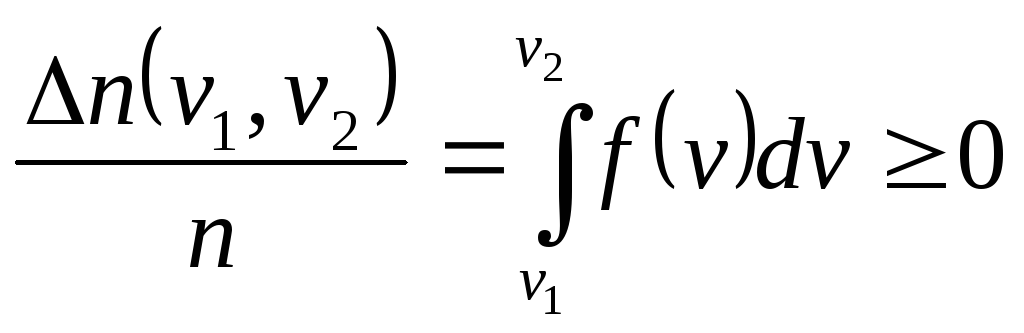
-
Нормированность:
![]()
Функция
плотности
![]() позволяет определить среднее значение
любой функции
позволяет определить среднее значение
любой функции
![]() :
:
|
|
5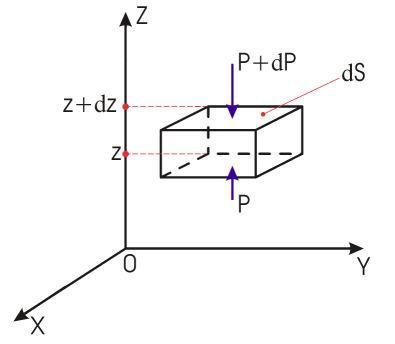 .1.
Рассмотрим случай нахождения идеального
газа во внешнем гравитационном поле.
При нахождении концентрации молекул
газа
.1.
Рассмотрим случай нахождения идеального
газа во внешнем гравитационном поле.
При нахождении концентрации молекул
газа
![]() во
внешнем поле будем исходить из
предположения, что любой бесконечно
малый объем газа находится в состоянии
механического равновесия, а температура
газа T
во
всех точках одинакова.
во
внешнем поле будем исходить из
предположения, что любой бесконечно
малый объем газа находится в состоянии
механического равновесия, а температура
газа T
во
всех точках одинакова.
На
рис. схематически изображен бесконечно
малый выделенный объем газа
![]() ,
находящийся в равновесии. Условие
механического равновесия для выделенного
объема газа запишется в виде:
,
находящийся в равновесии. Условие
механического равновесия для выделенного
объема газа запишется в виде:
![]()
или
![]()
Дальнейшие пребразования позволяют получить:
![]()
Интегрирование полученного уравнения при определенных граничных условиях позволяет определить зависимость давления от высоты:
|
|
где
![]() -
давление газа на высоте, принятой за
начало отсчета.
-
давление газа на высоте, принятой за
начало отсчета.
С учетом формулы
|
|
получаем:
|
|
Эта зависимость носит название барометической формулы.
Используя известную зависимость P от n можно получить зависимость концентрации молекул идеального газа от координаты z:
|
|
Все выражения были получены в предположении, что газ находится в однородном гравитационном поле и, следовательно, потенциальную энергию его молекулы в зависимости от координаты z можно выразить простой формулой:
|
|
Анализ полученных выражений позволяет сделать вывод, что для однородного гравитационного поля распределение концентрации газа зависит от потенциальной энергии его молекул в этом поле.
Это распределение позволяет рассчитывать концентрацию газа, находящегося в равновесном состоянии во внешнем силовом поле. Причем это поле не должно быть обязательно гравитационным, а может иметь любое происхождение, в частности, быть электростатическим или полем сил инерции.
6. Аналогично можно получить распределение частиц в газе по скоростям. Случайные изменения скоростей молекул в результате столкновений можно рассматривать как случайное блуждание частиц, но не в реальном координатном пространстве, а в пространстве скоростей, осями в котором являются скорости частиц vx, vу, vz (рис.).
 Запишем
формулу для числа частиц, имеющих
значение компоненты скорости vz
в интервале
между значениями vz
и vz
+ dz
в виде:
Запишем
формулу для числа частиц, имеющих
значение компоненты скорости vz
в интервале
между значениями vz
и vz
+ dz
в виде:
![]() ,
,
где теперь вместо потенциальной энергии частицы находится та часть ее кинетической анергии, которое связана с движением вдоль оси Z, а величина A — некоторая размерная константа.
Поскольку движения в направлениях x, y и z равноправны, распределения частиц со скоростями в этих направлениях описываются такими же выражениями. Тот факт, что частица обладает каким-либо значением скорости v, представляет собой случайное событие, состоящее из трех независимых случайных событий — определенных значений компонент скоростей vх, vу, vz. Поэтому число частиц, обладающих заданным значением полной скорости v, определяется произведением вероятностей указанных случайных событий
![]() .
.
Окончательно распределение частиц в газе по скоростям имеет вид:
![]() . (1)
. (1)
Это выражение называется распределением Максвелла.
6.1. Можно получить выражение для числа частиц в газе, обладающих заданной величиной скорости.
 Состояния
с различными проекциями скоростей vх,
vу,
vz,
но с одинаковой величиной v
будут
заполнять шаровой слой, объем которого
равен 4πv2dv.
Заменив, таким образом, в формуле (1)
элемент объема на элемент шарового
слоя, найдем распределение Максвелла
по абсолютным величинам скоростей:
Состояния
с различными проекциями скоростей vх,
vу,
vz,
но с одинаковой величиной v
будут
заполнять шаровой слой, объем которого
равен 4πv2dv.
Заменив, таким образом, в формуле (1)
элемент объема на элемент шарового
слоя, найдем распределение Максвелла
по абсолютным величинам скоростей:
![]()
![]() . (2)
. (2)
Функция
![]() ,
определяемая выражением (2), представляет
собой плотность вероятности того, что
частицы имеют заданное значение
абсолютной величины скорости. Приравнивая
нулю производную от нее по v,
можно найти положение максимума этой
функции. Графически функция представлена
на рис.
,
определяемая выражением (2), представляет
собой плотность вероятности того, что
частицы имеют заданное значение
абсолютной величины скорости. Приравнивая
нулю производную от нее по v,
можно найти положение максимума этой
функции. Графически функция представлена
на рис.
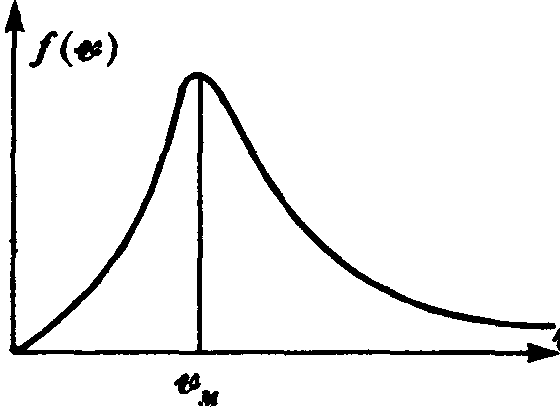 6.2.
Видно, что наиболее вероятная величина
скорости в газе — скорость vm.
6.2.
Видно, что наиболее вероятная величина
скорости в газе — скорость vm.
![]() .
.
Видно также, что вероятность частиц иметь скорость, равную нулю, или, наоборот, иметь бесконечную скорость равна нулю. Следовательно, наибольшее число частиц имеет близкие значения скоростей вблизи скорости vm. Функция распределения Максвелла позволяет вычислить все представляющие физический интерес средние характеристики газа, например, величину средней скорости
![]() ,
,
и величину среднеквадратичной скорости:
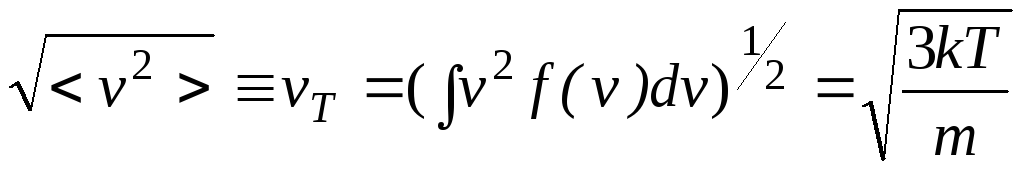 .
.
Все эти средние скорости близки друг другу.
Лекционные демонстрации
-
Атмосферное давление.
-
Воздушное огниво.
Учебно-методические материалы
Основная литература
1. Савельев И. В. Курс общей физики, кн. 3. – М.: ООО «Издательство Астрель», ООО «Издательство АСТ», 2007, §§1.1-1.3.
2. Иродов И. Е. Физика макросистем. Основные законы: Учеб. пособие для вузов. – М.: Бином. Лаборатория знаний, 2006, §§2.1-2.4.
3. Сивухин Д. В. Общий курс физики. т. 2. М.: ФИЗМАТЛИТ, 2009, §§ 7-19.
