
- •Кафедра биохимии
- •Методическая разработка к практическому занятию № 27 (для преподавателей)
- •Форма и строение эритроцитов
- •Цитоплазма
- •Плазмолемма и примембранный цитоскелет
- •Ретикулоциты
- •Вопрос 2. Особенности обмена зрелого эритроцита.
- •Энергетический обмен
- •Белковый и липидный обмен
- •Особенности углеводного обмена в эритроците, 2,3 – дфг – шунт
- •Вопрос 3. Обезвреживание метгемоглобина. Значение глюкозо-6-фосфатдегидрогеназы (гл-6-ФосфатДг).
- •Вопрос 4. Изменения обмена, происходящие при старении и консервировании эритроцитов. Изменение обмена в эритроцитах при старении
- •Изменение обмена при консервировании
- •Вопрос 5. Строение гемоглобина и виды гемоглобинов. Гемоглобинозы.
- •Виды гемоглобинов
- •Гемоглобина
- •Вопрос 6. Строение гема, производные гемоглобина
- •Производные гемоглобина
- •Вопрос 8. Эффект Бора, аллостерическая регуляция насыщения гемоглобина кислородом
- •Эффект Бора
- •Аллостерическая регуляция сродства гемоглобина к кислороду 2,3-дфг
- •Вопрос 9. Реакции синтеза гема, регуляция синтеза.
- •Регуляция биосинтеза гема
- •Вопрос 10. Нарушения синтеза гема. Порфирии
- •Способы классификации порфирий
- •Вопрос 11. Содержание гемоглобина в крови здорового человека.
- •Классификация и механизмы развития гипоксических состояний
- •Вопрос 12. Виды лейкоцитов, их функции, виды обмена в лейкоцитах
- •Основные виды лейкоцитов, их строение и функции
- •Обмен веществ в лейкоцитах
- •Вопрос 13. Реакции образования активных форм кислорода (афк); значение этих реакций
- •Вопрос 14. Эндогенная интоксикация
- •Основная
- •Дополнительная
Аллостерическая регуляция сродства гемоглобина к кислороду 2,3-дфг
2,3-ДФГ снижает сродство гемоглобина к кислороду и, таким образом, повышает отдачу кислорода тканям. Если кровь израсходовала весь свой запас ДФГ, гемоглобин остается фактически насыщенным кислородом. При акклиматизации в условиях высокогорья содержание ДФГ в эритроцитах резко увеличивается. ДФГ является аллотерическим лигандом, так как связывается с гемоглобином в другом по сравнению с О2 участком. ДФГ встраивается в полость тетрамерной молекулы гемоглобина, полость образована остатками всех 4 протомеров.
В Т – форме (дезоксигенерированной) молекулы Hb имеются дополнительные связи, и поэтому размер центральной полости больше, чем в R – форме (дезоксигемоглобине). Поэтому ДФГ взаимодействует только с Т – формой стабилизируя её, путем образования связи между атомами кислорода ДФГ и тремя положительно заряженными группами в каждой из - цепей.
В легких при высоком парциальном давлении кислород взаимодействует с Hb, изменяется конформация белка, уменьшается центральная полость и ДФГ вытесняется из гемоглобина.
Вопрос 9. Реакции синтеза гема, регуляция синтеза.
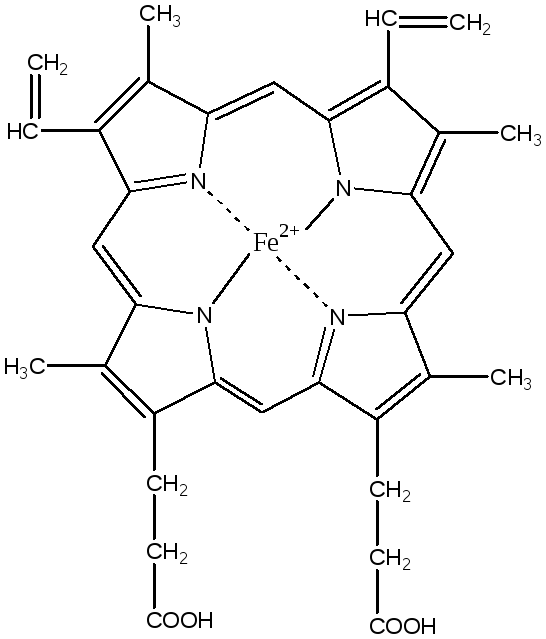
Гем является простетической группой гемоглобина, миоглобина, цитохромов, каталазы и пероксифазы.
Гем синтезируется во всех клетках, но наиболее активно синтез идет в печени и костном мозге, так как в этих тканях идет синтез гемоглобина и цитохромов. Гем в эритроцитах начинает синтезироваться уже на стадии полихроматофильных эритробластов. Клетки делится, постепенно накапливают гемоглобин, их цитоплазма становится оксифильной – это ацирофильные эритробласты. Синтез гема заканчивается только в зрелых эритроцитах (нет митохондрий).
Для синтеза гема необходимо два исходных реагента: глицин и сукцинил – КоА. Эти вещества необходимы для синтеза - аминолевулиновой кислоты ( - ALA). Реакция катализируется пиридоксальфосфатзависимым ферментам ALA – синтазой, которая локализуется в митохондриях.
Далее процесс перемещается в цитоплазму, так как следующий фермент синтеза гема – ALA – дегидротаза, локализован именно там. ALA – дегидротаза – Zn- содержащий фермент. Этот фермент катализирует реакцию конденсации двух молекул ALA с образованием пиррола – порфобилинагена (ПБГ).
Остальные стадии биосинтеза гема включают в себя соединение 4 молекул ПБГ в единую структуру, модификацию групп боковых цепей и образование хелатных комплексов с двух валентным атомом железа. Промежуточными тетрапехронами на стадиях между образованием ПБГ и формированием гема являются бесцветные (уро-) и копропорфириногемы. (содержащий метеновые мостики (-СН=)). Опишем подробнее стадии биосинтеза гема из ПБГ.
Уропорфириноген III превращается в копропорфириноген III путем декарбоксилирования всех ацетатных групп (А), вместо которых образуются метильные группы (М). Реакцию катализирует уропорфириноген – декарбоксилаза. Далее копропорфириноген III (КПГ) поступает в митохондрии, где превращается в протопорфириноген III (ППГ), а затем в протопорфирин III. Митоходриальный фермент копропорфириногеноксидаза катализирует декарбоксилирование и окисление двух пропионовых боковых цепей с образованием винильной группы во 2,4 положении (-СН=СН2). Так образуется ППГ. Затем он окисляется протопорфириногенооксидазой с образованием протопорфирина IX.
Завершающей стадией синтеза гема является включение в протопорфирин двух валентного железа. Эта реакция катализируется митохондриальным ферментом гем – синтезой или ферро – хелатазой.
Важным является и тот факт, что в процессе синтеза гема возрастает гидрофобность тетрапиррольных соединений в результате декарбоксилирования замещающих групп. Так, более полярный уропорфириноген экскретируется преимущественно с мочой, а более гидрофобные копропорфириноген и ППГ оказываются преимущественно в желчи и удаляются в составе фекалий.
