
- •I. Основные понятия и законы химии
- •II. Строение атома
- •1. Ядерная модель атома. Строение атома. Состав атомных ядер. Массовое число. Атомный номер. Нуклид. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д.И.Менделеева
- •IV. Химическая связь и строение вещества
- •Поскольку в этой молекуле оба атома кислорода равноценны (и, следовательно, равноценны обе связи s-o), свойства молекулы лучше передает графическая формула с делокализацией π-связью:
- •5. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции (овр)
- •Электродвижущая сила (эдс) гальванического элемента
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •4.Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
Галогены и их соединения
1. Общая характеристика галогенов. Строение атомов и степени окисления галогенов в соединениях. Характер изменения атомных радиусов, энергий ионизации, сродства к электрону и электроотрицательности в ряду F - At. Характер химических связей галогенов с металлами и неметаллами. Устойчивость высших валентных состояний галогенов. Особенности фтора.
1. с. 367-371; 2. с. 338-347; 3. с. 415-416; 4. с. 270-271; 7. с. 340-345.
2. Строение молекул и физические свойства простых веществ галогенов. Характер химической связи в молекулах галогенов. Физические свойства галогенов: агрегатное состояние, температуры плавления и кипения в ряду фтор – астат, растворимость в воде и в органических растворителях.
1. с. 370-372; 2. с. 340-347; 3. с. 415-416; 4. с. 271-287; 8. с. 367-370.
3. Химические свойства галогенов. Причины высокой химической активности галогенов и её изменение по группе. Отношение к воде, растворам щелочей, к металлам и неметаллам. Влияние температуры на состав продуктов диспропорционирования галогенов в растворах щелочей. Особенности химии фтора. Природные соединения галогенов. Принципы промышленных и лабораторных способов получения галогенов. Применение галогенов. Физиологическое и фармакологическое действие галогенов и их соединений на живые организмы. Токсичность галогенов и меры предосторожности при работе с ними.
1. с. 372-374, с. 387-388; 2. с. 342-347; 3. с. 416-419; 4. с. 276-287; 7. с.340-345, с. 355; 8. с. 380-382.
Простые вещества галогены, в отличие от водорода, очень активны. Для них наиболее характерны окислительные свойства, которые в ряду F2 – At2 постепенно ослабевают. Самый активный из галогенов - фтор: в его атмосфере самовоспламеняются даже вода и песок ! Галогены энергично реагируют с большинством металлов, с неметаллами, со сложными веществами.
4. Получение и применение галогенов.
1. с. 371-372; 2. с. 345-347; 3. с. 416-419; 4. с. 275-287; 7. с.340-345; 8. с. 380-382.
Все
способы получения галогенов основаны
на реакциях окисления галогенид-анионов
различными окислителями: 2Гал-1
-2е-
= Гал![]()
Галогены в промышленности получают электролизом расплавов (F2 и Cl2) или водных растворов (Cl2) галогенидов; вытеснением менее активных галогенов более активными из соответствующих галогенидов (I2 - бромом; I2 или Br2 - хлором)
Галогены в лаборатории получают окислением галогеноводородов (HCl, HBr) в растворах сильными окислителями (KMnO4, K2Cr2O7, PbO2, MnO2, KClO3); окислением галогенидов (NaBr, KI) указанными окислителями в кислой среде (H2SO4).
Бинарные соединения галогенов
1. Соединения с водородом (галогеноводороды). Характер химической связи в молекулах. Полярность молекул. Физические свойства, агрегатное состояние, растворимость в воде. Характер изменения температур плавления и кипения в ряду HF – HI. Ассоциация молекул фтороводорода. Термическая устойчивость галогеноводородов. Реакционная способность. Кислотные свойства, особенности плавиковой кислоты. Восстановительные свойства. Общие принципы получения галогеноводородов: синтез из простых веществ и из галогенидов. Хлороводород и соляная кислота. Физические и химические свойства. Способы получения. Применение соляной кислоты. Роль соляной кислоты и хлоридов в процессах жизнедеятельности. Галогениды.
1. с. 375-382; 2. с. 347-353; 3. с. 419-420; 4. с. 272-275, с. 289-292; 7. с.354-545; 8. с. 370-373, с. 374-375.
2. Соединения галогенов с кислородом.
1. с. 377-380; 2. с. 353-359; 3. с. 420-423; 4. с. 292-296; 7. с.350-354; 8. с. 375-376, с. 379.
3. Соединения с другими неметаллами.
1. с. 375-381; 2. с. 342-345; 4. с. 292-296; 7. с.350-355.
4. Соединения с металлами.
2. с. 342; 4. с. 292-296; 7. с.350-355.
Многоэлементные соединения галогенов
1. Кислородсодержащие кислоты хлора и их соли. Хлорноватистая, хлористая, хлорноватая и хлорная кислоты. Изменение кислотных свойств, устойчивости и окислительных свойств в ряду HClO – HClO4. Принципы получения этих кислот. Гипохлориты, хлориты, хлораты и перхлораты. Термическая устойчивость и окислительные свойства. Общие принципы получения солей. Применение солей. Хлорная известь. Бертоллетова соль. Перхлорат аммония.
1. с. 382-387; 2. с. 353-359; 3. с. 423; 4. с. 292-296; 7. с.350-354; 8. с. 375-378.
2. Кислородсодержащие кислоты брома и иода и их соли.
1. с. 382-387; 2. с. 353-359; 3. с. 423; 4. с. 292-296; 7. с.350-354; 8. с. 379-380.
3. Применение галогенов и их важнейших соединений
1. с. 387-388; 2. с. 345-347; 3. с. 419-423; 4. с. 272-296; 8. с. 380-382.
4. Биологическая роль соединений галогенов
1. с. 387-388; 2. с. 340-347; 3. с. 419-423; 4. с. 272-296; 8. с. 380-382.
Взаимосвязь важнейших соединений хлора:
K
 Cl
+ H2SO4
(конц.)
→ HCl↑ + KHSO4;
Cl
+ H2SO4
(конц.)
→ HCl↑ + KHSO4;HCl(конц.) + KMnO4 → Сl2↑ + MnCl2 + KCl + H2O;
Cl2 + H2O(охл) ↔ HClO + HCl;
HClO
 HClO3
+ HCl;
HClO3
+ HCl;H
ClO3
 HClO4
+ ClO2
+ H2O;
HClO4
+ ClO2
+ H2O;HClO4 + P2O5 → Cl2O7 + HPO3;
Cl2O7
 Cl2
+
O2;
Cl2
+
O2;См. № 5.
ClO2
 Cl2
+
O2;
Cl2
+
O2;ClO2 + H2O(охл) → HClO3 + HClO2;
HClO + P2O5 → Cl2O + HPO3;
Cl2O
 Cl2
+
O2;
Cl2
+
O2;Cl2 + KOH(охл.) → KClO + KCl + H2O;
KClO
 KClO3
+ KCl;
KClO3
+ KCl;KClO3
 KClO4
+ KCl;
KClO4
+ KCl;KClO4 + H2SO4 (конц.) → HClO4↑ + KHSO4;
KClO4 + P2O5
 Cl2O7
+ KPO3;
Cl2O7
+ KPO3;Cl2O7 + H2O → HClO4;
HClO4 + KOH → KClO4 + H2O;
Cl2O7 + KOH → KClO4 + H2O;
KClO4
 KCl + O2;
KCl + O2;KClO3
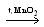 KCl + O2;
KCl + O2;Cl2 + KOH(гор.) → KClO3 + KCl + H2O;
См. № 14;
KClO + CO2 + H2O → HClO + KHCO3
HClO + KOH → KClO+ H2O;
KClO + CO2 → Cl2O + K2CO3;
Cl2O+ KOH(охл.) → KClO + H2O;
HClO3 + KOH → KClO3+ H2O;
KClO3 (р-р) + HClO4 → HClO3 + KClO4↓;
ClO2 + KOH → KClO3 + KClO2 + H2O;
KClO3 + H2SO4 (конц.) → ClO2↑ + HClO4 + KHSO4+ H2O;
KCl + H2O
 Cl2↑
+ H2↑+
KOH;
Cl2↑
+ H2↑+
KOH;Cl2 + K → KCl или см. №№ 13, 23.
Cl2O + H2O(охл.) → HClO.
–
