
Карабинцева Фармацевтическая технология методички / Стерильные и аспетически изготовляемые лекарственные формы 2012
.pdf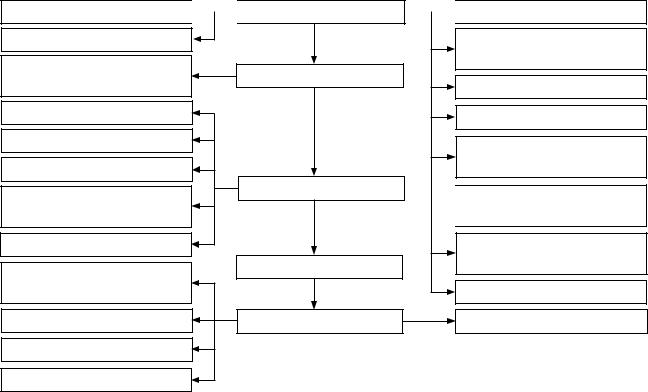
21
Получение воды для инъекций
Фильтрация воды
Приготовление раствора Химический анализ
Фильтрация
Наполнение флаконов
Закрытие пробками
Контроль на механические включения
Закатка колпачков
Контроль на механические включения
Проверка на герметичность
Полный анализ
Маркировка, упаковка

 Подготовительная стадия
Подготовительная стадия
Приготовление раствора
Наполнение
Стерилизация
Упаковка

 Подготовка флаконов, пробок
Подготовка флаконов, пробок
Фильтрация, подогрев обессоленной воды
Промывка кассет
Набор флаконов
Наружная мойка флаконов, пробок
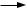
 Внутренняя мойка флаконов
Внутренняя мойка флаконов
Сушка, стерилизация флаконов и пробок
Переработка отходов
Регенерация флаконов
Рис. 2. Типовая технологическая схема изготовления инъекционных растворов [1]
Изготовление
На этой стадии проводят отвешивание порошкообразных веществ, отмеривание растворителей и химический анализ раствора.
В соответствии с приказом МЗ РФ № 308 от 21.10.1997 «Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм» инъекционные растворы готовят массо-объемным способом в мерной посуде или объем растворителя определяют расчетным путем. При необходимости добавляют стабилизатор. После изготовления проводят идентификацию, определяют количественное содержание ЛВ, рН, изотонирующие и стабилизирующие вещества. При удовлетворительном результате анализа раствор фильтруют.
Фильтрование
Фильтрование больших объемов растворов проводят на фильтровальных установках УФЖ-1, УФЖ-2 и др. Фильтр «Грибок» — простейшая установка для фильтрования небольших объемов растворов. Работает под вакуумом.
Одним из требований, предъявляемых к лекарственным формам дляинъекций,являетсяотсутствиемеханическихвключений.Ихналичие недопустимо, так как может при внутрисосудистом введении привести к эмболии.
Дляочисткирастворовотмеханическихпримесейимикробиологических загрязнений применяют фильтрование. В зависимости от размера удаляемых частиц (r) различают:
—грубое фильтрование (r > 50 мкм);
—тонкое фильтрование (r = 50–5 мкм);
—микрофильтрование, в том числе удаление микроорганизмов (r = 5–0,02 мкм);
—ультрафильтрование, в том числе удаление пирогенных веществ, коллоидных частиц и ВМС (r = 0,1–0,001 мкм);
—гиперфильтрация (обратный осмос) (r = 0,001–0,0001 мкм). Тонкое фильтрование используют для удаления из растворов ме-
ханических примесей, микро- и ультрофильтрование — для стерилизации.
В аптеках для фильтрования используют стеклянные фильтры, работающие под вакуумом — фильтровальные установки (рис. 3).
22

Бутыли закрывают крышками и соединяют с вакуумными камерами полиэтиленовыми трубками (10). На задней стороне панели проходит распределительная вакуумная трубка (7), соединенная насосом (8) и вакуумными камерами. Размещение флаконов для сбора профильтрованного раствора производят на регулируемых по высоте подъемных столиках с эксцентриковыми зажимами (13) и съемной пружиной (11), которые плотно поджимают флаконы к вакуумным камерам.
|
|
3 |
5 |
10 6 4 |
10 |
|
|
|
|
|
|
|
|
|
3 |
||
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|
|
|
|
11 |
|
|
|
|
1 |
9 |
|
||
|
|
|
|
|
||||
1 |
2 |
12 |
|
|
||||
|
|
|
||||||
|
|
8 |
|
|
|
|
|
|
Рис. 3. Аппарат стационарного типа для фильтрования:
1 — стойка; 2 — траверза; 3 — металлическая панель; 4 — вакуумные камеры; 5 — кран; 6 — затяжная гайка; 7 — распределительная вакуумная трубка; 8 — насос; 9 — стеклянные фильтры; 10 — полиэтиленовые трубки; 11 — съемная пружина; 12 — бутыли; 13 — эксцентриковые зажимы
Одним из простейших фильтров, применяемых для фильтрования небольших количеств инъекционных растворов, является фильтр «Грибок». Особенность фильтра заключается в том, что воронка закрыта слоем фильтрующего материала. Раствор по трубопроводу поступает в бак и под действием разрежения, создаваемого через вакуумную линию, фильтруется и попадает в бутыль. Для предотвращения переброса капель в вакуумную линию устанавливается ресивер.
23
Фасовка
Для фасовки инъекционных растворов используют стерильные флаконы из нейтрального стекла НС-1, НС-2. Для укупорки флаконов применяют пробки из специальных сортов резины: силиконовые (ИР-21), из нейтрального каучука (25П), бутилового каучука
(ИР-119).
После фасовки проводят первичный контроль каждого флакона на отсутствие механических включений визуальным методом, при их обнаружении раствор перефильтровывают. После контроля на чистоту флаконы обкатывают металлическими колпачками при помощи приспособления для обжима крышек и колпачков (ПОК) или более совершенного полуавтомата ЗП-1. После укупорки флаконы маркируют путем надписи или штамповкой либо с помощью жетона с указанием названия раствора и его концентрации.
Стерилизация
Стерилизация — процесс умерщвления в объекте или удаления из него микроорганизмов всех видов, находящихся на всех стадиях развития.
Объекты стерилизации: воздух помещений, вспомогательный материал, посуда, упаковочные средства, растворители, лекарственные вещества (кроме веществ с бактерицидным действием), конечный продукт.
Методы стерилизации:
—термические (паровой и воздушный);
—химические (газовый и стерилизация растворами);
—стерилизация фильтрованием;
—радиационный метод;
—стерилизация ультрафиолетовым излучением.
Водныерастворычащевсегостерилизуютнасыщеннымпаромпод давлением в паровых стерилизаторах вертикальных (марки ВК-15, ВК-3) (рис. 4) и горизонтальных (ГК-100, ГП-280 и др.). В отдельных случаях растворы стерилизуют текучим паром при температуре 100 °С, когда этот метод является единственно возможным для данного раствора. Текучий пар эффективен только против вегетативных форм микроорганизмов.
24

Стерилизовать растворы следует не позже, чем через 3 ч после началаизготовления.Стерилизацияраствороввемкостиболее1лне разрешается. Повторная стерилизация растворов запрещена.
После стерилизации проводят вторичный контроль на отсутствие механических включений, качество укупорки флаконов и полный химический контроль, т. е. проверяют рН, подлинность и количественное содержание действующих веществ. Стабилизаторы после стерилизации проверяют только в случаях, предусмотренных в НД. Для контроля после стерилизации отбирается один флакон от каждой серии.
Рис. 4. Стерилизатор вертикальный круглый электрический
В аптеках чаще всего используют термические методы, а имен-
но стерилизацию насыщенным паром под давлением. Метод основан на способности водяного пара вызывать набухание и коагуляцию клеточного белка, что приводит к гибели вегетативных и споровых форм микроорганизмов.
Водуирастворыстерилизуютприизбыточномдавлении0,11мПа и t = 120 °С, время стерилизации от 8 до 15 мин в зависимости от
25
объема, масла стерилизуют 2 ч. Паром под давлением стерилизуют изделия из стекла, фарфора, металла, вспомогательные материалы также при избыточном давлении 0,2 мПа и t = 132 °С. Паровую стерилизацию проводят в автоклавах.
Воздушный метод стерилизации заключается в использовании горячего воздуха (t = 160, 180, 200 °С), который обеспечивает пирогенетическое разложение белка и гибель микроорганизмов. Метод рекомендуется для стерилизации термостабильных порошков (NaCl, ZnO, тальк, белая глина) и масел, а также изделий из стекла, фарфора, металла, силиконовой резины, установок для стерилизующего фильтрования. Водные растворы этим методом не стерилизуют, так как:
—не обеспечивается быстрый нагрев до нужной температуры;
—при высоких температурах разлагаются лекарственные веще-
ства;
—возможен разрыв флаконов.
Стерилизациюгорячимвоздухомпроводятввоздушныхстерилизаторах, состоящих из стерилизационной камеры с полками и дверкой. Также пригодны обычные сушильные шкафы с электрообогревом.
Контрольпараметровиэффективноститермическихметодовстерилизации осуществляют:
—с помощью контрольно-измерительных приборов;
—химических тестов;
—биологических тестов.
Химический тест — это вещества, изменяющие свой цвет или физическое состояние при определенных параметрах стерилизации (например, на изменения температуры реагируют бензойная кислота, сахароза и др.).
Биологический тест — это объект из установленного материала, обсемененного тест-микроорганизмами, которые должны погибнуть при определенных условиях стерилизации.
Стерилизация фильтрованием имеет преимущества по сравне-
нию с методами термической стерилизации, для растворов термолабильных веществ этот метод является единственно доступным.
В зависимости от цели подбирают соответствующие фильтрующиематериалы,которыедолжныотвечатьследующимтребованиям:
26
—обеспечивать необходимую степень очистки растворов;
—обладать механической прочностью, чтобы не загрязнять фильтрат;
—иметь минимальное гидравлическое сопротивление;
—быть биологически безвредными;
—быть химически стабильными по отношению к лекарственным веществам и растворителю;
—выдерживать термическую стерилизацию.
Классификация фильтрующих материалов: По природе:
—натуральные;
—синтетические.
По механизму фильтрования:
—глубинные;
—мембранные.
Глубинные фильтры — фильтры, в которых задержание частиц происходит по всей глубине механическим путем в местах пересечения волокон или в результате адсорбции. Глубинные фильтры изготавливают из волокнистого материала или спеченного и спрессованного зернистого материала: шелк, лавсан, марля, капрон, стекловолокно, уголь активированный и др.
Достоинство глубинных фильтров — возможность использования для тонкой очистки и стерильной фильтрации.
Недостатки:
—возможность прохождения частиц через фильтры при изменении режима фильтрования;
—прорастаниеколониймикроорганизмоввглубинефильтрапри длительной эксплуатации;
—возможность загрязнения фильтрата частицами фильтра. Запрещено использование в производстве инъекционных раство-
ров фильтров из асбеста и стекловолокна.
Мембранные фильтры — тонкие, толщиной 100–150 мкм пластины с постоянным размером пор. Работают по принципу сита.
По способу получения мембраны классифицируют на ядерные, пленочные (из растворов и расплавов полимеров), порошковые и волоконные. Материалы: целлюлоза, поливинилхлорид, акрил, нейлон, тефлон и другие полимеры.
27
Ядерные (трековые) фильтры получают путем облучения полимеров продуктами радиоактивного распада. После облучения их выдерживают в протравливающем растворе до образования сквозных отверстий в местах прохождения радиоактивных частиц. Главные отличительные свойства ядерных мембран — малая толщина и высокая однородность пор по размерам.
Достоинства мембранных фильтров:
—задерживают все частицы крупнее своих пор;
—не загрязняют фильтрат волокнами;
—не поглощают фильтруемую жидкость;
—могут подвергаться проверке на целостность методом «точка пузырька», который основан на определении минимального давления, необходимого для продавливания пузырька воздуха через поры мембраны;
—не требуют промывания и выщелачивания.
Недостатки:
—большая склонность к забиванию, по сравнению с глубинными фильтрами, поэтому проводят предфильтрацию;
—большая чувствительность к тепловому воздействию (обычно мембраны используют при температуре не выше 130 °С);
—более низкая пропускная способность и, как следствие, меньшая производительность процесса фильтрования.
Примеры мембранных фильтров: «Миллипор» (США), «Владипор» и «Трекпор» (Россия).
Растворы фильтруют через мембранные фильтры под вакуумом или под давлением. Для задержки крупных частиц и предотвращения быстрого забивания пор помещают предфильтры с более крупными порами (из специальных сортов картона, полимерных материалов, фильтровальной бумаги).
Стерилизующую фильтрацию осуществляют в установках, включающих емкость с приготовленным раствором, фильтродержатель, емкость для фильтрата и источник избыточного давления (насос). Фильтродержатели применяют двух типов: пластинчатые и фильтрпатроны с одним трубчатым фильтром или более.
Эффективностьстерилизациипроверяютпрямымпосевомпробы фильтрата в питательную среду.
Используется также стерилизация ультрафиолетовым излуче-
нием,котороегубительнодлямикроорганизмов,причеммаксималь-
28
ная бактерицидная активность наблюдается у лучей с длиной волны 253,7–257,5 нм. Источником их являются лампы люминесцентного излучения, работающие на принципе газового разряда, возникающего в парах ртути при определенном напряжении тока, подаваемого на электроды лампы.
Аптеки применяют бактерицидные лампы для стерилизации воздуха, стен оборудования в стерильных блоках и боксах, в ассистентских комнатах. При использовании бактерицидных ламп для стерилизации воздуха необходимо учитывать вредное воздействие длительного облучения на человека. Применение неэкранированных бактерицидных ламп в присутствии людей не допускается.
Стерилизация ультрафиолетовым излучением растворов в ампулах и флаконах невозможна, так как стекло поглощает ультрафиолетовое излучение.
Стандартизация
Стандартизация проводится после стерилизации по следующим показателям: отсутствие механических включений, прозрачность, цветность, значение рН, подлинность и количественное содержание действующих веществ. Инъекционные лекарственные формы и вода для инъекций периодически, не реже 2 раз в квартал, проверяются органами Госсанэпиднадзора на стерильность и ежеквартально — на апирогенность.
Растворы для инъекций считаются забракованными, если они не соответствуют нормам хотя бы по одному из показателей, а именно: физико-химические свойства, содержание видимых механических включений, стерильность, апирогенность, а также при нарушении герметичности укупорки и недостаточном объеме заполнения флакона.
Оформление к отпуску
На флакон наклеивают этикетку белого цвета с синей сигнальной полосой, с обязательным указанием наименования раствора, его концентрации, даты изготовления, условий и срока хранения. Сроки хранения инъекционных лекарственных форм регламентированы приказом МЗ РФ № 214 от 16.07.1997.
29
Эталон приготовления лекарственной формы
Rp.: Sol. Magnii sulfatis 25% — 50 ml Sterilisetur!
Da. Signa: Для инъекций
Характеристика лекарственной формы. Стерильная лекар-
ственная форма для внутримышечного введения, не требующая стабилизации.
Технология и ее обоснование. Раствор готовят массо-объемным способом в асептических условиях. В стерильной мерной колбе на 50 мл растворяют в части воды для инъекций 12,5 г магния сульфата и доводят водой до метки. Проверяют концентрацию и при необходимости доводят ее до требуемой (25 %). Раствор фильтруют, проверяют на отсутствие механических включений, укупоривают стерильной пробкой, обкатывают ее алюминиевым колпачком или обвязывают пергаментной бумагой. Лекарственную форму оснащают этикеткой (пергаментная бумага 3×6 см), на которой черным каран- дашомделаютнадписьпровизора-технологаистерилизуютпритем- пературе 120 °С 8 мин под давлением. После стерилизации проводят вторичный контроль.
Готовый раствор оформляют этикеткой синего цвета «Для инъекций». На этикетке указывают номер аптеки, ФИО больного, состав лекарства, способ применения, дату изготовления, условия и срок хранения.
Паспорт письменного контроля
Дата ______________ № рецепта ________
Magnium sulfatis 12,5
Aqua pro injectionibus ad 50 ml V = 50 ml
Приготовил:(подпись) Проверил: (подпись) Отпустил: (подпись)
30
