
16,17,18
.pdf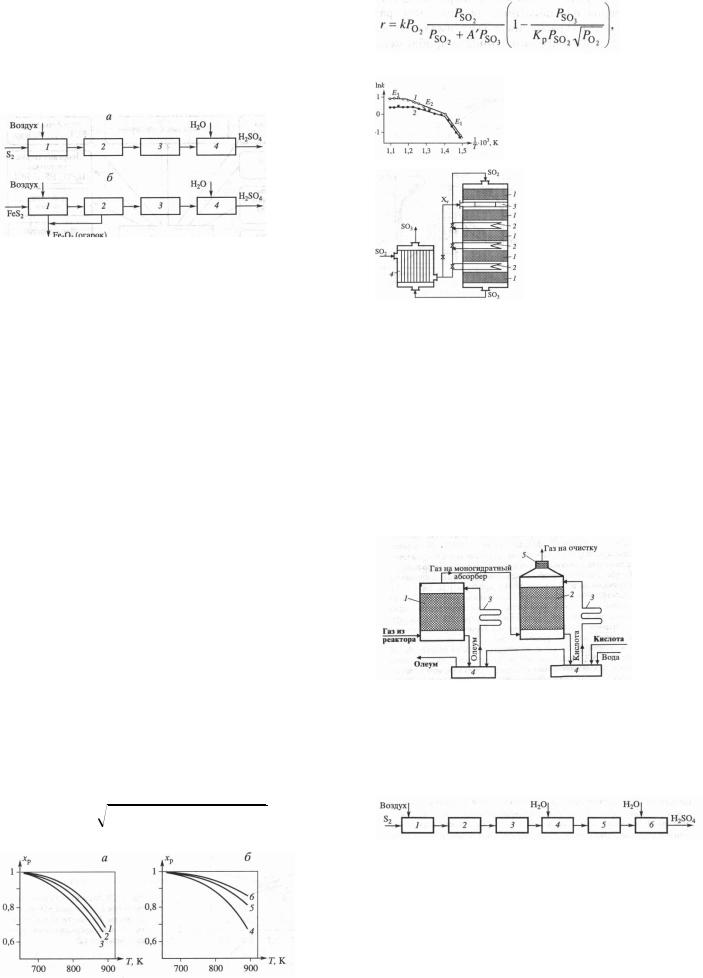
16. Производство серной к-ты.
1. Химич. схема:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 обжиг серн. колчедана или серы S2 + 2O2 = 2SO2
окисление SO2 + 0,5O2 = SO3
абсорбция SO3 + H2O = H2SO4 2. Структурная схема:
1 – обжиг серосодержащ. сырья; 2 – очистка и промывка обжигового газа; 3 – окисление SO2; 4 – абсорбция SO3.
3. Обжиг серосодерж. сырья: а) обжиг колчедана, состоит из:
термической диссоциации 2FeS2 = 2FeS + S2 газофазн. горения серы S2 + 2O2 = 2SO2 горения пирротина 4FeS + 7O2 = 2Fe2O3 + 4SO2 При избытке или недостатке O2 образуется:
3FeS2 + 8O2 = Fe3O4 + 6SO2
Процесс ведут при T= 1120 -1170 К;
Лимитир. стадия –массоперенос ок-ля к месту реакции, а прод. разложения – в газ. фазу.
Проведение процесса – в печах кипящего слоя (предотвращ. слипания частиц, хороший контакт с газом, выравн. темп. поля по всему слою)
Интенсивность до 1000 кг/м2ч, конц. SO2 – 13-15%. Дальнейш. очистка SO2 от пыли – циклон, электрофильтр. б) обжиг серы:
перед сжиганием расплавляют; отстаивают и фильтруют для удаления примесей, насосом подают в печь сжигания.
Для горения серы – диспергирование в потоке воздуха и испарение.
Температура в печи сгорания – до 1300 К, использ. котелутилизатор для использ. теплоты реакции.
Газ от сжигания серы богаче кислородом.
4. Окисление SO2: SO2 + 0,5O2 = SO3;
Реакция обратимая, экзотермич., протекает на Kat с уменьш. объема.
Зависимость Kp от Т: lgKp = 4905/T – 4,6455.
Равновесная степень превращения:
xp KP 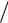 KP
KP 
 1 0,5axp
1 0,5axp 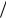 P(b 0,5axp )
P(b 0,5axp )
Зависимость Хр от Т при разных C0 (a) и Р (б):
Скорость реакции, ур-е Борескова -Иванова: (А’ = 0,8)
Зависимость константы скорости от температуры, катализаторы – СВД и ИК – 1 – 6 (ванадиевые)
Реактор окисления SO2: 1 – слои Kat;
2 – промежуточные т/обм;
3 – смеситель;
4 – внешний т/обм; XГ – холодный газ.
5. Абсорбция SO3 SO2 + H2O = H2SO4.
В широком интервале конц. H2SO4 в пар. фазе присутств. почти чистые пары воды, а над олеумом (р-р SO3 в H2SO4)
– SO3. Мин. содержаине воды в паровой фазепри конц. 98,3% к-ты (азеотроп) – соответсвует наиболее полная абсорбция SO3. При меньшей конц. – абсорбция в паровой фазе, при большей – неполное поглощение.
Влияние T на абсорбцию: растворимость SO3 и скорость р-и в жидк. фазе растут при уменьш. Т.
Оптимальные условия: конц. H2SO4 в жидк. должна быть близка к азеотропной, температура – не более 350 К. Схема абсорбции:
1 – олеумный абсорбер; 2 – моногидратный абсорбер; 3 – холодильники; 4 – сборники к-ты; 5 – брызгоотделитель.
6. Рациональное использ. сырья и энергии:
а) окисление SO2 – снижение темп. в нижних солях реакт. ниже 610К или увелич. давления выше 1,2 МПа; удаление продукта р-и из газ. смеси (двойная абсорбция):
1 – получ-е SO2; 2 – промывка обжигового газа; 3,5 – первая и вторая сист. окисл-я SO2, 4,6 – первая и вторая сист. абсорбции.
17. Производство аммиака
1. Химическая схема:
паровая конверсия метана CH4 + H2O = CO + 3H2; конверсия СО + H2O = CO2 + H2;
синтез аммиака N2 + 3H2 = 2NH3. 2. Структурн. схема:
1 – очистка прир. газа от серосодерж. соед.; 2 – конверсия метана; 3 – конверсия CO; 4 – очистка от оксидов углерода; 5
– синтез аммиака.
3. Конверсия метана: на никелевом катализаторе:
CH4 + H2O = CO + 3H2 –Q; CO + H2O = CO2 + H2 + Q.
Процесс – в трубчатой печи при повышенной темп. (1300 К) Оптимальное давление – 4 МПа;
Двухкратный изб. вод. пара для достижения xp = 99% Теплота реакц. смеси после реактора утилизир. в котлеутилизаторе.
4. Конверсия СО: Fe-Cr (T = 600 – 700 К) или Cu (T = 480 – 530
К) катализаторы. Реакц. обратимая экзотермическая. Реактор с адиабатич. слоями катализатора с охлажд. реакц. смеси между ними.
1- увлажнитель, 2 – реакт. с Fe-Cr Kat, 3 – котел-утилизатор; 4
– реакт. с Cu Kat
5. Очистка азотоводородной смеси от оксидов углерода: 17-18% СО2 и 0,3-0,5% СО (каталитич. яд).
а)МЭА-очистка: десорбц. 19-21% водн. р-ром моноэтаноламина NH2CH2CH2OH:
2RNH2 + H2O + CO2 = (RNH3)2CO3. Процесс: абсорбция (Т = 330К) – очистка газа; десорбц. чист. CO2 и регенерация МЭА. б)CO + 3H2 = CH4 + H2O. Обратная конверсия метана, T = 500550 К; никелевый Kat, изб. H2
6. Синтез NH3: N2 + 3H2 = 2NH3 + Q.
Kat – пористое железо с добавками Al, K, Ca и др. T = 650 – 830 K.
Обратимая р-я, вправо равновесие сдвигает уменьш. Т и увелич. P. Степень превращения более 20% - при давлении
30-32 МПа.
Реактор синтеза аммиака – трубчатый с охлаждением или многослойный с промежут. т/обм.
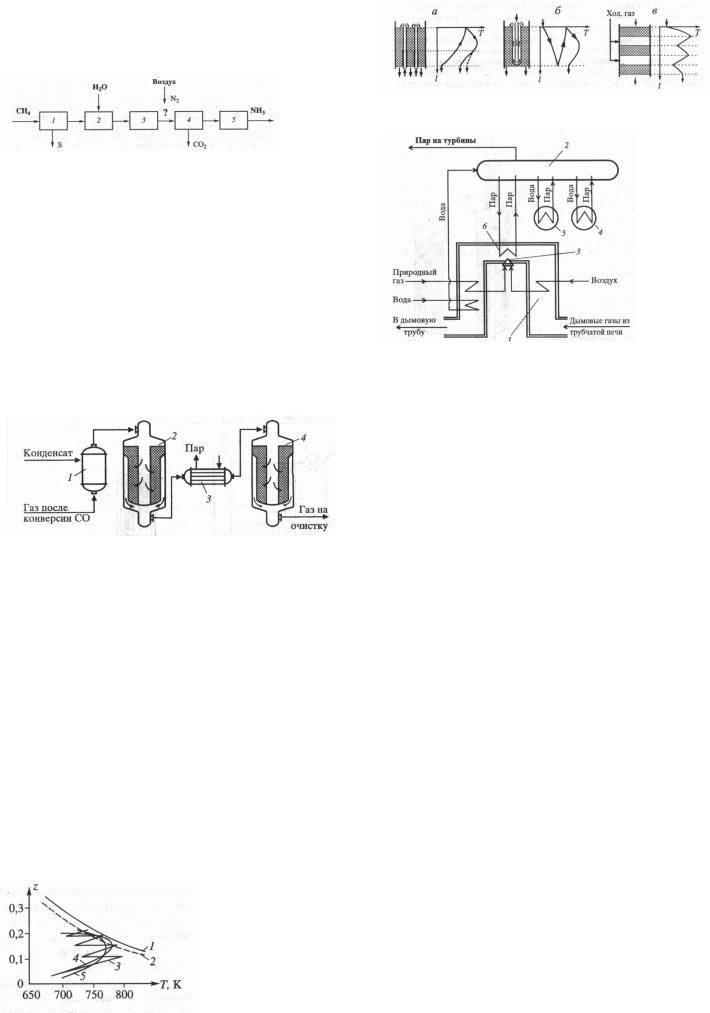
z – конц. аммиака в реакц. смеси 1 – равновесные конц.; 2 – ЛОТ;
3 – многослойный реактор (в)
4, 5 – трубчат. реакторы (a, б) Типы реакторов:
7. Рациональн. использ. сырья и ресурсов Энерготехнологич. схема
1 – газоход после печи конверсии метана; 2 – паросборник; 3
– доп. горелка; 4, 5- котлы-утилизаторы (после конверт. метана и СО); 6 – вспомогат. котел.
Пар идет на турбины компрессоров.
18. Производство азотной кислоты.
1. Химич. схема:
окисление аммиака 4NH3 + 5O2 = 4NO + 6H2O + Q окисление оксида азота 2NO + O2 = 2NO2 + Q
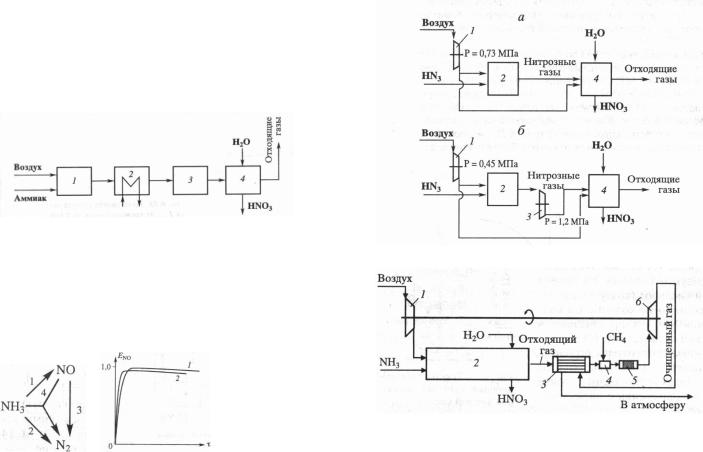
поглощение NO2 водой 3NO2 + H2O = 2HNO3 + NO + Q 2. Функциональн. схема:
1 – оксил. NH3; 2 – охлажд. газов; 3 – окислю NO; 4 –
абсорбция.
Энерготехнологич. схема производства аммиака:
3. Окисление аммиака: необратимая экзотерм. каталитич.
реакция: 4NH3 + 5O2 = 4NO + 6H2O + Q; 4NH3 + 3O2 = 2N2 + 6H2O + Q.
Kat: Pt или Pt(81-92%)/Pd/Rh(родий). Т = 1100 – 1200 K.
Схема превращения и выход NO:
Время процесса 10-4 с, катализатор непористый, выход NO совпад. с селективностью по NO. При увелич. P уменьш. выход (1 – 0,1 МПа, 2 – 0,7 МПа), но увелич. скорость процесса и уменьш. число катализаторных сеток.
4. Окисление NO: обратим. экзотерм. р-я. Опт. температура – ниже 400К. Кинетич. модель: r k1PNO2 PО2 k2 PNO2 2
Увелич. Р ускоряет р-ю.
Аппарат – окислитель – полый, обеспеч. необх. время пребывания. Требуется охлажд. – скоростной т/обм – конденсатор.
При охлажд. конденсир. вода; образует с NO2 азотн. кислоту. Сокращение времени контакта газа с водой, образ. к-та отправл. в сечение колонны, соотв. её конц (30%)
5.Абсорбция: 2NO2 + H2O = HNO3 + HNO2; 3HNO3 = HNO2 + 2NO + H2O.
Суммарно: 3NO2 + H2O = 2HNO3 + NO+ Q.
Абсорбц. колонна с переливными ситчат. тарелками. Барботаж в слое жидк. на тарелке обеспеч. поглощение газ. смесии жидкофазн. окисл-е NO.
Суммарно: 4NO2 + 2H2O + O2 = 4HNO3 или 4NH3 + 8O2 = 4HNO3 + 4H2O.
Понижение T – улучш. поглощение NO2, отвод теплоты – змеевиковые холодильники;
Повышение P – улучш. поглощение NO2 и увелич. конц. к-ты:
1aтм – 47-49%; 7 атм – 58%; 11 атм – 62%.
6.Эффективн. использ. энергоресурсов:
Процесс под единым давлением (а) или при двух давлениях
(б):
1 – воздушн. компрессор; 2 – окисл. аммиака; 3 – компрессор нитрозн. газов; 4 – абсорбц. нитрозн. газов
1 – компрессор; 2 – аппараты; 3 – т/обм; 4 – газ.горелка; 5 – реактор каталитич. очистки; 6 – газ. турбина.
Дополнит. энергетич. узел – газ. горелка 4, нагрев. газы из абсорбера до 1000-1050 К, вместе с нейтрализацией оксидов азота на Pd катализаторе.
