
Лабораторные работыпо теме Квантовая физика. Номера 30, 40, 44, 46
.pdf
5.Установить коллиматор УМ-2 входной щелью вплотную к про-
рези в защитном кожухе. Перемещая окуляр О3 в зрительной трубке добиться чёткого изображения спектра водорода. Установить: какие линии этого спектра принадлежат серии Бальмера. Наличие молекулярного водорода в газоразрядной трубке приводит к появлению полос молекулярного спектра, затрудняющих наблюдение линий атомарного спектра.
6.Вращая барабан М последовательно совместить нить зрительной трубы с линиями спектра, делая отсчёты. Измерения повторить три раза для каждой линии спектра. Воспользовавшись градуировочным графиком определить длины волн спектральных линий атома водорода. Данные занести в таблицу № 2.
Таблица № 2
Цвет |
|
Отсчёт |
λэксп |
|
Rэксп |
Тип перехода |
||
линии |
|
по |
из |
|
м–1 |
|
|
|
|
|
барабану, |
графика |
|
|
|
|
|
|
|
φ |
м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Красная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зелёно- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
голубая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фиолетово- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
синяя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фиолетовая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Среднее значение <R> |
Rтеор |
|
ε = |
|< R > −Rтеор | |
100% |
|||
м–1 |
|
м–1 |
|
Rтеор |
||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
7. Для каждой из наблюдаемых линий водорода вычислить значение постоянной Ридберга, воспользовавшись формулой
R = |
1 |
|
|
1 |
|
, |
|
λ |
1 |
− |
1 |
||||
|
|
|
|||||
|
|
|
n2 |
n2 |
|
||
|
|
|
|
|
|||
|
|
|
|
|
1 |
|
где: λ- длина волны,
n = 2, n1 = n + 1, n + 2, n + 3, n + 4, n + 5, и т. д. 8. Определить среднее значение <R>
< R >= R1 + R2 + R3 + R4
4
9. Воспользовавшись формулой рассчитать постоянную Ридберга, значение которой даёт теория для атома водорода, и сравнить её с экспериментальным значением
R = |
me4 |
= |
me4 |
|
64π3ε02 h3c |
8ε02 h3c |
|||
|
|
где: m = 9,109534·10–31 кг - масса электрона, e = 1,602189·10–19 Кл- заряд электрона,
h = 6,626176·10–34 Дж·с - постоянная Планка, с = 2,997925·108 м/с - скорость света в вакууме,
ε0 = 8,854188·10–12 Ф/м.
10. Воспользовавшись схемой состояний (рис. 3 приложения), записать в таблице № 2 в условных обозначениях типы переходов, соответствующих каждой наблюдаемой линии спектра.
21 |
22 |

ПРИЛОЖЕНИЕ I
Основные определения и законы теплового излучения
Тепловое излучение – это явление испускания электромагнитных волн нагретыми твердыми телами, жидкостями и газами за счёт внутренней энергии.
Уравнения электромагнитной волны
E(rr,t) = Er0 cos(ωt −кrrr+α) , H (rr,t) = Hr0 cos(ωt −кrrr +α) .
Поток энергии излучения – это величина, равная энергии, испускаемой телом в единицу времени по всем направлениям, во всём интервале частот
Ф= Wt - среднее значение,
Ф= dWdt - мгновенное значение,
[Ф] = Джс = Вт .
Энергетическая светимость – это величина, равная потоку энергии, испускаемому единицей поверхности излучающего тела по всем направлениям во всём интервале частот
R = ФS - среднее значение,
R = ddSФ - мгновенное значение,
[R] = Втм2 .
Спектральная плотность энергетической светимости (или ис-
пускательная способность) – это величина, равная энергетической светимости в единичном интервале частот (или длин волн)
r |
= |
dR |
, или |
r |
= |
dR |
, |
[r |
] = |
Вт |
, |
|
dω |
dλ |
м2 м |
||||||||||
ω,T |
|
|
λ,T |
|
|
λ,T |
|
|
||||
|
|
|
R = ∞∫rω,T dω = ∞∫rλ,T dλ . |
|
|
|
||||||
|
|
|
0 |
|
0 |
|
|
|
|
|
||
Поглощательная способность – это величина, равная отношению потока, поглощенного телом, к потоку падающему
aω,T = Фпогл ≤1 .
Ф
пад
Абсолютно чёрное тело (АЧТ) – это тело, полностью поглощающее все падающее на него излучение всех частот. Для АЧТ коэффициент поглощения всегда равен единице
aω,T =1.
Тело, для которого aω,T <1 , называют серым.
Закон Кирхгофа. Отношение испускательной способности тела к его поглощательной способности не зависит от природы тела и является для всех тел одной и той же универсальной функцией температуры и частоты (или длины волны)
rω,T |
= f (ω,T ) или |
rλ,T |
= f (λ,T ) . |
|
a |
a |
|||
|
|
|||
ω,T |
|
λ,T |
|
Для абсолютно чёрного тела aω,T =1. Следовательно, f (ω,T ) уни-
версальная функция Кирхгофа – есть испускательная способность абсолютно черного тела.
Закон Стефана-Больцмана. Энергетическая светимость абсолютно черного тела прямо пропорциональна четвёртой степени абсолютной температуры
|
|
R =σT 4 , |
|
где σ = 5,67·10–8 |
Вт |
- постоянная Стефана-Больцмана. |
|
м2 К4 |
|||
|
|
Законы Вина.
1) С повышением температуры максимум спектральной плотности энергетической светимости смещается в сторону коротких волн
|
λ = |
c1 |
, |
|
|
|
|
||
|
m |
T |
|
|
где c1 = 2,9·10–3м·К – первая посто- r(λ,T) |
||||
янная Вина. |
|
|
|
|
2) |
Максимальное |
значение |
||
спектральной плотности энергети- |
||||
ческой |
светимости |
пропорцио- |
||
нально пятой степени абсолютной температуры
 T1
T1
T2 < T1
T3 < T2
rmax = c2T 5 , |
λ1 |
λ |
|
λ2 λ3 |
23 |
24 |
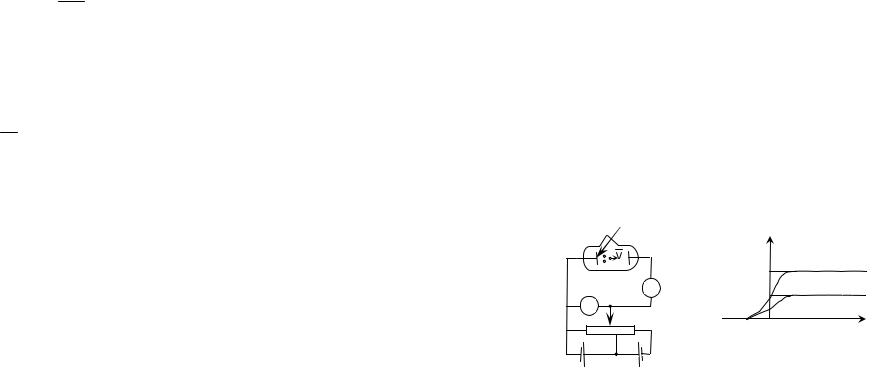
где c2 = 1,29·10–5 мВт3 К - вторая постоянная Вина.
Постоянные Вина с1 и c2 получены экспериментально
Гипотеза Планка. Электромагнитное излучение испускается в виде отдельных порций энергии (квантов), величина которых пропорциональна частоте излучения
ε = hν = hω ,
где h = 6,62·10–34 Дж·с – постоянная Планка, h = 2hπ =1,056·10−34 Дж·с .
Формула Планка дает спектральную плотность энергетической светимости абсолютно черного тела
f (ω,T ) |
= |
|
hω3 |
|
|
1 |
|
|
, |
|
|||||
|
4π2c2 |
|
|
hω |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
e kT |
−1 |
|||||||||
|
|
|
|
|
|
||||||||||
f (ν,T ) = |
2πhν3 |
|
|
1 |
|
|
, |
|
|||||||
|
c2 |
|
e |
hν |
−1 |
|
|||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
kT |
|
|
|
||||||
f (λ, T ) = |
|
2π hc 2 |
|
|
|
|
|
|
|
1 |
|
. |
|||
|
|
|
λ5 |
|
e |
|
|
hc |
|
||||||
|
|
|
|
|
|
|
|
−1 |
|||||||
|
|
|
|
|
|
|
λkT |
|
|||||||
25
ПРИЛОЖЕНИЕ II
Фотоэффект
Внешний фотоэффект – это испускание электронов веществом под действием падающего на него электромагнитного излучения.
Внутренний фотоэффект – это вызванные электромагнитным излучением переходы электронов внутри полупроводника или диэлектрика из связанных состояний в свободные без вылета наружу.
Вентильный фотоэффект – это возникновение ЭДС (фото-ЭДС) при освещении контакта двух разных полупроводников или полупроводника и металла (при отсутствии внешнего электрического поля).
Электрическая схема для экспериментального исследования внешнего фотоэффекта и вольтамперные характеристики вакуумного фотоэлемента приведены на рисунках ниже.
K |
A |
I |
|
||
|
|
I2 > I1 |
|
|
IН2 |
|
µA |
I1 |
|
V |
IH1 |
|
|
|
|
R |
U |
|
-U3 |
0 |
- |
+ |
|
+
 -
-
По величине задерживающего напряжения определяют максимальную кинетическую энергию фотоэлектронов
eUЗ = |
mυ2 |
||
max |
. |
||
2 |
|||
|
|
||
Законы внешнего фотоэффекта.
1.При фиксированной частоте падающего света число фотоэлектронов, вырываемых из катода в единицу времени, пропорционально интенсивности света, то есть сила фототока насыщения пропорциональна интенсивности падающего на катод излучения. (Закон Столетова)
2.Максимальная начальная скорость (максимальная начальная кинетическая энергия) фотоэлектронов определяется частотой света и не зависит от его интенсивности.
3.Для каждого вещества существует красная граница фотоэффек-
та, т.е. минимальная частота света ν0, при которой ещё возможен внеш-
26

ний фотоэффект (ν0 зависит от химической природы вещества и состояния его поверхности).
4. Фотоэффект явление практически безынерционное.
Явление фотоэффекта и его закономерности могут быть объяснены на основе предложенной А.Эйнштейном квантовой теории. Свет частоты ν не только испускается, как это предполагал М.Планк, но и распространяется в пространстве и поглощается веществом отдельными порциями (квантами), энергия которых ε = hν . Кванты электромагнитного излучения получили название фотонов. Энергия фотона
ε = hν = hcλ .
По Эйнштейну, каждый квант поглощается только одним электроном. Поэтому число вырванных фотоэлектронов должно быть пропорционально интенсивности света (первый закон фотоэффекта).
Безынерционность фотоэффекта объясняется тем, что передача энергии при столкновении фотона с электроном происходит почти мгновенно.
Уравнение Эйнштейна для внешнего фотоэффекта. Энергия падающего фотона расходуется на совершение электроном работы выхода Aвых из металла и на сообщение вылетевшему фотоэлектрону кинетиче-
ской энергии |
mυ2 |
, (по закону сохранения энергии) |
||||
max |
||||||
2 |
||||||
|
|
|
|
|
||
|
|
hν = A |
+ |
mυ2 |
||
|
|
max |
. |
|||
|
|
|
||||
|
|
вых |
|
2 |
|
|
|
|
|
|
|
||
Из этого уравнения следует, что максимальная кинетическая энергия фотоэлектрона линейно возрастает с увеличением частоты падающего излучения (второй закон фотоэффекта). Так как с уменьшением частоты света кинетическая энергия фотоэлектронов уменьшается (для данного металла Авых = const), то при некоторой частоте ν =ν0 кинети-
ческая энергия станет равной нулю и фотоэффект прекратится (третий закон фотоэффекта). Поэтому hν0 = А следовательно ν0 = Ah есть красная граница фотоэффекта для данного металла.
ПРИЛОЖЕНИЕ III
Теория Бора для водородоподобных систем
В основе теории Бора лежала идея связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света.
Теория Бора применима не только к атому водорода, но и к водородоподобной системе, состоящей из ядра с зарядом Ze+ и одного электрона e− , вращающегося вокруг ядра. Примерами таких систем являются ионы He+ , Li+2 и т.п.
Бор, не отказываясь от описания поведения электрона в атоме при помощи законов классической физики, сформулировал постулаты, которые противоречили сохраняющемуся в теории классическому описанию движения электрона в атоме.
Первый постулат Бора. (постулат стационарных орбит) существуют стационарные состояния атома, находясь в которых атом не излучает энергию.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию (правилу квантования орбит Бора)
Ln = mυr = nh , n = 1, 2, 3,…
где m -масса электрона; υ - скорость электрона; r - радиус его орбиты.
Целое число n равно числу длин волн де Бройля для электрона, укладывающихся на длине круговой орбиты. В самом деле, учитывая формулу де Бройля
λ= hp = mhυ = 2mπυh
ипервый постулат Бора, из которого выразим радиус r
r = mnυh ,
найдём отношение длины круговой орбиты к длине волны де Бройля
λl = 2πλr = 2πmυnh 2mπυh = n .
27 |
28 |
Второй постулат Бора (правило частот). При переходе атома из одного стационарного состояния в другое испускается или поглощается один фотон
hν = En − Ek .
При En > Ek происходит излучение фотона, при En < Ek поглоще-
ние.
Получим выражение для энергии атома водорода.
|
|
|
|
|
|
|
|
|
|
|
|
Полная энергия E атома складывается |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
из кинетической энергии Т движения элек- |
||||||||||||||||||
|
|
|
|
|
|
|
|
e- |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
трона и потенциальной энергии взаимодей- |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
ствия с ядром U |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
T = mυ |
, |
U = −e |
|
, |
|||||||||
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
4πε0 r |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E = |
mυ2 |
− |
e2 |
|
. |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4πε0 r |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||
|
По 2-му Закону Ньютона |
Fr = mar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
и закону Кулона |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
F = |
|
e2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4πε0 r2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
имеем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
e2 |
|
= |
mυ2 |
|
, |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
4πε0 r2 |
r |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где |
a = |
υ2 |
|
- центростремительное ускорение. |
|
|
|
|
|
|
||||||||||||||||||
r |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Сокращая на r, получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
e2 |
|
= mυ |
2 |
, |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
4πε0 r |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
то есть
U = –2T.
Из первого постулата Бора выразим радиус r = mnυh ,
тогда сможем найти скорость
e2 mυ |
= mυ |
2 |
, |
υ = |
e2 |
, |
4πε0 nh |
|
4πε0 hn |
||||
|
|
|
|
|
а кинетическая и потенциальная энергии
T = |
mυ |
2 |
|
m |
|
|
e |
2 |
|
2 |
|
|
me |
4 |
|
1 |
, |
|
|
= |
|
|
|
|
= |
|
|
|
|||||||||
|
|
|
4πε0 hn |
32π2ε02 h2 n2 |
||||||||||||||
2 |
|
2 |
|
|
|
|||||||||||||
|
U = −2T |
= − |
|
me4 |
|
|
1 |
|
. |
|
|
|
||||||
|
16π2ε02 h2 n2 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Полная энергия атома водорода
E |
|
=T +U =T − |
2T = −T = − |
me4 |
|
1 |
= − |
|
me4 |
|
1 |
, |
|
n |
32π2ε02 h2 n2 |
8ε02 h2 |
|
n2 |
|||||||||
|
|
|
|
|
|
|
|||||||
|
|
E = − |
13,6 эВ |
, где n = 1, 2, 3, … . |
|
|
|
|
|||||
|
|
n2 |
|
|
|
|
|||||||
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
Энергетические уровни водородоподобной системы
|
En, эВ |
|
0 |
E > 0 |
|
n = 5 |
||
|
||
-0,9 |
n = 4 |
|
-1,5 |
n = 3 |
|
-3,4 |
n = 2 |
Ei
-13,6 |
|
n = 1 |
|
||
|
|
|
E |
|
= − |
Z 2 me4 |
1 |
, |
|
n |
32π2ε02 h2 |
|
n2 |
|||
|
|
|
|
|||
n = 1, 2, 3, … .
Придавая n различные целочисленные значения, получим для атома водорода (Z = 1) возможные уровни энергии, схематически представленные на рисунке.
Энергия атома водорода, с увеличением n, возрастает и энергетические уровни сближаются к границе, соответствующей значению n = ∞.
Атом водорода обладает
минимальной энергией
E1 = –13,6 эВ
при n = 1
и максимальной энергией
E∞ = 0
при n = ∞.
29 |
30 |
Основное состояние – это состояние атома с наименьшей энергией Возбужденное состояние – это любое состояние атома, кроме ос-
новного состояния.
Энергия ионизации – это энергия, которую необходимо сообщить атому, находящемуся в основном состоянии, чтобы удалить электрон
Ei = E∞ − E1 = 0 −(−13,6) =13,6 эВ.
Потенциал ионизации – это ускоряющий потенциал, который должен пройти электрон, чтобы приобрести кинетическую энергию, равную энергии ионизации (потенциал ионизации численно равен энергии ионизации, выраженной в электрон-вольтах (эВ)).
Энергия возбуждения – это энергия, которую необходимо сообщить атому, находящемуся в основном состоянии, чтобы он перешел в возбужденное состояние.
Энергия связи – это энергия, которую необходимо сообщить атому, находящемуся в возбужденном состоянии, чтобы удалить электрон.
Согласно второму постулату Бора при переходе атома водорода из стационарного состояния k в стационарное состояние n с меньшей энергией испускается фотон с энергией
|
|
|
|
|
|
|
|
hν |
|
|
|
|
me4 |
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
. |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
2 |
|
k |
2 |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8ε0 h |
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Учитывая, что hν = |
hc |
|
, получим формулу Бальмера |
||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
λ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
me4 |
|
|
1 |
|
|
1 |
|
|
1 |
|
1 |
|
|||||||||||||||||||
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
= R |
|
|
|
− |
|
|
|
, |
||||||||
|
|
|
|
λ |
8ε |
2 3 |
|
|
|
2 |
k |
2 |
|
|
|
2 |
k |
2 |
||||||||||||||||||
|
|
|
|
|
0 h |
|
c n |
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|||||||||||||||
где |
R = |
me4 |
=1,097·10 |
7 |
м |
−1 |
постоянная Ридберга. |
|
|
|||||||||||||||||||||||||||
8ε02 h3c |
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В ультрафиолетовой области спектра находится серия Лаймана
1 |
1 |
|
1 |
|
|
||
|
= R |
|
− |
|
|
|
, |
λ |
2 |
k |
2 |
||||
|
1 |
|
|
|
|
||
где: n = 1, k = 2, 3, 4 … .
В видимой области спектра – серия Бальмера
1 |
|
1 |
|
1 |
|
|
||
|
= R |
|
|
− |
|
|
|
, |
λ |
2 |
2 |
k |
2 |
||||
|
|
|
|
|
|
|||
где: n = 2, k = 3, 4, 5 … .
В инфракрасной области спектра - серия Пашена
1 |
1 |
|
1 |
|
|
||
|
= R |
|
− |
|
|
|
, |
λ |
2 |
n |
2 |
||||
|
3 |
|
|
|
|
||
31
где: n = 3, k = 4, 5, 6 … .
Серия Брэкета n = 4, k = 5, 6, 7 … . Серия Пфунда n = 5, k = 6, 7, 8 … .
Следовательно теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из выше лежащих возбужденных состояний.
Опыты Дж. Франка и Г. Герца
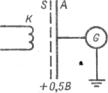
Постулат Бора о существовании стационарных состояний атомов и правило частот нашли свое экспериментальное подтверждение в опытах Д. Франка и Густава Герца (1913). В опытах изучались столкновения электронов с атомами газов методом задерживающего потенциала. Идея опытов заключалась в том, что пучок электронов, ускоряемых в электрическом поле, проходил через газ и электроны испытывали соударения с атомами газа. Первые опыты были поставлены на ртути.
Схема опытов изображена на рисунке. Накаленный катод К, испускающий, электроны, сетчатый электрод S и анод А, соединенный с электрометром или гальванометром G, помещались в стеклянный сосуд, в котором находились ртутные пары при давлении около 0,1 мм рт. ст. Между катодом и сеткой создавалось ускоряющее элек-
трическое поле с разностью потенциалов ϕ1, а между сеткой и анодом – слабое замедляющее поле с разностью потенциалов ϕ2, не превышаю-
щей 0,5 В.
Электроны, встречающие на своем пути атомы ртути, могут испытывать с ними соударения двоякого рода. Первый тип соударений – упругие столкновения, в результате которых энергия электронов не изменяется, а изменяются лишь направления скоростей электронов. Такие упругие столкновения, хотя и затрудняют попадание электронов на анод, не могут быть причиной практически полного отсутствия анодного тока в трубке, который должен возрастать с увеличением разности потенциалов ϕ1.
Второй тип возможных соударений электронов с атомами – неупругие столкновения – связан с потерей электронами их энергии и передачей этой энергии атомам ртути. В соответствии с постулатами Бора каждый из атомов ртути не может принять энергию в любом количестве. Атом может воспринять лишь определенную энергию и перейти при этом в одно из возбужденных энергетических состояний.
32
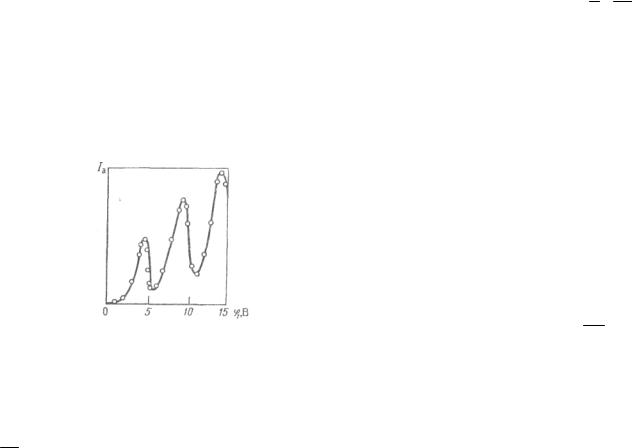
Ближайшее к нормальному состоянию атома ртути возбужденное состояние отстоит от основного по шкале энергий на 4,86 эВ. До тех пор, пока электроны, ускоряемые полем, не приобретут энергию eϕ1 = 4,86 эВ, они испытывают лишь упругие столкновения и анодный ток возрастает с ростом ϕ1. Как только кинетическая энергия электронов достигает 4,86 эВ, начинают происходить неупругие столкновения. Электрон с таким значением энергии полностью отдает ее атому ртути, возбуждая переход одного из электронов атома ртути из нормального энергетического состояния на возбужденный энергетический уровень. Ясно, что такой электрон, потерявший свою кинетическую энергию, не сможет преодолеть задерживающее его поле и не достигнет анода. Таким образом, при разности потенциалов между катодом и сеткой, равной 4,86 эВ, должно происходить резкое падение анодного тока. Аналогичное явление будет при eϕ1 = 2·4,86 эВ, 3·4,86 эВ, вообще говоря, при еϕ1 = n·4,86 эВ, когда электроны могут испытать два, три и т.д. неупругих соударения с атомами ртути, потерять при этом полностью свою энергию и не достигнуть анода.
На рисунке приведена характерная кривая зависимости силы анодного тока от разности потенциалов между катодом и сеткой в опытах Франка и Герца, подтверждающая справедливость первого постулата Бора.
Правило частот Бора также экспериментально подтвердилось в опытах Франка и Герца. Ртутные пары, возбужденные электронным ударом, оказались источником ультрафиолетового излучения с длиной волны 2,537·10–7 м (первая резонансная
линия ртути). Это излучение происходит в тот момент, когда атом ртути, возбужденный электронным ударом на уровень с энергией Е2, возвращается в основное нормальное энергетическое состояние с энергией Е1. Согласно правилу частот Бора, Е2 – Е1 = hv, где Е2 – Е1 = ∆Е. По известному значению ∆Е = 4,86 эВ можно вычислить длину волны излучения:
λ = ∆hcE = 2,537·10−7 м.
Этот результат полностью согласуется с экспериментом.
ПРИЛОЖЕНИЕ IV
Водородоподобная система в квантовой механике
Гипотеза де Бройля. Движение любой микрочастицы с импульсом p = mυ сопровождается волновым процессом с длиной волны
λ = hp = mhυ .
Волновые свойства микрочастицы накладывают ограничения на возможность одновременного определения ее координаты и импульса.
Соотношения неопределенностей Гейзенберга. Невозможно од-
новременно точно определить координату и импульс микрочастицы. Чем точнее мы определяем координату микрочастицы, тем менее точно мы сможем определить ее импульс и наоборот
∆x∆px ≥ h,
∆y∆py ≥ h ,
∆z∆pz ≥ h .
Более того время жизни ∆t микрочастицы на энергетическом уровне связано с шириной энергетического уровня ∆E
∆t∆E ≥ h .
Состояние микрочастицы в квантовой механике описывается волновой функцией ψ(x, y, z,t) .
Физический смысл волновой функции. Квадрат модуля волно-
вой функции дает плотность вероятности обнаружить микрочастицу в данной точке пространства в данный момент времени
ρ = dWdV =|ψ |2 ,
где: ρ - плотность вероятности,
dW – вероятность обнаружить микрочастицу в объеме dV, |ψ|2 = ψ*ψ - квадрат модуля волновой функции, ψ* - функция комплексно-сопряженная к ψ.
Свойства волновой функции.
1)Конечная.
2)Однозначная.
3)Непрерывная.
4)Имеет непрерывные производные по координатам и времени
5) Удовлетворяет условию нормировки: ∫|ψ |2 dV =1 .
V
33 |
34 |

6) Справедлив принцип суперпозиции. Если ψ1 иEi ψ2 являются волновыми функциями, то любая их линейная комбинация
ψ = aψ1 + bψ2,
также является волновой функцией, где a и b произвольные константы.
Волновая функция является решением уравнения Шредингера.
Уравнение Шредингера.
− |
h2 |
∆ψ +Uψ = ih |
∂ψ |
, |
|
2m |
∂t |
||||
|
|
|
где: h =1, 056·10−34 Дж·с- постоянная Планка, m – масса микрочастицы,
∆ψ = ∂2ψ + ∂2ψ + ∂2ψ - оператор Лапласа,
∂x2 ∂y2 ∂z2
U - потенциальная энергия микрочастицы, i – мнимая единица.
Стационарное состояние – это состояние микрочастицы со строго определенной энергией Е. Для стационарного состояния волновая функция имеет вид
− i Et
ψ(x, y, z,t) =ψ(x, y, z)e h ,
где ϕ(x, y, z) - волновая функция, зависящая только от координат.
Стационарное уравнение Шредингера.
− h2 ∆ψ +Uψ = Eψ . 2m
Стационарное уравнение Шредингера для электрона в водородопо-
добном ионе
− h2 ∆ψ − Ze2 ψ = Eψ , 2m 4πε0 r
где: Z – зарядовое число
(Z = 1 для водорода, Z = 2 для He+ , Z = 2 для Li++ ), m = 9,11·10–31 кг – масса электрона,
е = 1,6·10–19 Кл – заряд электрона, ε0 = 8,85·10–12 Ф/м – электрическая постоянная,
h =1, 056·10−34 Дж·с- постоянная Планка,
r – расстояние от ядра до электрона, Е – энергия электрона,
ψ = ψ(x, y, z) - волновая функция, зависящая только от координат.
35
Так как поле, в котором движется электрон, является центральносимметричным, то для решения данного уравнения обычно используют сферическую систему координат r, θ, φ.
В теории дифференциальных уравнений показано, что уравнение
− h2 ∆ψ − Ze2 ψ = Eψ
2m 4πε0 r
имеет решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции ψ, только при собственных значениях энергии
E |
|
= − |
Z 2 me4 |
1 |
, |
|
n |
32π2ε02 h2 |
|
n2 |
|||
|
|
|
|
|||
где n = 1, 2, 3, … - главное квантовое число.
Таким образом, решение уравнения Шредингера для атома водорода (Z = 1) приводит к появлению дискретных энергетических уровней E1, E2, E3, … , показанных на рисунке в виде горизонтальных прямых.
|
En |
|
E > 0 |
|
0 |
|
r |
|
E3 |
Ei |
U(r) |
E2 |
E1
Состояние с наименьшей энергией является основным
E = − |
me4 |
= −13,6 эВ , |
|
32π2ε02 h2 |
|||
1 |
|
все остальные состояния называются возбуждённые.
По мере роста главного квантового числа n энергетические уровни располагаются теснее и при n = ∞ энергия E∞ = 0. При E > 0 движение электрона является свободным.
Энергия ионизации атома водорода
Ei = 0 −(−E1 ) =13,6 эВ.
36
Из решения уравнения Шредингера вытекает, что момент импульса электрона не может быть произвольным, а принимает дискретные значения
L = h l(l +1) ,
где l - орбитальное квантовое число, которое при заданном n принимает значения l = 0, 1, 2, …, (n – 1), т.е. всего n значений.
Из решения уравнения Шредингера следует также, что вектор момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция на направление oz внешнего магнитного поля принимает квантованные значения, кратные h
Lz = hml ,
где ml - магнитное орбитальное квантовое число, которое при задан-
ном l может принимать значения ml = 0, ±1, ±2,..., ±l. , т.е. всего 2l + 1
значений.
Спин электрона – это собственный механический момент импуль-
са электрона, не связанный с движением электрона в пространстве. Спин электрона (и всех других микрочастиц) – квантовая величина,
у неё нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Собственный механический момент импульса (спин) Ls согласно общим выводам квантовой механики квантуется по закону
Ls = h s(s +1) ,
где s = 12 - спиновое квантовое число.
Проекция спина на направление внешнего магнитного поля принимает квантованные значения, кратные h
Lsz = hms ,
где ms - магнитное спиновое квантовое число, которое имеет только два значения ms = ± 12 .
Хотя энергия электрона и зависит только от главного квантового числа n, но каждому собственному значению энергии En (кроме E1) соответствует несколько собственных функций ψ(n,l, ml , ms ) отличаю-
щихся значениями квантовых чисел l, ml и ms Следовательно, атом водорода может иметь одно и тоже значение энергии, находясь в нескольких различных состояниях, соответствующих данному n.
Кратность вырождения – это число квантовых состояний с одинаковой энергией, но отличающихся значениями квантовых чисел l, ml и ms
n−1
∑2(2l +1) = 2n2 .
l =0
Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объёма. Вероятность обнаружения электрона в различных частях атома различна. Электрон при своём движении проявляет волновые свойства, образуя электронное облако, плотность которого характеризует вероятность нахождения электрона в различных точках объёма атома. Квантовые числа n и l характеризует размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве.
Для полного описания состояния электрона в атоме необходимо наряду с главным n, орбитальным l, магнитным орбитальным ml квантовыми числами задавать ещё магнитное спиновое ms квантовое число.
Энергия многоэлектронного атома Enl зависит от главного кван-
тового числа n и орбитального квантового числа l. Если атом помещен во внешнее электрическое или магнитное поле, то энергия зависит также от магнитного ml и спинового ms квантовых чисел.
Спектр – это набор частот или длин волн излучаемых или поглощаемых атомом.
Квантовые числа n, l, ml позволяют более полно описать спектр испускания (поглощения) атома водорода, полученный в теории Бора.
В квантовой механике вводятся правила отбора, ограничивающие число возможных переходов электронов в атоме, связанных с испусканием и поглощением излучения.
Теоретически доказано и экспериментально подтверждено, что для дипольного излучения электрона, движущегося в центральносимметричном поле ядра, могут осуществляться только такие переходы, для которых:
1. изменение орбитального квантового числа ∆l удовлетворяет условию
∆l = ±1;
2. изменение магнитного квантового числа ∆ml удовлетворяет условию
∆ml = 0, ±1 .
37 |
38 |
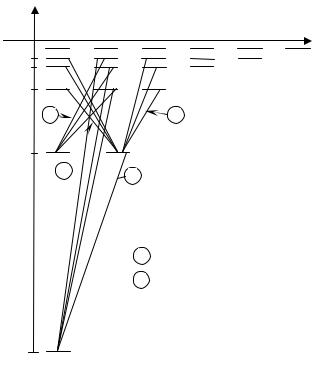
Учитывая число возможных состояний, соответствующих данному n, и правило отбора, рассмотрим спектральные линии атома водорода.
Серии Лаймана соответствуют переходы np →1s (n = 2, 3, …);
Серии Бальмера соответствуют переходы:
|
np → 2s , ns → 2 p , nd → 2 p (n = 3, 4 …). |
||||
|
l=0 |
1 |
2 |
3 |
4 |
0 |
s |
p |
d |
f |
g |
-0,54 |
|
|
|
|
|
-0,85 |
|
|
|
|
|
-1,5 |
|
|
|
|
|
|
2 |
|
|
2 |
|
-3,38 |
|
|
|
|
|
|
2 |
|
1 |
|
|
|
|
|
|
|
|
1
 - серия Лаймана
- серия Лаймана
2 
 - серия Бальмера
- серия Бальмера
1
-13,55
n
Переход электрона из основного состояния в возбужденное обусловлен увеличением энергии атома и может происходить только при сообщении атому энергии извне, например, за счёт поглощения атомом фотона. Так как поглощающий атом находится обычно в основном состоянии, то спектр поглощения атома водорода должен состоять из линий, соответствующих переходам 1s → np (n = 2, 3, …), что находится в полном согласии с опытом.
39 |
40 |
