
Хронические лейкозы. Капустинский М.Н
..pdfХРОНИЧЕСКИЕ ЛИМФО - И МИЕЛОЛЕЙКОЗЫ.
Хронический миелолейкоз (ХМЛ)
Хронический миелолейкоз (ХМЛ) – злокачественная опухоль кроветворной ткани, исходящая из клеток предшественниц миелопоэза, морфологическим субстратом которой являются дифференцирующиеся и зрелые гранулоциты.
ХМЛ был первым из описанных лейкозов. В 1845 году впервые появились сообщения о заболевании, при котором увеличение селезенки, а иногда и печени сочеталось с наличием в крови огромного количества «гнойных телец», т.е. нейтрофилов. R. Virchov впервые дал подробное гистологическое описание заболевания, связав воедино изменения крови и внутренних органов, и назвал его «селезеночной лейкемией».
Пик заболеваемости: возраст 30-50 лет, 30% составляют больные старше 60 лет. Мужчины болеют несколько чаще, чем женщины (соотношение 1:1,5).
Возможные этиологические факторы:
Ионизирующая радиация. Спорный вопрос:
1.Малые дозы радиации.
2.Слабые электромагнитные излучения.
3.Гербициды, инсектициды и т.д.
4.Химические агенты – бензол.
Маркерами генетической предрасположенности к хроническому миелолейкозу является наличие HhA – антигенов CW3 и CW4.
Хронический МЛ является результатом злокачественной трансформации стволовой клетки, что доказывается:
1.вовлечением в патологический процесс не только гранулопоэза, но и эритропоэза и тромбопоэза;
2.наличием филадельфийской хромосомы (22q-) в эритробластах, нейтрофилах, эозинофилах, базофилах, макрофагах и мегакариоцитах;
3.наличием одного и того же изофермента глюкозы-6- фосфатдегидрогеназы в перечисленных клетках, но не в фибробластах и других соматических клетках у женщин с ХМЛ, которые являются
гетерозиготами по изоферментам А и В.
Филадельфийская хромосома обнаруживается у 90-97% больных.
Филадельфийская хромосома – это транслокация длинного плеча 22 хромосомы на 9-ю, содержащую онкоген c-abl, который сливается с онкогенами bcr, что приводит к образованию комплексного гена bcr – abl. Включение его в линии гомопоэтических клеток обуславливает задержку их
созревания и запрограммированную клеточную смерть (апоптоз) и увеличивает ответную реакцию на ростовые факторы.
Патогенетические аспекты ХМЛ.
Главное патогенетическое событие - соматическая мутация,
возникающая в плюрипотентной гемопоэтической стволовой клетке.
При возникновении филадельфийской хромосомы (Ph-хромосомы) происходит обмен генетическим материалом между хромосомами 9 и 22, в результате чего на 22 хромосоме образуется слитный ген BCR-ABL, продукт которого – белок р 210 – является тирозинкиназой с повышенной активностью (тирозинкиназы – энзимы, катализирующие перенос фосфата от АТФ к тирозину на специфических клеточных белках, участвующих в передаче регулирующих сигналов к ядру клетки).
Биологический эффект химерного гена BCR-ABL в гемопоэтических предшественниках:
-нарушение нормального функционирования клетки; -злокачественная трансформация; -нарушение контроля над пролиферацией, адгезией и апоптозом; -вытеснение нормальных стволовых клеток.
Основные диагностические критерии ХМЛ:
●КАК: лейкоцитоз (до 300х109), нейтрофилёз, увеличение количества зрелых гранулоцитов (с/я, п/я нейтрофилов), появление созревающих клеток гранулоцитарного ряда (юныеметамиелоциты, миелоциты, промиелоциты, бластные элементы), эозинофильно-базофильная ассоциация (↑ эозинофилов > 5% и базофилов > 1%), гипертромбоцитоз (↑ тромбоцитов > 320);
●Миелограмма КМ: специфический маркёрPh’- хромосома
(филадельфийская хромосома), увеличение лейкоцитарно-эритроцитарного соотношения20:1 и более (в норма: 3-4:1).
КЛАССИФИКАЦИЯ ХМЛ В течении ХМЛ выделяют 3 фазы:
1)хроническая,
2)акселерации (прогрессирующая, переходная),
3)острая или терминальная или фаза бластной трансформации (бластный криз).
Athens |
(1993) |
предлагает |
выделять |
клинические |
варианты, |
||
морфологические варианты и фазы клинического течения ХМЛ. |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фазы |
Клинические варианты |
|
Морфологические |
клинического |
||||
|
|
течения |
|||||
|
|
|
|
варианты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1. Типичная ХМЛ с |
|
Хроническая |
|
Начальная фаза |
|||
филадельфийской |
эозинофильная лейкемия |
|
|
||||
хромосомой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хроническая |
|
Хроническая |
|
2. Атипичная ХМЛ без |
базофильная лейкемия |
стабильная фаза |
|||||
|
|
|
|
|
|||
филадельфийской хромосомы |
|
Хроническая |
|
Фаза акселерации |
|||
|
|
|
|
|
|||
|
|
|
моноцитарная лейкемия |
|
|
||
|
|
|
|
|
|||
3. Хронический МЛ у детей |
|
Хроническая |
|
Фаза бластного |
|||
|
|
|
|
нейтрофильная |
|
криза |
|
|
|
|
|
лейкемия |
|
|
|
|
|
|
|
|
|
|
|
Клиническая картина.
1) Хроническая фаза. Симптомы ранней хронической фазы ХМЛ не специфичны и случайны. Характеризуется отсутствием клинических проявлений заболевания. Жалобы на слабость, потливость, субфебрильную температуру, боли в левом подреберье (как правило, обусловленные спленомегалией), появляются лишь при развернутой клинической картине заболевания сначала лишь при физической нагрузке, позже и в покое. Больные переносят её «на ногах».
Периферическая кровь: нейтрофилёз, все промежуточные клетки (метамиелоциты, миелоциты, промиелоциты, до 10% бластов), увеличение количества зрелых миелоцитов (с/я, п/я), значительный гипертромбоцитоз.
2) Фаза акселерации. Трактуется как фаза обострения болезни или прогрессирование. Развивается поликлоновый характер процесса. Течение становится злокачественным, резко увеличиваются все субъективные и объективные проявления заболевания. Отмечается экстрамедуллярный опухолевый рост (увеличение лимфатических узлов, печени, селезенки). Клиника напоминает проявления острого лейкоза. Имеет место болевой синдром в костях, мышцах; анемический синдром, спленомегалия (селезёнка может занимать всю брюшную полость, вызывать болевой и компрессионный синдром).
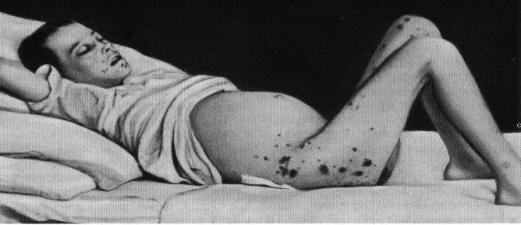
Периферическая кровь: наблюдается значительная анемия, резко увеличено количество лейкоцитов. Много молодых клеток (50%) гранулоцитов одного ряда, увеличивается количество бластов до 15-20%, базофилов до 20% и более, эозинофилов. Количество тромбоцитов разное (↑↓), появляются мегатромбоциты.
Миелограмма:
Увеличение промиелоцитов и бластных клеток от 10 до 20%;
Возрастание базофилов и эозинофилов;
Снижение мегакариоцитов;
Большая редукция красного кровяного ростка.
Трепанобиопсия подвздошной кости: возрастает количество гранулоцитов, бластов и промиелоцитов.
3) Терминальная стадия (бластный криз) – его клиническая симптоматика соответствует клинической картине острого лейкоза.
Возникает внезапное изменение клинической картины: быстрый рост селезенки (инфаркты селезенки) – острые боли в левом подреберье, нередко с иррадиацией в спину, повышение температуры тела до 37,5-38,5 С, иногда – тошнота, рвота; высокая лихорадка (при исключении очагов инфекции); сильные боли в костях, суставах; развитие плотных очагов саркомного роста в коже, лимфатических узлах (чаще наблюдается увеличение лимфатических узлов одной группы). Очаги саркомного роста могут возникать в любом органе, вызывая нарушения его функции, а также в костной ткани; геморрагический синдром.
Все эти новые проявления болезни в терминальной стадии связаны с возникновением новых мутантных субклонов в рамках основного опухолевого клона, неспособных к дифференцировке, но непрерывно пролиферирующих, вытесняющих исходный дифференцирующийся клон клеток.
Рис 3. Геморрагический синдром (по И.А. Кассирскому, 1970)

Периферическая кровь:
выраженная нормохромная анемия с исчезновением ретикулоцитов;
лейкоцитоз (возможна лейкопения);
нейтропения;
значительное увеличение количество бластов до 20 и более;
феномен «провала» в лейкоцитарной формуле, как при остром лейкозе;
тромбоцитопения;
увеличение базофилов зрелых или молодых форм.
Миелограмма:
Увеличение количества бластов до 20% и более;
Уменьшение количества зрелых гранулоцитов;
Значительное снижение мегакариоцитарного и эритроцитарного ростка;
Морфология бластов разнообразна. Различают несколько видов бластного криза в зависимости от морфологических и цитохимических особенностей бластов:
Миелобластный;
Лимфобластный;
Промиелоцитарный;
Миеломонобластный;
Монобластный;
Эритробластный;
Мегакариобластный;
Недифференцированный;
Смешанный.
Методы диагностики ХМЛ.
Морфологическое исследование крови (рис. 1) и пунктата костного мозга.
Рис . Картина крови при ХМЛ: в препарате зрелые и палочкоядерные нейтрофилы, миелоциты, крупные клетки с эозинофильной зернистостью – эозинофильные миелоциты. (по М. Г. Абрамову, 1985)
Кариологическое исследование костного мозга (стандартное цитогенетическое исследование и метод флюоресцентной гибритизации in situ-FISH).
ПЦР – для диагностики и мониторирования минимальной остаточной болезни в процессе терапии (выявление химерного BCR-ABL транскрипта).
Обязательное определение Ph’- хромосомы (филадельфийской хромосомы).
Дифференциальный диагноз.
Идиопатический миелофиброз (ИМ) (сублейкемический миелоз)
возникает в результате пролиферации мутантного клона, происходящего из стволовой кроветворной клетки, способной дифференцироваться в направлении эритроцитов, гранулоцитов и тромбоцитов. Пик заболеваемости приходится на возраст старше 50 лет. Ведущим клиническим проявлением ИМ является спленомегалия, которая определяется у 100% больных. Уже на 1-2 году заболевания наблюдается быстрый рост размеров селезенки, нижний полюс которой пальпируется на 10 см и более ниже края реберной дуги. Постояннный признак ИМ - нормобластоз.
Стернальная пункция при ИМ зачастую оказывается неудачной, «сухой» или дает скудный пунктат с низким содержанием миелокариоцитов.
Решающее значение имеют данные трепанобиопсии: гиперплазия трех ростков миелоидного кроветворения.
Острый лейкоз. Опорные пункты дифференциальной диагностики ОЛ и хронической фазы ХМЛ: наличие при ХМЛ в лейкограмме «промежуточных форм», в то время как для ОЛ характерно лейкемическое «зияние», к тому же в хроническую фазу ХМЛ бластные клетки единичны; наличие эозинофильно-базофильной ассоциации при ХМЛ, при ОЛ – эозинофильно-базофильная диссоциация; количество тромбоцитов при ХМЛ либо нормальное, либо повышенное, между тем, при ОЛ уже с самого начала регистрируется тромбоцитопения. В костном мозге при ОЛ обнаруживается высокое число бластных клеток (>20%), пониженное количество мегакариоцитов или их отсутствие.
Лейкемоидные реакции миелоидного типа (изменения в крови,
напоминающие лейкоз, но не трансформирующиеся в ту опухоль, на которую похожи). Развитие реакций большей частью обусловлено инфекционными и токсическими причинами, менее выраженный «левый» сдвиг в лейкоцитарной формуле, появление токсической зернистости в нейтрофилах, после купирования основного процесса, вызвавшего лейкемоидные реакции, все проявления исчезают.
Лечение ХМЛ.
Первые попытки лечения ХМЛ были предприняты во второй половине XIX века. В 1865 году на заседании Берлинского терапевтического общества Lissauer сообщил о 2-х пациентах, у которых удалось добиться сокращения размера селезенки и улучшения самочувствия применением раствора
мышьяка.
В 1903 году впервые при лечении больного ХМЛ было использовано облучение селезенки рентгеновскими лучами.
Важнейшими событиями в терапии ХМЛ стали синтез производного дисульфоновой кислоты под названиями: в Англии – милеран, во Франции – мизульфан, в нашей стране – миелосан. Это ознаменовало новую эру в лечении ХМЛ. Терапия миелосаном не только улучшила качество жизни больных, но и способствовала увеличению продолжительности жизни.
Лечение миелосаном чрезвычайно просто. При невысоком лейкоцитозе (15,0-30·10х109/л) и не увеличенной или незначительно увеличенной селезенке доза миелосана 2 мг 2-3 раза в неделю оказывается достаточной для снижения лейкоцитов до 8,0-10,0х109/л. С высоким лейкоцитозом (100,0- 500,0х109/л), больших размерах селезенки назначают 6-8 мг препарата ежедневно в течение 2-4 месяцев удается добиться желаемого эффекта снижения лейкоцитоза. При снижении количества лейкоцитов до 7,0- 15,0х109/л, больного переводят на поддерживающее лечение с дозами миелосана 2 мг 1-3 раза в неделю. Побочные действия: у мужчинимпотенция, у женщиннарушение менструального цикла; фиброз лёгочной ткани, гиперпигментация кожи. Продолжительность жизни на фоне этого лечения составляла примерно 3 года.
В 1996 году появилось первое сообщение о применении при лечении ХМЛ гидроксимочевины (гидреа) , которая влияет на более зрелые клетки, обеспечивая быстрое, но кратковременное снижение количества лейкоцитов. Выпускается в капсулах по 500 мг. Назначают 40 мг/кг в сутки с уменьшением дозы до 2 г при снижении лейкоцитов. Схема: при лейкоцитозе более 20 тыс1600 мг/м2 (5-6 капсул), при снижении лейкоцитоза ниже 20 тыс600 мг/м2, отменяется при лейкоцитозе ниже 5 тыс. Продолжительность жизни на фоне этого лечения составляла примерно 5 лет.
Новая эра в терапии ХМЛ началась в 80-е годы с появлением в арсенале лечебных средств -интерферона. Впервые начали применять препарат в США. Позже стали внедрять в клиническую практику рекомбинатный интерферон - (интрон, реаферон, велферон и др). Ежедневные дозы 2-4 МИ/м2, (МИ – 1000000ЕД) вызывали снижение лейкоцитов до 9,0х109/л у 3138% больных. Предложены следующие схемы: лечение ХМЛ следует начинать с цитостатического препарата, лучше всего гидроксимочевины. Может быть использован и миелосан. При снижении количества лейкоцитов до 10,0х10,9/л показано лечение -интерференом. Подобная комбинация позволила добиться клинико-гематологической ремиссии у 67% больных.
В последние годы стали применять препарат Гливек, ингибитор ВСRAbl тирозиновой кислоты. Ингибитор тирозинкиназы Гливек (иматиниб мезилат, STI 571) – наиболее эффективный препарат, который является
стандартом в лечении ХМЛ. Механизм действия Гливека: блокирование активности белка р210-BCR-ABL-тирозинкиназы, играющей ключевую роль в патогенезе ХМЛ. Молекула Гливека по своей структуре соответствует АТФ-связывающему участку тирозинкиназы, ответственной за фосфорилирование многочисленных эффекторных белков и передачу сигналов в клетке. Присоединяясь к этому активному участку вместо АТФ, Гливек нарушает функционирование клетки, что приводит к индукции апоптоза в клетках, содержащих BCR-ABL-тирозинкиназу, и их гибели.
Выбор метода терапии в хронической стадии ХМЛ.
Нетрансплантационные методы лечения: -гливек (ингибитор путей передачи сигналов);
-α-интерферон (восстановление интегринзависимой адгезии клетки); -химиотерапия (гидреа).
Трансплантация костного мозга.
Терапевтические подходы в фазу акселерации.
-Гливек, 6-меркаптопурин, малые дозы цитозара, метотрексат, преднизолон.
Лечебная тактика в терминальной стадии.
-Протокол «7+3», «7+3»+вепезид.
-Протокол "5+2" (цитозар+рубомицин или идарубицин). -СОАР (циклофосфан, винкристин, цитарабин, преднизолон).
-RAСОР (даунорубицин 45 мг/м2 в 1, 2 дни; цитарабин 100 мг/м2 1 раз в день 1-5 дни; винкристин 2 мг в/в 1 день; дексаметазон 10 мг/м2 1-5 дни внутрь).
-COMP (циклофосфан, винкристин, метотрексат, преднизолон).
Профилактика нейролейкемии:
интратекально: метотрексат, цитарабин, дексаметазон.
Применяется аллогенная трансплантация мозга, стволовых клеток.
В последние годы изучена эффективность целого ряда новых лекарственных препаратов в терапии ХМЛ: азидомодина, децитабина, топотскана, трансретиноевой кислоты и др.
Перспективные подходы к терапии.
Тирозинкиназы II поколения: Тасигна (нилотиниб), Спрайсел (дазатиниб).
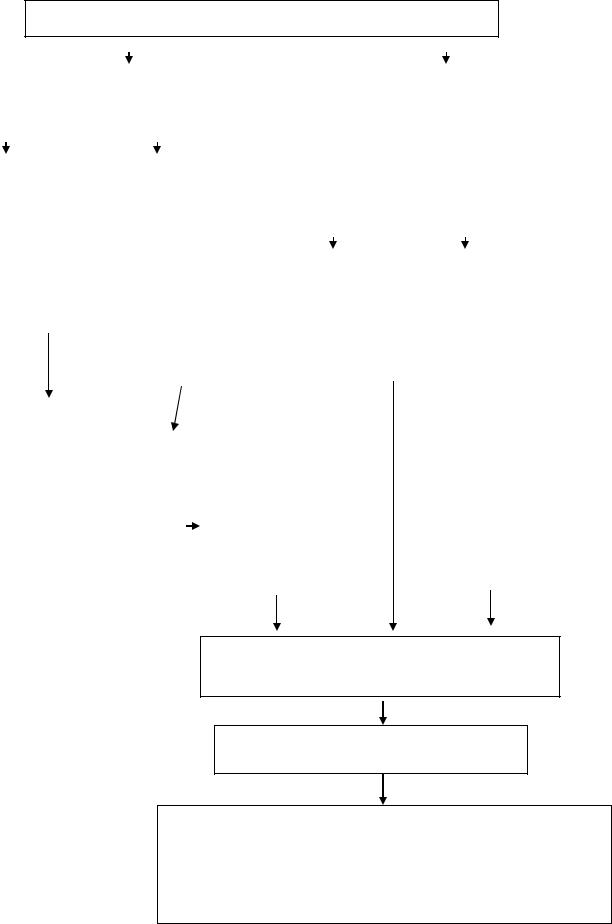
Схема лечения ХМЛ
Ранняя хроническая стадия ХМЛ
Есть HLA-совместный |
|
|
|
Нет HLA-совместного |
|
родственник |
|
|
|
родственника |
|
|
|
|
|
|
|
|
|
Молодой |
|
|
Пожилой |
|
|
Лечение Hydrea, затем IFN-α + |
||||||||||
|
|
больной |
|
|
больной |
|
|
|
Ara-С (или STI 571) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Аллогенная |
|
|
|
|
Цитогенетический |
|
Нет |
цитогене- |
|
|||||||
|
|
трансплантация |
|
|
|
|
ответ в течение 12 |
|
тического ответа |
|
||||||||
|
|
|
|
|
|
|
|
|
|
мес - менее 50% |
|
в течение 12 мес. |
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Rh+-клеток в |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
костном мозге |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Увеличение |
|
|
|
|
Поздняя |
|
||
|
Продолжения лечения, пока |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
сохраняется данный эффект. |
|
|
числа Rh+- |
|
|
|
|
хроническая |
|
||||||||
Консервирование костного мозга |
|
|
клеток в |
|
|
|
стадия (более |
|
||||||||||
при числе Rh+-клеток в костном |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
костном |
|
|
|
|
года), стадия |
|
|
|||||||||
|
|
мозге менее 25% |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
акселерации |
|
|
|||
|
|
|
|
|
|
|
|
|
|
мозге более |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
50% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аллогенная трансплантация от HLA – совместимого родственника
При невозможности
Продолжение лечения Hydrea, IFN- α? Ara-С. новые лекарственные средства. Трансплантация от HLAсовместимого неродственного донора. Аутотрансплантация после интенсивной терапии.
Критерии ответа на терапию при ХМЛ
Гематологическая |
Количество |
Спленомегалия |
|
Тромбоциты |
ремиссия |
лейкоцитов |
|
|
|
|
|
|
|
|
Полная |
< 9×109/л, |
Отсутствует |
|
< 350×109/л |
|
нормализация |
|
|
|
|
формулы |
|
|
|
|
|
|
|
|
Частичная |
≤ 20×109/л, единичные |
Персистирование |
|
< 450×109/л |
|
миелоциты |
|
|
|
|
|
|
|
|
Отсутствие ответа |
20×109/л, |
Спленомегалия |
|
≥ 450×109/л |
|
миелоцитарный сдвиг |
|
|
|
|
>3% |
|
|
|
|
|
|
|
|
Цитогенетический |
% Ph+- клеток в костном мозге |
|
||
ответ |
|
|
|
|
|
|
|
||
Полный |
0 |
0 – 34% |
||
|
|
|
|
|
Частичный |
< 35 |
|
|
|
|
|
|
|
|
Минимальный |
35 - 90 |
|
|
|
|
|
|
|
|
Отсутствие |
> 90 |
|
|
|
|
|
|
|
|
Малый цитогенетический ответ- до 75% миелоидных клеток в КМ несут филадельфийскую хромосому.
Большой (полный) цитогенетический ответ :
-частичная цитогенетическая ремиссия- не более 35% клеток несут филадельфийскую хромосому;
-полная цитогенетическая ремиссия- отсутствие в КМ миелоидных клеток, несущих филадельфийскую хромосому.
Большой молекулярный ответ – нет клеток несущих филадельфийскую хромосому и BCR-ABL – транскрипт выявить не удается.
Прогноз при ХМЛ.
Неблагоприятные прогностические признаки ХМЛ:
Возраст > 60 лет;
Симптомы интоксикации (слабость, потливость, потеря веса);
Гепатомегалия > 4 см;
Спленомегалия 5 см;
Анемия 100 г/л;
Увеличение количества бластов в крови 3%, костном мозге 5%;
Увеличение количества базофилов в крови 7%;
