Сосудистая хирургия часть 1
.pdf
Глава 41
Чрескожные вмешательства при поражении артерий аорто-подвздошного сегмента
Эдвард Б. Дитрих
В предыдущем издании этой книги 1995 г. приведено следующее |
|
положение в отношении чрескожных вмешательств на аорто-под- |
|
вздошном сегменте: «Без сомнения, начало следующего века оз- |
|
наменуется становлением новой узкой специальности — эндова- |
|
скулярной хирургии, а в отношении периферических сосудов почти |
|
в каждом сосудистом бассейне предпочтение будет отдаваться эн- |
|
доваскулярному подходу». Это предсказание не только сбылось. |
|
Благодаря совершенствованию эндоваскулярных методов лече- |
|
ния, они становятся все менее и менее инвазивными. В настоящее |
|
время, как ожидалось, эндоваскулярные вмешательства демонст- |
|
рируют большие возможности практически в любом артериаль- |
|
ном бассейне от коры головного мозга до тыла стопы. Не каждое |
|
вмешательство или техника могут похвастаться подобным успе- |
|
хом, но возможности методов в некоторых сосудистых бассей- |
|
нах находятся в стадии изучения. Этот прогресс связан с изряд- |
|
ным количеством существующих противоречий и разногласий. В |
|
свое время установка первого стента Palmas в подвздошную арте- |
|
рию вызывала не меньше нападок, чем в настоящее время вызы- |
|
вает стентирование бифуркации сонных артерий. Однако уже че- |
|
рез 5 лет ангиопластика и стентирование подвздошных артерий |
|
стали новым золотым стандартом в лечении стенозов этого сег- |
|
мента. Не без оснований можно предположить, что то же самое |
|
произойдет с вмешательствами на сонных артериях. |
|
Однако терапевты до сих пор направляют пациентов с изоли- |
|
рованными поражениями абдоминального отдела аорты и об- |
|
щих подвздошных артерий на аорто-бедренное шунтирование. |
|
Этот традиционный хирургический подход должен использовать- |
|
ся только для ограниченного числа пациентов, которым не подхо- |
|
дит эндолюминальное вмешательство, ставшее сейчас общедос- |
|
тупным (рис. 41.1). Отдаленные результаты эндоваскулярного |
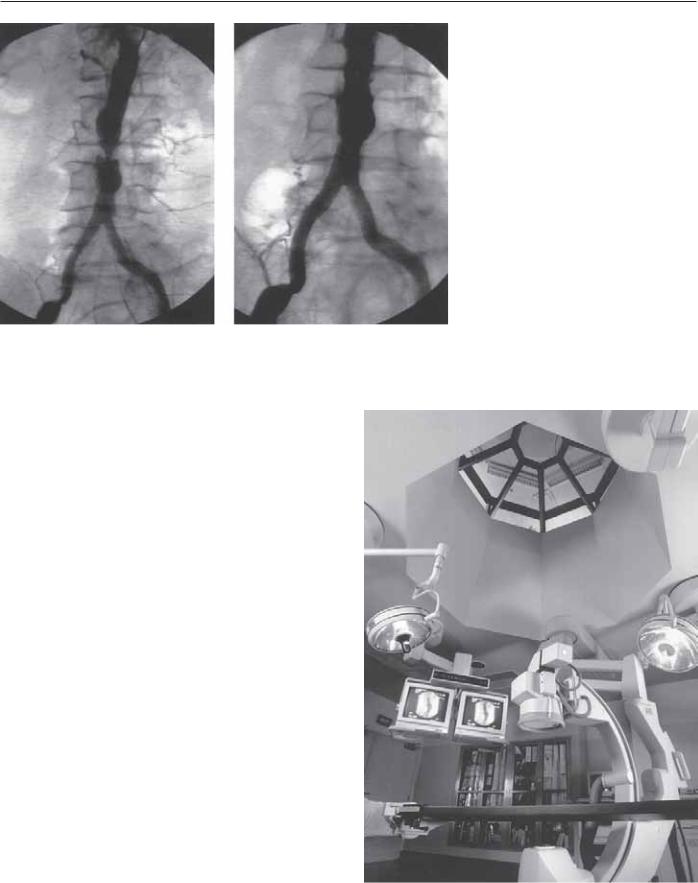
Рис. 41.1. На ангиограмме представлен случай, который, несмо- |
лечения подвздошных артерий впечатляют [1–6] благодаря нали- |
тря на все достижения эндоваскулярной хирургии, лучше ле- |
чию современного медицинского оборудования, позволяющего |
чить классическим аорто-феморальным шунтированием. |
508 Раздел VI. Хронические окклюзии артерий нижних конечностей
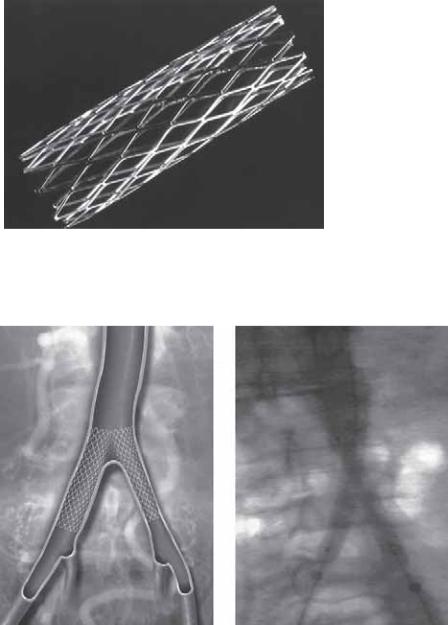
Рис. 41.4. (А) Предоперационная ангиограмма и (Б) контрольная ангиограмма после имплантации Palmaz-стента в случае локального стеноза брюшного отдела аорты. Это одна из первых выполненных процедур такого рода, наглядно продемонстрировавшая возможности стентирования.
А |
|
Б |
|
|
|
В данной главе мы обсудим достижения в лечении поражений аорто-подвздошного сегмента с использованием эндоваскулярных технологий, дадим общее представление о необходимом оборудовании и представим обзор современных методов выбора лечения.
Оборудование
Оснащение операционной
Для выполнения высококачественного чрескожного вмешатель- |
|
ства требуется хорошо оборудованная операционная, что подра- |
|
зумевает наличие рентгеновского аппарата с высокой разрешаю- |
|
щей способностью, делающего возможным успешное выполнение |
|
всего вмешательства. Наибольшей популярностью среди рентген- |
|
хирургов пользуется разборная передвижная рентгенологическая |
|
установка с С-аркой и усиливающим изображение устройством, |
|
соединяющаяся с 3/4-дюймовым записывающим устройством и |
|
монитором для отображения вводимого контраста. Второй мони- |
|
тор с цифровым дисковым накопителем также необходим для об- |
|
работки неподвижного изображения выбранного артериального |
|
сегмента, облегчая выполнение роад-меппинга — функции, не- |
|
обходимой для выполнения сложных процедур ангиопластики. |
|
Существует несколько распространенных во всем мире рент- |
|
геновских установок в различных модификациях, зависящих от |
|
компании-производителя (например, Philips, GE, OEC, Siemens, |
|
Toshiba и др.). Наше отделение оборудовано установкой ISS-2000 |
|
Plus Intraoperative Imaging System, International Syrgical Systems, |
|
Phoenix, AZ (рис. 41.5), которая была спроектирована и усовер- |
|
шенствована под нашим руководством таким образом, чтобы удо- |
|
влетворять всем текущим и возможным потребностям эндоваску- |
|
лярной хирургии. Использование автоматического инжектора |
|
обеспечивает точность и правильность введения контрастного ве- |
Рис. 41.5. Фотография системы интраоперационной визуали- |
щества, что необходимо при длительных вмешательствах и чего |
зации ISS-2000 Plus. Многочисленные преимущества системы, |
сложно достичь при ручном введении. Инжекторы (Medrad, |
фиксированной к потолку, неоднократно демонстрировались |
Indianola, PA) выпускаются в различных конфигурациях, вклю- |
в последние 10 лет. |