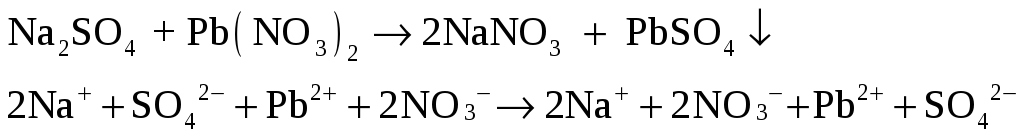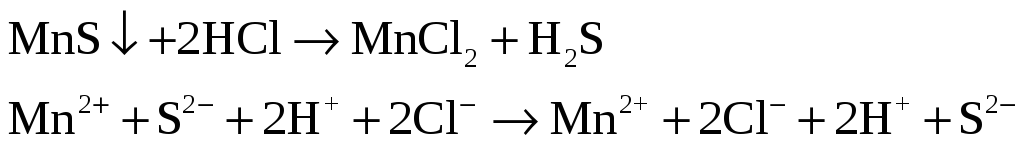Лаба 8 химия
.doc
Приборы и посуда: нагревательные приборы, мерный цилиндр емкостью 20 мл, шпатели, штативы с пробирками, стеклянные палочки.
Реактивы и материалы: оксалат кальция СаС2О4, индикаторная бумага.
Растворы: соляная кислота HCl (2н и 1,18 г/см3); серная кислота H2SO4 (2н) и 1:1 азотная кислота HNO3 (ρ =1,4 г/см3); уксусная кислота СН3СООН (2н); гидроксид натрия NaOH (2н); гидроксид калия –КOH (2н); хлорид калия KCl (насыщ.); ацетат натрия CH3COONa (2н); сульфат натрия Na2 SO4 (2н); сульфид натрия Na2S (1н); хлорид бария BaCl2 (0,5 н и насыщ.); хлорид стронция SrCl2 (0,5н); сульфат стронция SrSO4 (насыщ.); хлорид кальция CaCl2 (0,5н); сульфат кальция CaSO4 (насыщ.); хлорид меди (II) CuCl2 (0,5 н); сульфат цинка ZnSO4 (0,5н); сульфат марганца (II) MnSO4 (0,5 н) ; гидрооксид бария Ba(OH)2 (насыщ.); насыщенный раствор Са(ОН)2 (известковая вода); нитрат свинца (II) Pb(NO3)2 (1н); хромат калия K2CrO4 (1н); хлорид аммония NH4Cl (0,2н).
Опыт 1.
Влияние концентрации ионов на образование и растворение осадков.
В две пробирки налейте насыщенный раствор Са(ОН)2 (известковая вода). В первую пробирку добавьте 2н. раствор NaOH, во вторую – CaCl2.
-
 – реакция не идёт, гидроксид кальция
(малорастворимая щелочь) не взаимодействует
с гидроксидом натрия (растворимая
щелочь).
– реакция не идёт, гидроксид кальция
(малорастворимая щелочь) не взаимодействует
с гидроксидом натрия (растворимая
щелочь). -
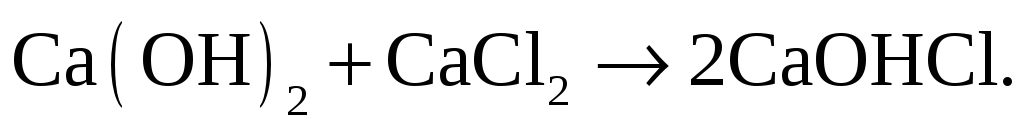
Прилейте в каждую из пробирок раствор HCl, наблюдая за изменениями.
-
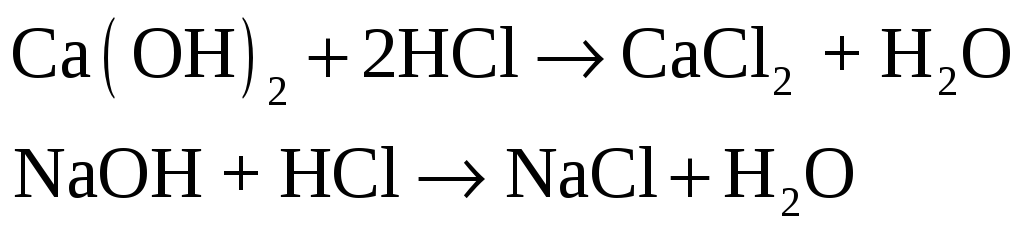 –
помутнение.
–
помутнение. -
 – пузырится.
– пузырится.
Опыт 2.
Ионные реакции с образованием труднорастворимых солей.
Налейте в три пробирки по 2 – 3 мл растворов хлоридов бария, стронция и кальция. В первую пробирку прилейте раствор сульфата натрия, во вторую – насыщенный раствор сульфата кальция, в третью – насыщенный раствор сульфата стронция. Что наблюдается?
-
 – белый осадок.
– белый осадок.
-
 – замутнение.
– замутнение.
-
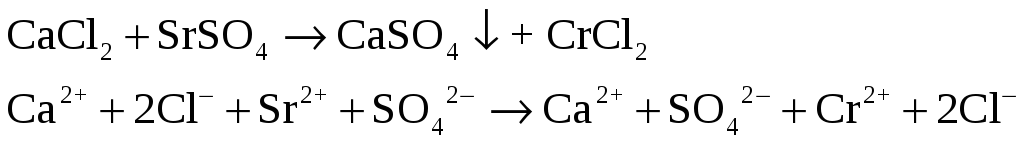 – бледно-белый.
– бледно-белый.
Опыт 3.
Ионные реакции с образованием труднорастворимых солей.
В две пробирки налейте по 1 – 2 мл раствора нитрата свинца (II) Pb(NO3)2. В одну пробирку добавьте такой же объем раствора сульфата натрия, в другую – раствора хромата калия K2CrO4.
-
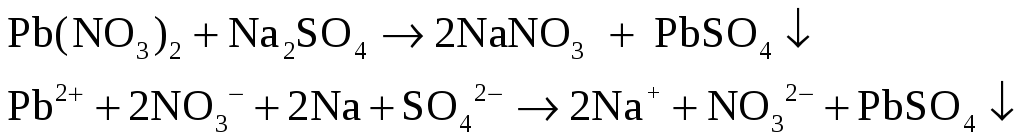 – белый густой
осадок.
– белый густой
осадок.
-
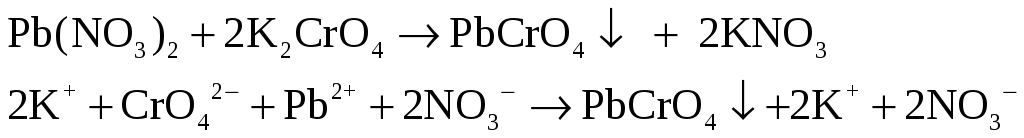 – жёлтый рыхлый
осадок.
– жёлтый рыхлый
осадок.
В третью пробирку налейте по 1 мл растворов сульфата натрия и хромата калия, перемешайте стеклянной палочкой и добавьте немного раствора нитрата свинца.
Опыт 4.
Влияние произведения растворимости сульфидов на их отношение к кислотам.
Получите осадки сульфидов марганца (II) и меди (II). Подействуйте на них 2н раствором HCl.
Опыт 5.
Ионные реакции с образованием слабых электролитов.
-
В пробирку налейте 1 – 2 мл раствора ацетата натрия, добавьте немного серной кислоты (1:1), перемешайте раствор стеклянной палочкой и слегка подогрейте.
Наблюдаем образование летучей слабой
уксусной кислоты
![]() :
:
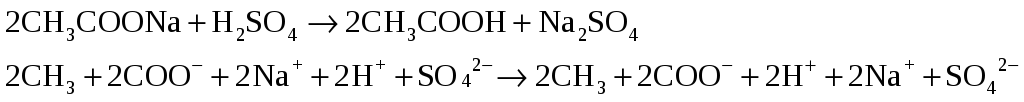 – запах уксуса
– запах уксуса
-
К раствору хлорида аммония добавьте немного раствора гидроксида натрия и осторожно подогрейте раствор.
 –
запах аммиака.
–
запах аммиака.
-
В пробирку внесите немного сухого оксалата кальция СаС2О4 и добавьте соляную кислоту.
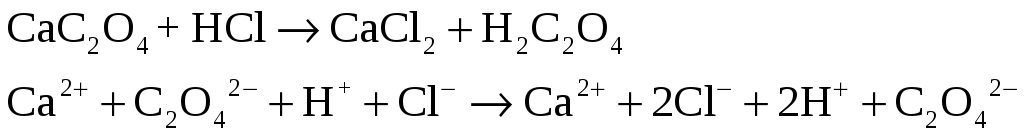
Опыт 6.
Реакции нейтрализации.
-
Взаимодействие сильной кислоты и сильного основания. Налейте в фарфоровую чашку 5 мл 2н. раствора HCl и прибавьте к нему по каплям 2н раствор NaOH. Раствор перемешивайте стеклянной палочкой и определяйте характер его среды, перенося каплю раствора на индикаторную бумагу. Опыт продолжите до получения нейтральной среды раствора. Полученный раствор выпарьте досуха.
 – при выпаривании
получается соль
– при выпаривании
получается соль![]()
-
Взаимодействие слабой кислоты и сильного основания.
Налейте в пробирку 2 мл 2н раствора
щелочи и добавьте одну каплю фенолфталеина
![]() .
Добавляйте по каплям 2н раствор уксусной
кислоты до обесцвечивания раствора.
.
Добавляйте по каплям 2н раствор уксусной
кислоты до обесцвечивания раствора.
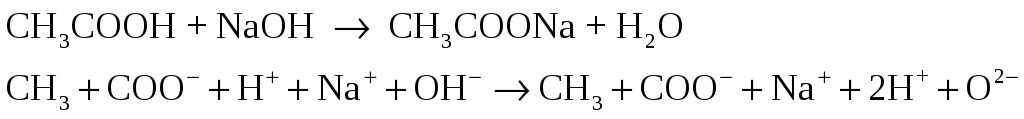 – образуется
ацетат натрия.
– образуется
ацетат натрия.
Опыт 7.
Тепловой эффект реакции нейтрализации.
-
Отмерьте по 20 мл. 2н. растворов NaOH и HCl. Налейте растворы в два стакана и измерьте температуру. Смешайте кислоту со щелочью в одном из стаканов и осторожно перемешайте жидкость термометром.
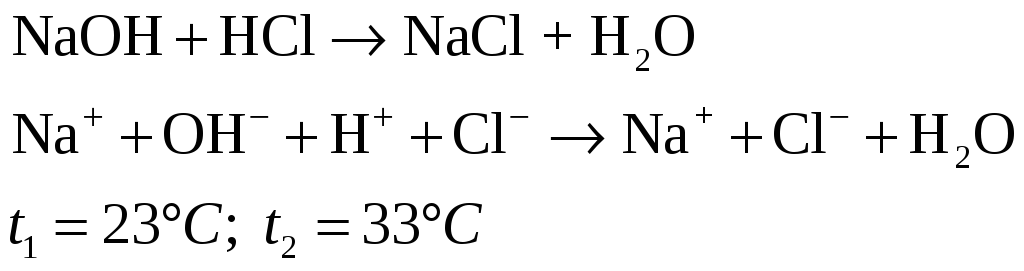
-
Повторите предыдущий опыт, взяв 2н. растворы другой щелочи (например, КОН) и другой сильной кислоты (например, H2SO4).
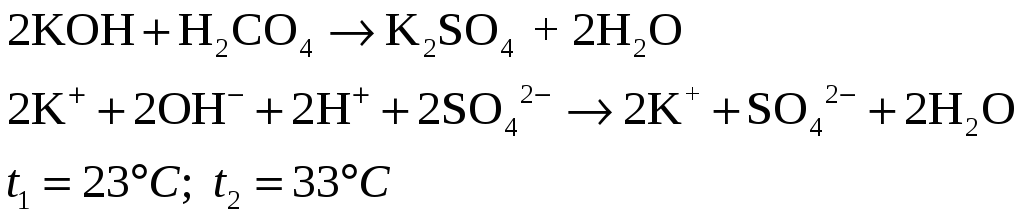
Опыт 8.
Получение и свойства амфотерного гидроксида.
Из имеющихся в лаборатории реактивов получите осадок гидрооксида цинка. Взболтайте полученную суспензию и разделите на две пробирки. В одну из них добавьте раствор HCl, в другую – избыток раствора NaOH.
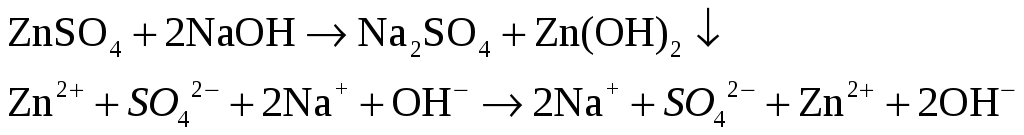
 – густой
светло-белый
осадок.
– густой
светло-белый
осадок.
 –
осадок растворился.
–
осадок растворился.