
Методичка. Молекулярка. термодинамика
.pdfЛАБОРАТОРНАЯ РАБОТА
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Цель работы: Экспериментальное изучение законов Гей-Люссака,
Шарля и Бойля-Мариотта и расчет универсальной газовой постоянной,
коэффициента температурного расширения газа и температурного коэффициента давления газа.
Приборы и принадлежности: универсальная установка Кобра 3,
источник питания, измерительный модуль давления, термопара,
стеклянный кожух, газовый шприц, нагреватель, регулятор мощности,
штатив, зажимы, магнит, магнитная мешалка, мензурка, персональный компьютер и программное обеспечение.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Состояние идеального газа определяется температурой, давлением и количеством вещества. Для некоторых идеальных газов эти параметры состояния объединяются в общее уравнение состояния.
При постоянном объеме изменение параметров газа можно описать с помощью закона Шарля.
При постоянной температуре изменение параметров газа можно описать с помощью закона Бойля-Мариотта.
При постоянном давлении уравнение идеального газа принимает вид закона Гей-Люссака.
Закон Гей-Люссака
Состояние газа зависит от параметров состояния – температуры,
давления и количества вещества. Таким образом, зависимость объема от
151
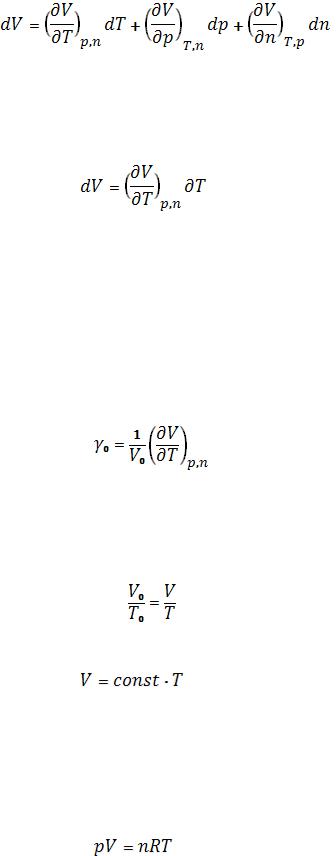
температуры, давления и количества вещества выражается полным дифференциалом:
(1)
Для данного количества вещества (n = const, dn = 0, объем газа в шприце) и изобарного изменения состояния (p = const, dp = 0) данное
соотношение упрощается: |
|
|
|
|
(1.1) |
Коэффициент частного дифференциала |
( V / T ) p,n |
геометрически |
соответствует наклону тангенса для функции V = f(T) и, таким образом,
характеризует зависимость между объемом и температурой. Эта зависимость определяется начальным объемом. Следовательно,
температурным коэффициентом объемного расширения газа 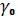 называется степень температурной зависимости объема V или V0 при T = 273,15 K.
называется степень температурной зависимости объема V или V0 при T = 273,15 K.
(2)
При достаточно низком давлении и достаточно высокой температуре интегрирование дифференциального уравнения, выведенного из выражения (1) и (2), где 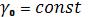 , дает:
, дает:
(3.1)
и
(3.2)
Согласно данному соотношению, установленному Гей-Люссаком, на графике зависимости объема от температуры кривые начинаются с нуля
под разными углами наклона. |
|
Из выражения (2) и закона для идеального газа |
|
, |
(4) |
152 |
|

где R универсальная газовая постоянная, можно получить следующее выражение для вычисления угла наклона данных зависимостей:
(5)
Исходя из этого, температурный коэффициент объемного расширения и значение универсальной газовой постоянной R можно определить
экспериментально при известном начальном объеме V0 и известном количестве вещества n. Количество вещества n равно отношению объема V
и молярной массы Vm.
, |
(6) |
где V0 = 22,414 л/моль при нормальных условиях T0 = 273,15 K и p0 = 1013,25 ГПа.
Следовательно, при нормальных условиях, объем, измеренный при p
и T изменяется следующим образом:
(7)
Закон Шарля
Состояние газа зависит от параметров состояния – температуры,
давления и количества вещества. Таким образом, зависимость объема от температуры, давления и количества вещества выражается полным дифференциалом:
(8)
Для данного количества вещества (n = const, dn = 0, объем газа в шприце) и изохорного изменения состояния (V = const, dV = 0) данное соотношение упрощается:
(8.1)
153
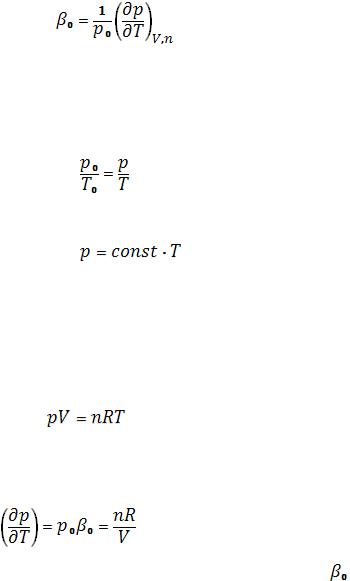
Коэффициент частного дифференциала |
( p / T )V ,n |
геометрически |
соответствует наклону тангенса функции p = f(T) и, таким образом,
характеризует зависимость между давлением и температурой. Степень этой зависимости определяется начальным давлением. Следовательно,
температурным коэффициентом давления газа 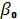 называется степень
называется степень
температурной зависимости давления p или p0 при T = 273,15 K.
(9)
Для случая идеального газа (при нормальном давлении и комнатной
температуре) интегрирование дифференциального уравнения, выведенного из выражения (8) и (9), где 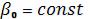 , дает
, дает
(10.1)
и
(10.2)
Согласно данному соотношению, установленному Шарлем, при
графическом представлении зависимости давления от температуры кривые
стремятся вверх при р=0 для Т=0. |
|
Из выражения (9) и закона для идеального газа |
|
, |
(11) |
где R универсальная газовая постоянная, получается следующее |
|
выражение: |
|
|
(12) |
Исходя из этого температурный коэффициент давления газа |
и |
универсальную газовую постоянную R можно определить для данного
начального давления p0 и количества вещества n. Постоянное количество вещества n равно отношению объема V к молярной масс 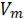
154
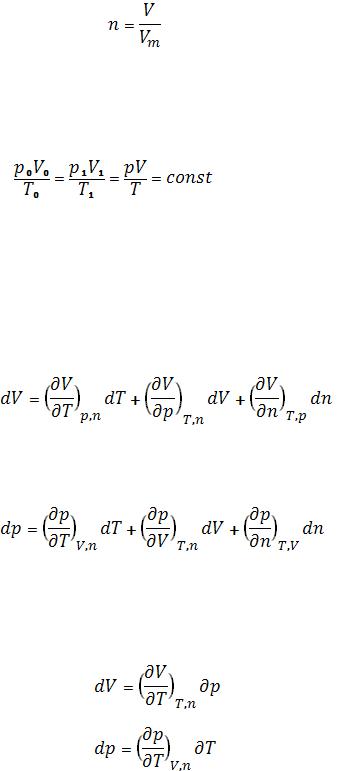
, |
(13) |
где V0 = 22,414 л/моль при нормальных условиях T0 = 273,15Kи p0 =
1013,25 ГПа. Следовательно, объем измеренный при p и T при нормальных условиях изменяется согласно уравнения:
(14)
Закон Бойля-Мариотта
Состояние газа зависит от параметров состояния – температуры,
давления и количества вещества. Таким образом, зависимость объема от температуры, давления и количества вещества выражается полным дифференциалом:
Аналогично при изменении давления справедливо выражение:
Коэффициент частного дифференциала ( V / p)T ,n и
геометрически соответствует наклону тангенса для функции V = f(p) или p = f(V) и, таким образом, характеризует зависимость между давлением и объемом. Эта зависимость определяется начальным объемом или
155
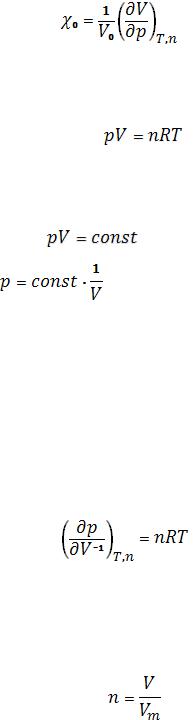
начальным давлением. Следовательно, коэффициент сжатия 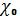 зависящий от объема V или V0 при T = 273,15 K равен:
зависящий от объема V или V0 при T = 273,15 K равен:
(17)
При условиях близких к нормальным отношение между параметрами
p, T, V описывается законом состояния идеального газа:
(18.1)
При постоянном количестве вещества и изотермическом процессе
данное выражение преобразуется в
(18.1)
(18.2)
Согласно данному соотношению, экспериментальным путем полученному Бойлем и Мариоттом, уменьшение давления сопровождается увеличением объема и наоборот. Графиками функций 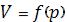 или
или 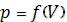 являются гиперболы. Графиками зависимости давления p от обратного объема 1/V являются прямые линии, где p = 0 при 1/V = 0. Из
являются гиперболы. Графиками зависимости давления p от обратного объема 1/V являются прямые линии, где p = 0 при 1/V = 0. Из
соотношения
(19)
можно экспериментальным путем определить газовую постоянную R при данном постоянном количестве воздуха n. Величина n равна отношению объема Vк молярному объему Vm:
(20)
Величина V0 = 22,414 л/моль при нормальных условиях T0 = 273,15K и p0 =
1013,25 ГПа. Следовательно, объем полученный при нормальных условиях изменяется по закону:
156
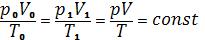
(21)
МЕТОДИКА ЭКСПЕРИМЕНТАЛЬНОГО ИЗУЧЕНИЯ ЗАКОНОВ ГЕЙ-ЛЮССАКА, ШАРЛЯ И БОЙЛЯ-МАРИОТТА
ЗАКОН ГЕЙ-ЛЮССАКА
Соберите экспериментальную установку как показано на рисунке
1. Закрепите газовый шприц (1) в стеклянном кожухе (2), шприц должен обеспечивать герметичность. Через воронку наберите в шприц воды. В резиновой пробке проткните отверстие. Отрегулируйте начальный объем шприца (50 мл) и закройте его выпускное отверстие пробкой. Вставьте термопару (3) во внутреннюю камеру через отверстие в пробке. Убедитесь, что термопара не касается стенки шприца, а расположена в центре. Соедините кремниевую трубку с патрубком (4) верхнего рукава кожуха, чтобы отфильтрованная жидкость, расширяемая при нагреве, могла по трубке попасть в мензурку (операции выполняет инженер лаборатории).
Подключите температурный зонд (5) к выходу измерительного модуля. Запустите программу для измерений и в меню «Gauge» («Устройство») введите «Закон идеального газа». Выберите параметры как показано на рисунке 2. В окне «Start/Stop» («Старт/Стоп») выберите
«Getvalueonkeypress» («Значение с нажатием клавиши»). В окне
«Othersettings» («Другие установки») выберите Digitaldisplay 1 (Цифровой дисплей 1) для «Temperature 1» («Температура 1») и «Diagram 1» («Схема
1») для канала «Temperature T» («Температура T»), в окне «X bounds» («Х-
связи») – «1-15» и в окне «Mode» («Режим») - «noautorange» («вручную»).
Прокалибруйте датчик, выбрав функцию «Calibrate» («Градуирование») и
введя значение температуры, измеренное термометром. Нажмите
«Continue» («Далее»). Расположите дисплеи в удобном порядке.
157

Рис. 1. Экспериментальная установка для изучения закона ГейЛюссака
Рис. 2. Параметры измерения Запишите первое значение при начальной температуре и сохраните
его («Savevalue»), включите нагреватель и постепенно подогревайте кожух. Перемешайте воду в кожухе при помощи магнитной мешалки и отрегулируйте равновесие давления в шприце при помощи плунжера.
После каждого увеличения объема на 1 мл считайте новое значение. После того, как объем газа составил 60 мл, выключите нагревательный аппарат и завершите измерения («Close»). Сохраните результаты измерения (меню
«File» «Savemeasurementsas…»). Для построения графика зависимости
158
температуры от объема в меню подсказок «Measurement» «Channelmanager» («Измерение» «Управление каналами»), выберите температуру по x оси и объем по оси y, а затем по pv/T ось y.
ЗАКОН ШАРЛЯ
Соберите экспериментальную установку как показано на рисунке 3.
Поместите газовый шприц (1) в кожух (2), шприц должен обеспечивать герметичность. Через воронку наберите в шприц воды. Соедините кремниевую трубку с патрубком (3) верхнего рукава кожуха, чтобы жидкость, расширяемая при нагреве, могла по трубке попасть в мензурку.
Отрегулируйте начальный объем в 50 мл, соедините выпускное отверстие шприца с переходником (4) при помощи короткой кремниевой трубки и подсоедините трубку. Соедините переходник с измерительным модулем
(5) при помощи короткой трубки (d = 2 мм). Старайтесь, чтобы соединения были максимально короткими. Подключите измерительный модуль к универсальной установке Кобра 3 (6) при помощи преобразователя и информационного кабеля. Запустите программу для измерений и в меню
«Gauge» введите «Закон идеального газа». Выберите параметры как показано на рис. 4. В окне «Start/Stop» выберите «Get value on key press» .
В окне «Other settings»выберите Digital display 1 для «Pressure p»
(«Давление p»), Digital display 2 для«Temperature» и «Diagram 1» для канала «Pressure p», в окне «X bounds» «1-15» и в окне «Mode» («Режим») -
«no auto range». Прокалибруйте датчик, выбрав функцию «Calibrate» и
введя значение температуры и давления. Нажмите «Continue» («Далее»).
Расположите дисплеи в удобном порядке. Запишите значение давления при начальной температуре и сохраните его («Savevalue»). Включите нагреватель, и постепенно подогревайте кожух. Перемешайте воду в кожухе при помощи магнитной мешалки и отрегулируйте равновесие давления в шприце при помощи плунжера.
159
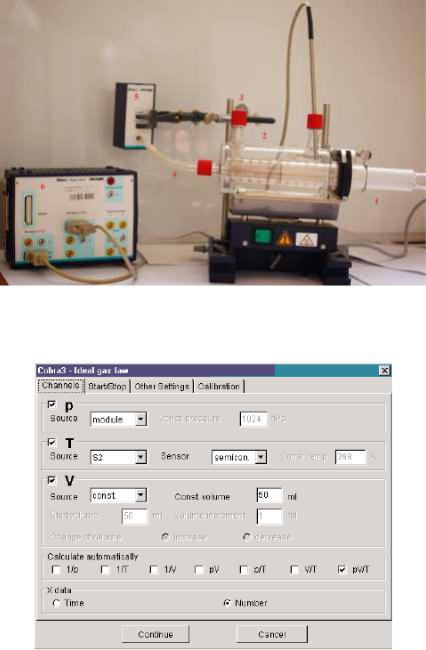
Рис. 3. Экспериментальная установка для изучения закона Шарля
Рис. 4. Параметры измерения
После каждого увеличения температуры на 5 K при помощи плунжера доведите объем в шприце до начального V = 50 мл и считайте следующее значение давления. После достижения температуры 370K или при потере воздуха при сжатии выключите нагреватель и завершите измерения
(«Close»). Сохраните результаты измерения (меню «File» «Savemeasurementsas…»). Для построения графика зависимости давления
160
