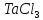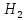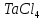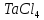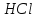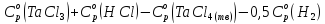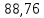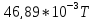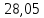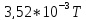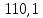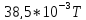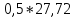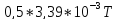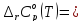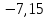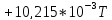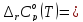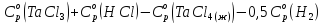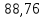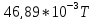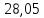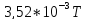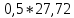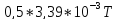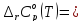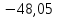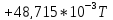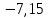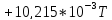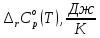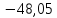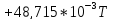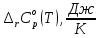Расчет химического равновесия по табличным термодинамическим данным
1. Формулировка задачи
По термодинамическим данным (таблица 1) для реакции (реакция взята из приложения А1)
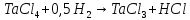 (1)
(1)
в
интервале температур 300-750 К рассчитать
изменения функций
 ,
,
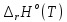 ,
,
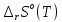 ,
,
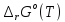 и
и
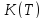 .
Построить графики этих функций с
температурным шагом 50 градусов.
Проанализировать изменение этих
функций при росте температуры. Сделать
заключение о направлении реакции в
расчетном интервале температур.
.
Построить графики этих функций с
температурным шагом 50 градусов.
Проанализировать изменение этих
функций при росте температуры. Сделать
заключение о направлении реакции в
расчетном интервале температур.
2. Составление таблицы термодинамических данных
Из приложения А2 сделать выборку термодинамических данных веществ реакции и поместить их в таблицу 1.
Табличные данные показывают, что в интервале температур 300-750 К происходит плавление твердого тетрахлорида тантала.
При температуре 570 К тетрахлорид тантала плавится. Следовательно, расчету подлежат две химические реакции:
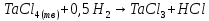 в
интервале 300-570 К; (2)
в
интервале 300-570 К; (2)
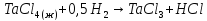 в
интервале 570-750 К. (3)
в
интервале 570-750 К. (3)
3. Расчет изменения теплоемкости
Изменения
теплоемкости
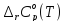 реакций
реакций
Таблица 1-Термодинамические данные веществ реакции (III)
|
Вещество |
Фаза |
|
|
К |
|
Коэффициенты уравнения
|
|||
|
a |
b |
c |
d |
||||||
|
|
тв |
-481,5 |
148,6 |
1300 |
50,2 |
88,76 |
46,89 |
- |
- |
|
|
г |
0 |
130,6 |
- |
- |
27,72 |
3,39 |
- |
- |
|
|
тв |
-586,2 |
196,8 |
570 |
21,8 |
110,1 |
38,5 |
- |
- |
|
|
ж |
- |
- |
1050 |
83,7 |
151 |
- |
- |
- |
|
|
г |
-95,46 |
186,8 |
- |
- |
28,05 |
3,52 |
- |
- |
|
|
|
|||
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(4) |
|
|
|
|||
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(5) |
Сравнение уравнений (4) и (5) показывает, что фазовое превращение одного из веществ, приводит к изменению термодинамической характеристики реакции.
Расчет представим таблицей 2 и графиком (рисунок 1).
Таблица
2 - Расчетные значения
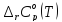 и
и
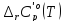 реакции(III)
реакции(III)
|
|
|
|
|
|
300 |
-7,15 |
3,065 |
-4,086 |
|
350 |
-7,15 |
3,575 |
-3,575 |
|
400 |
-7,15 |
4,086 |
-3,064 |
|
450 |
-7,15 |
4,597 |
-2,553 |
|
500 |
-7,15 |
5,108 |
-2,043 |
|
550 |
-7,15 |
5,618 |
-1,532 |
|
570 |
-7,15 |
5,823 |
-1,327 |
Продолжение таблицы 2
|
T, K |
|
|
|
|
570 |
-48,05 |
27,768 |
-20,282 |
|
600 |
-48,05 |
29,229 |
-18,821 |
|
650 |
-48,05 |
31,665 |
-16,385 |
|
700 |
-48,05 |
34,101 |
-13,950 |
|
750 |
-48,05 |
36,536 |
-11,514 |

Рисунок1 - Зависимость изменения теплоемкости реакции(III) от температуры

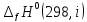
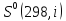
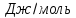 *K
*K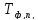
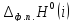
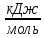
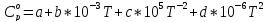
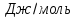 *K
*K