
Биохимия лекции / 1 семестр / Задания / Третичная структура
.docТретичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
-
Водородные связи образуются между двумя полярными незаряженными радикалами или между незаряженным и заряженным радикалами, например, радикалами серина и глутамина:
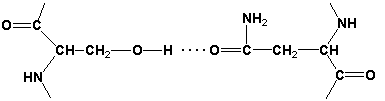
-
Ионные связи могут возникать между противоположно заряженными радикаламинапример, радикалами глутамата и аргинина:

-
Гидрофобные взаимодействия характерны для неполярных радикалов, например, валина и лейцина:

-
Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи:
 .
.
По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
-
Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
-
Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
-
Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К фибриллярным белкам относятся:
-
Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин.
-
Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин.
-
Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин.
