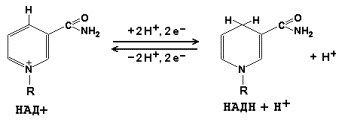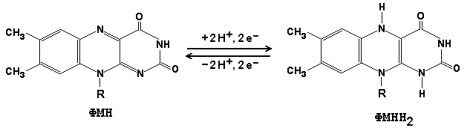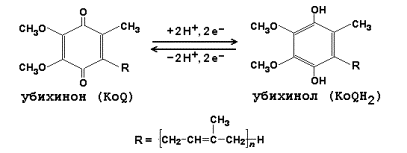Биохимия лекции / 1 семестр / 9 неделя
.docx|
9-я неделя |
Дыхательная цепь и окислительное фосфорилирование. Микросомальное окисление. |
|
|
|
|
Содержание |
Формирование представлений о ферментативных процессах, лежащих в основе синтеза АТФ за счёт энергии, выделяемой при переносе электронов в дыхательной цепи. |
|
|
|
|
Ключевые слова |
аденозиндифосфат, аденозинтрифосфат, акцептор электронов , акцепторный контроль, АТФ-аза, АТФаза Na+, К+-зависимая, АТФ-синтетаза, возбуждение нейронов и мышц, восстановительный потенциал, высокоэнергетическое соединение , гем, гемоглобин, гемопротеин, дегидрирование , донор электронов, дыхание, дыхательная цепь, дыхательный контроль, ингибитор дыхания, ионофоры, катаболизм , киназа , кислородная задолженность, кофермент Q, микросомы , митохондрии , низкоэнергетическое фосфатное соединение, никотинамидадениндинуклеотид, никотинамидадениндинуклеотидфосфат (НАДФ), окислительное фосфорилирование, оксигеназа , оксигеназы со смешанной функцией, ортофосфатное расщепление, отношение Р/О, переносчик электронов, пирофосфатное расщепление, порфирины, протон-движущая сила, разобщающий агент, свободная энергия, участки сопряжения, флавинадениндинуклеотид , флавопротеин, фосфаген, фосфорилирование, фосфорилирование в дыхательной цепи, фосфорилирующий потенциал, фотосинтез, фотосинтетическое фосфорилирование, хемиосмотическое сопряжение, цитохромоксидаза, цитохромы , электрохимический градиент, энергия фосфатной группы |
|
|
|
|
Цели |
После изучения данной темы студент должен знать состав и особенности структуры промежуточных акцепторов электронов в митохондриальной дыхательной цепи, механизмы преобразования энергии, выделяющейся в ходе переноса электронов, в энергию макроэргических связей АТФ и регуляцию этих процессов, уметь применять полученные знания для решения теоретических и практических задач. |
|
|
|
|
План занятия |
|
|
Раздел 9.1 |
Дыхательная цепь и окислительное фосфорилирование. |
|
Раздел 9.2 |
Коэффициент фосфорилирования. |
|
Раздел 9.3 |
Разобщение дыхания и фосфорилирования. |
|
Раздел 9.4 |
Микросомальное окисление. |
|
Раздел 9.5 |
Примеры обучающих задач и методы их решения. |
|
|
|
|
План работы |
|
|
|
Пройдите тест на знание теоретического материала 'Дыхательная цепь и окислительное фосфорилирование (10)' |
|
|
|
|
|
|
|
© С.М.Ершиков, 2009. Все права защищены |
|
|
Раздел 9.1 |
Дыхательная цепь и окислительное фосфорилирование. |
|
|
|
||
|
9.1.1. В пируватдегидрогеназной реакции и в цикле Кребса происходит дегидрирование (окисление) субстратов (пируват, изоцитрат, α-кетоглутарат, сукцинат, малат). В результате этих реакций образуются НАДН и ФАДН2. Эти восстановленные формы коферментов окисляются в митохондриальной дыхательной цепи. Окисление НАДН и ФАДН2, протекающее сопряжённо с синтезом АТФ из АДФ и Н3РО4 называется окислительным фосфорилированием. Схема строения митохондрии показана на рисунке 9.1. Митохондрии представляют собой внутриклеточные органеллы, имеющие две мембраны: наружную (1) и внутреннюю (2). Внутренняя митохондриальная мембрана образует многочисленные складки – кристы (3). Пространство, ограниченное внутренней митохондриальной мембраной, носит название матрикс (4), пространство, ограниченное наружной и внутренней мембранами, - межмембранное пространство (5).
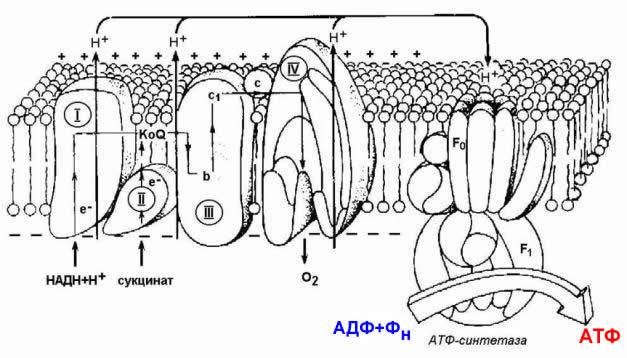
Рисунок 9.1. Схема строения митохондрии. 9.1.2. Дыхательная цепь – последовательная цепь ферментов, осуществляющая перенос ионов водорода и электронов от окисляемых субстратов к молекулярному кислороду – конечному акцептору водорода. В ходе этих реакций выделение энергии происходит постепенно, небольшими порциями, и она может быть аккумулирована в форме АТФ. Локализация ферментов дыхательной цепи – внутренняя митохондриальная мембрана. Дыхательная цепь включает четыре мультиферментных комплекса (рисунок 9.2).
Рисунок 9.2. Ферментные комплексы дыхательной цепи (обозначены участки сопряжения окисления и фосфорилирования): I. НАДН-KoQ-редуктаза (содержит промежуточные акцепторы водорода: флавинмононуклеотид и железосерные белки). II. Сукцинат-KoQ-редуктаза (содержит промежуточные акцепторы водорода: ФАД и железосерные белки). III. KoQН2-цитохром с-редуктаза (содержит акцепторы электронов: цитохромы b и с1, железосерные белки). IV. Цитохром с-оксидаза (содержит акцепторы электронов: цитохромы а и а3, ионы меди Cu2+). 9.1.3. В качестве промежуточных переносчиков электронов выступают убихинон (коэнзим Q) и цитохром с. Убихинон (KoQ) – жирорастворимое витаминоподобное вещество, способен легко диффундировать в гидрофобной фазе внутренней мембраны митохондрий. Биологическая роль коэнзима Q – перенос электронов в дыхательной цепи от флавопротеинов (комплексы I и II) к цитохромам (комплекс III). Цитохром с – сложный белок, хромопротеин, простетическая группа которого – гем – содержит железо с переменной валентностью (Fe3+ в окисленной форме и Fe2+ в восстановленной форме). Цитохром с является водорастворимым соединением и располагается на периферии внутренней митохондриальной мембраны в гидрофильной фазе. Биологическая роль цитохрома с – перенос электронов в дыхательной цепи от комплекса III к комплексу IV. 9.1.4. Промежуточные переносчики электронов в дыхательной цепи расположены в соответствии с их окислительно-восстановительными потенциалами. В этой последовательности способность отдавать электроны (окисляться) убывает, а способность присоединять электроны (восстанавливаться) возрастает. Наибольшей способности отдавать электроны обладает НАДН, наибольшей способностью присоединять электроны – молекулярный кислород. На рисунке 9.3 представлено строение реакционноспособного участка некоторых промежуточных переносчиков протонов и электронов в окисленной и восстановленной форме и их взаимопревращение.
Рисунок 9.3. Взаимопревращения окисленных и восстановленных форм промежуточных переносчиков электронов и протонов. 9.1.5. Механизм синтеза АТФ описывает хемиосмотическая теория (автор - П. Митчелл). Согласно этой теории, компоненты дыхательной цепи, расположенные во внутренней митохондриальной мембране, в ходе переноса электронов могут «захватывать» протоны из матрикса митохондрий и передавать их в межмембранное пространство. При этом наружная поверхность внутренней мембраны приобретает положительный заряд, а внутренняя – отрицательный, т.е. создаётся градиент концентрации протонов с более кислым значением рН снаружи. Так возникает трансмембранный потенциал (ΔµН+). Существует три участка дыхательной цепи, на которых он образуется. Эти участки соответствуют I, III и IV комплексам цепи переноса электронов (рисунок 9.4).
Рисунок 9.4. Расположение ферментов дыхательной цепи и АТФ-синтетазы во внутренней мембране митохондрий. Протоны, выведенные в межмембранное пространство за счёт энергии переноса электронов, снова переходят в митохондриальный матрикс. Этот процесс осуществляется ферментом Н+-зависимой АТФ-синтетазой (Н+-АТФ-азой). Фермент состоит из двух частей (см. рисунок 9.4): водорастворимой каталитической части (F1) и погружённого в мембрану протонного канала (F0). Переход ионов Н+ из области с более высокой в область с более низкой их концентрацией сопровождается выделением свободной энергии, за счёт которой синтезируется АТФ.
9.1.6. Энергия, аккумулированная в форме АТФ, используется в организме для обеспечения разнообразных биохимических и физиологических процессов. Запомните основные примеры использования энергии АТФ: 1) синтез сложных химических веществ из более простых (реакции анаболизма); 2) сокращение мышц (механическая работа); 3) образование трансмембранных биопотенциалов; 4) активный транспорт веществ через биологические мембраны. |
||
|
© С.М.Ершиков, 2009. Все права защищены |
||
|
Раздел 9.2 |
Коэффициент фосфорилирования. |
|
|
|
||
|
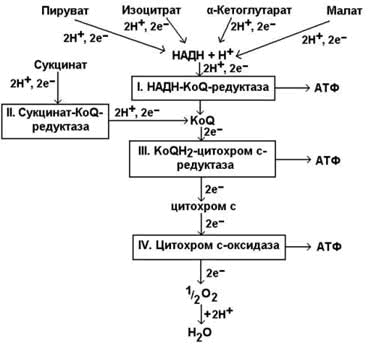
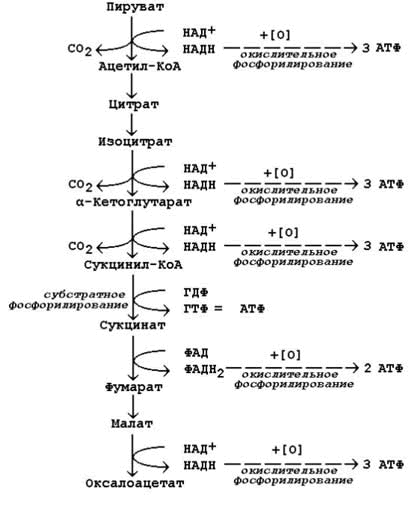
9.2.1. Степень сопряжённости окисления и фосфорилирования в митохондриях характеризует коэффициент фосфорилирования (Р/О). Он равен отношению количества молекул неорганического фосфата (Н3РО4), перешедшего в АТФ, к количеству атомов потреблённого кислорода (О2). Например, если донором водорода для дыхательной цепи является молекула НАДН, то электроны от донора (НАДН) к акцептору (кислород) проходят 3 участка сопряжения окисления и фосфорилирования (I, III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 3 молекулы АТФ (3 АДФ + 3 Н3РО4 → 3 АТФ). Затрачивается 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 3/1 = 3. Если донором водорода будет молекула ФАДН2, то электроны в дыхательной цепи проходят 2 участка сопряжения окисления и фосфорилирования (III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 2 молекулы АТФ (2 АДФ + 2 Н3РО4 → 2 АТФ). Затрачивается, как и в предыдущем случае, 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 2/1 = 2. 9.2.2. Более сложный пример расчёта коэффициента фосфорилирования – при окислении пирувата до конечных продуктов - показан на рисунке 9.5. В этом метаболическом пути происходит дегидрирование 4 субстратов (пирувата, изоцитрата, α-кетоглутарата и малата) с образованием НАДН и одного субстрата (сукцината) с образованием ФАДН2. Восстановленные коферменты окисляются в дыхательной цепи, и в сопряжённых реакциях фосфорилирования образуется (4×3 АТФ + 1×2 АТФ)=14 молекул АТФ. Ещё 1 молекула АТФ (ГТФ) образуется в реакции субстратного фосфорилирования на уровне сукцинил-КоА. Таким образом, при полном окислении 1 молекулы пирувата образуется 15 молекул АТФ (из них 14 - путём окислительного фосфорилирования). Чтобы рассчитать количество потреблённого кислорода, нужно знать число реакций дегидрирования на данном участке метаболического пути. Для окисления каждой восстановленной формы кофермента необходим 1 атом кислорода (см. выше). Следовательно, в нашем примере потребляется 5 атомов кислорода. Значение коэффициента Р/О будет равно 14/5 = 2,8.
Рисунок 9.5. Расчёт энергетического баланса реакций окислительного декарбоксилирования пирувата и цикла Кребса.
|
||
|
© С.М.Ершиков, 2009. Все права защищены |
||
|
Раздел 9.3 |
Разобщение дыхания и фосфорилирования. |
||
|
|
|||
|
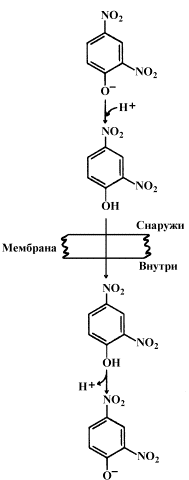
9.3.1. Перенос электронов в дыхательной цепи не во всех случаях протекает сопряжённо с фосфорилированием АДФ. Состояние, при котором окисление субстратов в дыхательной цепи происходит, но АТФ при этом не образуется, называется свободным (нефосфорилирующим) окислением. Энергия, выделяемая при окислении, рассеивается в виде теплоты. В физиологических условиях свободное окисление может служить одним из механизмов терморегуляции. В организме человека и некоторых животных имеется особая ткань – бурый жир, содержащий митохондрии, приспособленные для выработки теплоты. Много бурого жира у новорождённых, в последующие периоды жизни его количество уменьшается. В митохондриях бурого жира содержание дыхательных ферментов значительно выше, чем ферментов, осуществляющих фосфорилирование АДФ, поэтому в них преобладают процессы свободного окисления. Разобщение процессов окисления и фосфорилирования в митохондриях может иметь место при некоторых патологических состояниях. Основными симптомами таких состояний могут быть быстрая утомляемость, повышенная температура тела, снижение массы тела, несмотря на повышенный аппетит, учащение дыхания и сердцебиения. 9.3.2. Разобщение процессов окисления и фосфорилирования может быть вызвано действием ряда веществ, как природных, так и синтетических. Механизм действия этих веществ заключается в том, что они являются переносчиками протонов через мембрану. Вещества, разобщающие окисление и фосфорилирование, можно разделить на протонофоры и ионофоры. Протонофоры представляют собой слабые гидрофобные органические кислоты, которые в форме аниона (R-COO-) связывают протоны в межмембранном пространстве, диффундируют через мембрану и диссоциируют в матриксе с образованием протонов. К этой группе относятся, например, свободные жирные кислоты, гормоны щитовидной железы, салицилаты, дикумарол, 2,4-динитрофенол (см. рисунок 9.6).
Рисунок 9.6. Механизм действия 2,4-динитрофенола. Ионофоры (валиномицин, нигерицин, грамицидин) способны встраиваться в мембрану, образуя канал, по которому могут перемещаться протоны и другие одновалентные катионы - Na+ или K+ (рисунок 9.7). В результате снимается протонный потенциал и нарушается синтез АТФ.
Рисунок 9.7. Валиномицин облегчает проникновение в клетку ионов Н+.
|
|||
|
© С.М.Ершиков, 2009. Все права защищены |
|||
|
Раздел 9.4 |
Микросомальное окисление. |
||
|
|
|||
|
9.4.1. Микросомальное окисление является одним из этапов биотрансформации – обезвреживания неполярных (нерастворимых в воде) соединений как эндогенного происхождения, так и чужеродных для организма (ксенобиотиков). Эндогенные субстраты - холестерол, стероидные гормоны, ненасыщенные жирные кислоты, витамин D3. Экзогенные субстраты - лекарственные вещества. В результате окисления субстратов повышается их растворимость в воде, скорость выведения из организма. Биотрансформация лекарственных веществ, как правило, снижает их токсичность. 9.4.2. Ферментная система микросомального окисления встроена в мембраны эндоплазматического ретикулума клетки (ЭПР, рисунок 9.8).
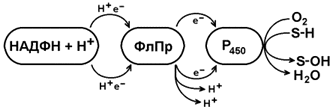
Рисунок 9.8. Структура эндоплазматического ретикулума (источник: Альбертс Б. и соавт., Молекулярная биология клетки, 1994). Она представляет собой короткую цепь переноса водорода и включает несколько последовательно расположенных в мембране белков-ферментов (рисунок 9.9).
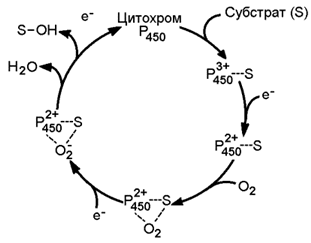
Рисунок 9.9. Схема монооксигеназной цепи окисления ЭПР. Источником электронов и протонов в этой цепи является восстановленный кофермент НАДФН, который образуется в реакциях пентозофосфатного пути окисления глюкозы. Промежуточным акцептором Н+ и е— служит флавопротеин (ФлПр), содержащий кофермент ФАД. Конечное звено в цепи микросомального окисления - цитохром Р450. Это - сложный белок, хромопротеин, в качестве простетической группы содержит гем. Цитохром Р450 является монооксигеназой, то есть ферментом, включающим один из атомов молекулярного кислорода в окисляемое вещество. Поэтому цепь реакций микросомального окисления называют также монооксигеназной цепью. Цитохром Р450 выполняет две функции. Он связывает окисляемый субстрат и активирует молекулярный кислород, облегчая их взаимодействие друг с другом. Реакция, катализируемая цитохромом Р450, называется реакцией гидроксилирования, так как образующийся продукт содержит ОН-группу (рисунок 9.10).
Рисунок 9.10. Механизм реакции гидроксилирования субстрата при участии цитохрома Р450. В отличие от митохондриальной дыхательной цепи, при переносе электронов в монооксигеназной цепи не происходит аккумулирования энергии в виде АТФ. Поэтому микросомальное окисление является свободным окислением. 9.4.3. Основные факторы, влияющие на активность монооксигеназной системы печени, которые следует учитывать при выборе дозировки лекарственных веществ: а) возраст – в детском возрасте и у пожилых людей активность ферментов микросомального окисления ниже, чем у людей среднего возраста; б) пол – мужские половые гормоны повышают скорость реакций гидроксилирования субстратов в печени, женские половые гормоны, наоборот, понижают; в) характер питания – при недостаточном поступлении белков с пищей в печени снижается синтез ферментов, участвующих в микросомальном окислении; г) влияние лекарственных веществ и ядов – некоторые лекарственные препараты (например, фенобарбитал и другие барбитураты, некоторые антибиотики) являются индукторами микросомального окисления и ускоряют процессы гидроксилирования субстратов; другие вещества (угарный газ СО, амизил, дезипрамил) снижают скорость микросомального окисления. |
|||
|
© С.М.Ершиков, 2009. Все права защищены |
|||
|
Раздел 9.5 |
Примеры обучающих задач и методы их решения. |
||
|
|
|||
|
Вопросы для повторения. 1. Что называют дыхательной цепью? Перечислите основные ферментные комплексы дыхательной цепи, укажите их локализацию в клетке. 2. Перечислите переносчики электронов и протонов от субстратов к кислороду. Какое свойство определяет последовательность их расположения в дыхательной цепи? 3. Напишите реакционноспособный участок молекулы НАД в окисленной и восстановленной форме. Какие субстраты могут служить донорами Н+ и е— в реакции восстановления НАД? 4. Напишите реакционноспособный участок молекулы ФАД в окисленной и восстановленной форме. Какой субстрат ЦТК служит донором Н+ и е— в реакции восстановления ФАД? 5. Напишите реакционноспособный участок молекулы ФМН в окисленной и восстановленной форме. Какой переносчик служит донором Н+ и е— в реакции восстановления ФМН? 6. Напишите реакционноспособный участок молекулы KoQ в окисленной и восстановленной форме. Укажите функцию KoQ в дыхательной цепи. 7. Укажите особенности структуры и функции цитохромов, входящих в состав митохондриальной дыхательной цепи и последовательность их участия в реакциях. 8. Что такое трансмембранный протонный потенциал? Как и в каких участках дыхательной цепи он образуется? Какова его роль в клетке? 9. Дайте определение понятия «окислительное фосфорилирование», укажите его локализацию в клетке. Какой фермент завершает этот процесс? 10. Охарактеризуйте фермент, катализирующий синтез АТФ из АДФ и фосфата (название, локализация в клетке, состав, функции). 11. Напишите формулу АТФ, укажите её полное название и биологическую роль. Приведите примеры процессов в организме, требующих участия АТФ. 12. Сколько молекул АТФ образуется в ходе превращения молекулы α-кетоглутарата в оксалоацетат? Обоснование представьте в виде схемы. 13. Сколько молекул АТФ образуется в ходе превращения молекулы изоцитрата в сукцинат? Обоснование представьте в виде схемы. 14. Как рассчитывается коэффициент фосфорилирования и что он выражает? Каково его максимальное значение при окислении НАДН и ФАДН2? 15. Чему равен коэффициент фосфорилирования Р/О при окислении сукцината до оксалоацетата? Обоснование представьте в виде схемы. 16. Чему равен коэффициент фосфорилирования Р/О при окислении изоцитрата до сукцинил-КоА? Обоснование представьте в виде схемы. 17. Чему равен коэффициент фосфорилирования Р/О при окислении пирувата до ацетил-КоА? Обоснование представьте в виде схемы. 18. Укажите особенности дыхательной цепи, локализованной в митохондриях бурого жира. Какова биологическая роль бурого жира? 19. Приведите примеры протонофоров. Опишите механизм их влияния на окислительное фосфорилирование. 20. Что понимают под микросомальным окислением? Укажите его внутриклеточную локализацию и биологическую роль.
|
|||
|
© С.М.Ершиков, 2009. Все права защищены |
|||