Интернет-курс Ёршикова С.М. / 6 / 6
.2.doc|
Раздел 6.2 |
Иммобилизованные ферменты и их использование в медицине. |
|
|
|
|
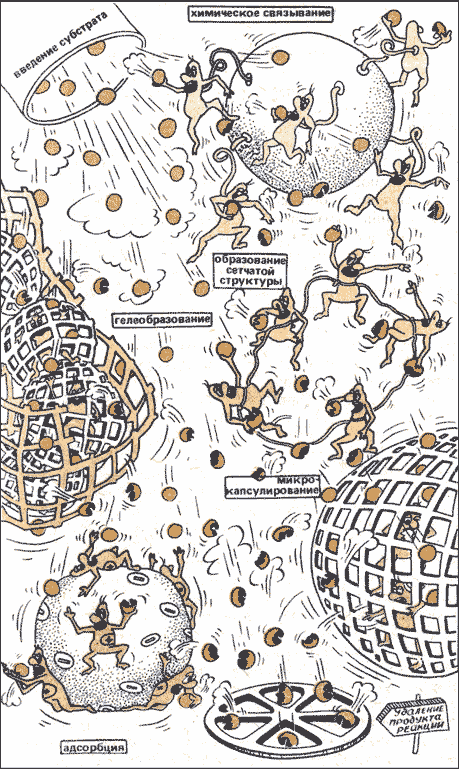
Ферменты — вещества белковой природы и поэтому неустойчивы при хранении, а так же чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому было положено в 1916 году, когда Дж. Нельсон и Е. Гриффин адсорбировали на угле инвертазу и показали , что она сохраняет в таком виде каталитическую активность. Сам термин был «иммобилизованные ферменты» узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве. Иммобилизованные ферменты — это искусственно полученные комплексы фермента с нерастворимым в воде носителем. Иммобилизация (от лат. immobilis - «неподвижный») осуществляется: путем физической адсорбции фермента на нерастворимом материале; включения фермента в ячейки геля; а так же ковалентным связыванием фермента с нерастворимым материалом или молекул фермента между собой с образованием нерастворимых полиферментных комплексов. Преимущества иммобилизованных ферментов перед нативными предшественниками 1. Гетерогенный катализатор легко отделим от реакционной среды, что даёт возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт. 2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость реакции и выход продукта. 3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность, зависимость от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям. 4. Можно регулировать каталитическую активность иммобилизованных ферментов путём изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путём связывания на нерастворимых носителях, так и путём внутримолекулярной и межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путём присоединения к растворимому полимеру. Методы иммобилизации Разработаны многочисленные методы иммобилизации. На рис. 6.4 показаны важнейшие из них. Ферменты могут связываться с носителем химически (ковалентно), а также физически — путем адсорбции или путем закрепления на носителе за счет электростатических взаимодействий. Под действием специальных реагентов молекулы ферментов могут соединяться между собой (образуя «сеть»). Их удается также механически заключать в гели или микрокапсулы. Путем иммобилизации можно повлиять на характерные свойства того или иного фермента, например его активность, стабильность, оптимальную рабочую температуру, оптимальное значение рН, а также способность связываться с субстратом.
Рисунок 6.4. Основные способы получения иммобилизованных ферментов. Ковалентное связывание с активированными полимерами. Иммобилизация ферментов путем их ковалентного связывания с активированными полимерами представляет собой, вероятно. Наиболее широко распространенный метод, т.к. несмотря на его трудоемкость, он позволяет получить иммобилизованный фермент, прочно связанный с полимерным носителем. Сополимеризация с помощью многофункциональных групп. Многофункциональные реагенты можно использовать не только для присоединения молекул фермента к целлюлозе или другим полимерам, но и для связывания молекул фермента друг с другом. К наиболее широко используемым многофункциональным реагентам относится глутаровый альдегид. Гелеобразующее действие альдегидов было отмечено Бэйкером ещё в 1910 году. По существу, это старое наблюдение не утратило своего значения и сегодня. Для того, что бы получить нерастворимую матрицу, состоящую из фермента и глутарового альдегида, необходимо либо заполимеризовать глутаровый альдегид, либо осадить фермент. В результате увеличивается длина связывающей молекулы или уменьшается расстояние между молекулами фермента. Основной недостаток методов такого типа заключается в том, что бифункциональные реагенты часто очень хорошо взаимодействуют с активным центром фермента, тем самым инактивируя его. Однако в тех случаях, когда это удаётся избежать, например, путём обратимого блокирования активного центра, метод даёт хорошие результаты. Физическая адсорбция. Самым старым из применяемых методов иммобилизации ферментов является физическая адсорбция на полимерной матрице без ковалентного связывания. Осуществить такую адсорбцию чрезвычайно просто: адсорбент и фермент в течение некоторого времени перемешивают вместе. Однако выход связанного фермента мал, и при этом фермент частично или полностью инактивируется. Применялось множество различных адсорбентов. Сорбция может происходить с помощью ионных, гидрофобных и водородных связей, а также за счёт вандерваальсовых сил. Недостатком такого метода является то, что обратимая природа связывания фермента с носителем в самый ответственный момент может привести к его десорбции. Одной из причин, часто вызывающих десорбцию фермента, служит добавление субстрата. Это особенно трудно предотвратить, т.к. остальные факторы, способные вызывать десорбцию такие, как изменение рН, температуры, или ионной силы можно контролировать, но ни один фермент не функционирует без своего субстрата. Пространственное разделение. Для пространственного разделения молекулы фермента и свободного раствора можно использовать один из 3 методов:
Важной особенностью первых двух способов заключается в том, что фермент фактически ни к чему не прикрепляется. Благодаря этому отсутствуют стерические помехи, возникающие при ковалентном и электростатическом связывания фермента с полимером. Носители для иммобилизованных ферментов Для получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования:
Схематическая классификация носителей
Для иммобилизации ферментов наиболее широко применяют природные полисахариды и синтетические носители полиметильного типа, остальные применяются значительно реже. Большое значение природных полимеров в качестве носителей для иммобилизации объясняется их доступность, и наличием реакционно-способных функциональных групп, легко вступающих в химические реакции. Характерной особенность этой группы носителей также является их высокая гидрофильность, Недостаток природных полимеров- неустойчивость к воздействию микроорганизмов и довольно высокая стоимость. Наиболее часто для иммобилизации используются такие полисахариды, как целлюлоза, декстран, агароза и их производные. Целлюлоза гидрофильная, имеет много гидроксильных групп, что позволяет модифицировать её, замещая эти группы. Для увеличения механической прочности целлюлозу гранулируют путём частичного гидролиза, в результате чего разрушаются аморфные участки. Гранулированную целлюлозу довольно легко превратить в различные ионообменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д. Особенности использования иммобилизованных ферментов в медицине 1. Наиболее широко и эффективно процессы иммобилизации применяются для создания более стабильных форм, легко разрушающихся и теряющих свою активность медицинских препаратов. Так иммобилизация медицинских ферментов позволяет значительно увеличить сроки их хранения, делает их более устойчивыми к воздействию внутренних сред организма, позволяет сохранить первоначальную активность ферменте в течение продолжительного времени. 2. Успех использования иммобилизованных препаратов в значительной мере определяется правильным выбором носителя для иммобилизации и метода иммобилизации. Иммобилизация лекарственных веществ на различных природных и синтетических полимерах не только повышает гидролитическую способность этих соединений, но и приводит к увеличению эффективности самих лекарств. 3. Разработанные методы иммобилизации биологических активных соединений на неорганических матрицах позволяют проводить процессы модификации ряда хирургических инструментов и аппаратов, а также поверхностей различных эндопротезов, заменяющих работу важнейших органов человека. На основе иммобилизованной уреазы созданы и прошли успешные испытания портативные аппараты искусственной почки. По мнению многих специалистов, на смену эре антибиотиков и гормональных препаратов приходит эра ферментов. Иммобилизованные ферменты успешно используются для удаления различных вредных метаболитов, лечения некоторых злокачественных новообразований. В практической медицине используются различные типы повязок, тампонов с иммобилизованными на их поверхности ферментами, антибиотиками, антисептиками и т.д.. 4. Процессы иммобилизации широко применяются в медицине для аналитических и препаративных целей. С применением иммобилизованных препаратов разработаны более точные и экономические методы массовых клинических анализов для определения глюкозы, молочной кислоты и инсулина в крови, мочевины в сыворотке крови, галактозы в моче, пенициллина в фармацевтических препаратах. |
|
|
© С.М.Ершиков, 2007. Все права защищены |
|