
Тема 2. Метаболизм эритроцита. Свёртывание крови. Кислотно-основное состояние (кос) и его регуляция
Практическая значимость темы. Эритроциты составляют основную массу форменных элементов крови. Метаболизм эритроцита максимально приспособлен для выполнения главной функции этих клеток - транспорта кислорода к тканям. Врождённые дефекты гемоглобина, ферментов гликолиза и пентозофосфатного пути в эритроцитах приводят к нарушениям структуры и функции этих клеток, развитию гемолитической анемии.
Цель занятия. После изучения данной темы студент должен знать: особенности строения и функции молекулярных форм гемоглобина; пути обмена глюкозы в эритроцитах и их биологическую роль; молекулярные основы процессов общего пути свёртывания крови; основные механизмы поддержания КОС крови и лабораторные показатели, используемые для его оценки и их изменение при нарушениях КОС; уметь применять полученные знания при решении теоретических и практических задач.
Исходный уровень знаний.
Строение и биологические функции аминокислот и белков.
Кислотно-основные свойства биологических макромолекул.
Строение и свойства ферментов, обусловленные их белковой природой.
Механизмы регуляции активности ферментов.
Механизмы транспорта веществ через биологические мембраны.
Окислительно-восстановительные реакции и реакции с участием макроэргических соединений в биологических системах.
Принципы диагностики врождённых дефектов ферментов.
2.1. Эритроциты.
Эритроциты - высокоспециализированные клетки, основной функцией которых является транспорт кислорода из лёгких в ткани. Продолжительность жизни эритроцитов составляет в среднем 120 суток; разрушение их происходит в клетках ретикуло-эндотелиальной системы. В отличие от большинства клеток организма, у эритроцита отсутствуют клеточное ядро, рибосомы и митохондрии.
2.1.1. Гемоглобин. Важнейшим белком эритроцитов, выполняющим функцию переноса кислорода и углекислоты, является гемоглобин. Это сложный белок, хромопротеин, состоящий из четырёх полипептидных цепей (2 α и 2 β), каждая из которых в качестве простетической группы содержит гем.

Содержание гемоглобина в крови в норме - 140-160 г/л. Снижение содержания гемоглобина наблюдается при кровопотерях, недостатке в организме железа, витамина B12, фолиевой кислоты.
Гемоглобин - аллостерический белок, его сродство к кислороду может регулироваться. Повышение сродства гемоглобина к кислороду происходит при увеличении концентрации O2, снижении концентрации H+, CO2, 2,3-дифосфоглицерата. Понижение сродства гемоглобина к кислороду происходит при уменьшении концентрации О2, повышении концентрации Н+, СО2, 2,3-дифосфоглицерата.
Известны различные молекулярные формы гемоглобина. Так, в крови плода и новорождённого ребёнка присутствует гемоглобин f (фетальный), который отличается от гемоглобина А (взрослого человека) заменой β-цепей глобина на γ-цепи. Эта замена приводит к тому, что HbF менее эффективно связывает 2,3-дифосфоглицерат. Поэтому эритроциты плода обладают более высоким сродством к кислороду, чем эритроциты матери.
Гемоглобин S отличается от гемоглобина А аминокислотным составом β-цепей глобина (заменой глутаминовой кислоты на валин). При этом снижается растворимость дезоксиформы гемоглобина S в воде и сродство его к кислороду, снижается резистентность (устойчивость) эритроцитов к гемолизу, развивается серповидно-клеточная анемия.
Гликозилированный гемоглобин - продукт неферментативного взаимодействия гемоглобина с глюкозой. Отличается пониженной способностью отдавать кислород в тканях. Содержание гликозилированного гемоглобина повышается в крови при сахарном диабете. Этот показатель отражает уровень глюкозы в крови пациента на протяжении 2-3 предшествовавших месяцев. Поэтому определение гликозилированного гемоглобина в крови используют для контроля эффективности лечения больных диабетом.
От молекулярных форм гемоглобина следует отличать его производные, примером которого является метгемоглобин. Это производное гемоглобина содержит в составе гема трёхвалентное железо. Метгемоглобин образуется под действием окислителей и не способен транспортировать О2. Содержание метгемоглобина в крови возрастает также при дефиците фермента метгемоглобинредуктазы, в эритроцитах (см. 2.1.2). При накоплении метгемоглобина развивается кислородное голодание.
2.1.2. Особенности энергетического обмена в эритроцитах. Основным энергетическим субстратом эритроцита является глюкоза, которая поступает из плазмы крови путём облегчённой диффузии. Около 90% используемой эритроцитом глюкозы подвергается гликолизу (анаэробному окислению) с образованием конечного продукта - молочной кислоты (лактата). Запомните функции, которые выполняет гликолиз в зрелых эритроцитах:
1) в реакциях гликолиза образуется АТФ путём субстратного фосфорилирования. Основное направление использования АТФ в эритроцитах - обеспечение работы Na+,K+-АТФазы. Этот фермент осуществляет транспорт ионов Nа+ из эритроцитов в плазму крови, препятствует накоплению Na+ в эритроцитах и способствует сохранению геометрической формы этих клеток крови (двояковогнутый диск).
2) в реакции дегидрирования глицеральдегид-3-фосфата в гликолизе образуется НАДН. Этот кофермент является кофактором фермента метгемоглобинредуктазы, участвующей в восстановлении метгемоглобина в гемоглобин по следующей схеме:
![]()
Эта реакция препятствует накоплению метгемоглобина в эритроцитах.
3) метаболит гликолиза 1,3-дифосфоглицерат способен при участии фермента дифосфоглицератмутазы в присутствии 3-фосфоглицерата превращаться в 2,3-дифосфоглицерат:

2,3-Дифосфоглицерат принимает участие в регуляции сродства гемоглобина к кислороду (см. 2.1.1). Его содержание в эритроцитах повышается при гипоксии. Гидролиз 2,3-дифосфоглицерата катализирует фермент дифосфоглицератфосфатаза.
Приблизительно 10% глюкозы, потребляемой эритроцитом, используется в пентозофосфатном пути окисления. Реакции этого пути служат основным источником НАДФН для эритроцита. Данный кофермент необходим для перевода окисленного глутатиона (см. 2.1.3) в восстановленную форму. Дефицит ключевого фермента пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназы - сопровождается уменьшением в эритроцитах отношения НАДФН/НАДФ+, увеличением содержания окисленной формы глутатиона и снижением резиcтентности клеток (гемолитическая анемия).
2.1.3. Механизмы обезвреживания активных форм кислорода в эритроцитах. Молекулярный кислород в определённых условиях может превращаться в активные формы, к которым относятся супероксидный анион О2-, пероксид водорода Н2О2, гидроксильный радикал ОН. и синглетный кислород 1О2. Эти формы кислорода обладают высокой реакционной способностью, могут оказывать повреждающее действие на белки и липиды биологических мембран, вызывать разрушение клеток. Чем выше содержание О2, тем больше образуется его активных форм. Поэтому эритроциты, постоянно взаимодействующие с кислородом, содержат эффективные антиоксидантные системы, способные обезвреживать активные метаболиты кислорода.
Важным компонентом антиоксидантных систем является трипептид глутатион, образующийся в эритроцитах в результате взаимодействия γ-глутамилцистеина и глицина:
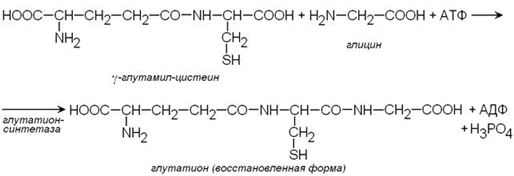
Восстановленная форма глутатиона (сокращённое обозначение Г-SH) участвует в реакциях обезвреживания пероксида водорода и органических пероксидов (R-O-OH). При этом образуются вода и окисленный глутатион (сокращённое обозначение Г-S-S-Г).

Превращение окисленного глутатиона в восстановленный катализирует фермент глутатионредуктаза. Источник водорода - НАДФН (из пентозофосфатного пути, см. 2.1.2):
![]()
В эритроцитах имеются также ферменты супероксиддисмутаза и каталаза, осуществляющие следующие превращения:

Антиоксидантные системы имеют для эритроцитов особое значение, так как в эритроцитах не происходит обновления белков путём синтеза.
