
Методичка_1курс
.pdf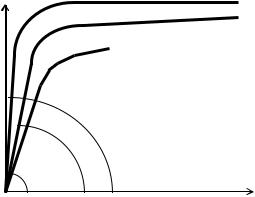
лизаторов А, В и С каталитическая активность убывает, поскольку tgα > tgβ > tgγ (см. рис. 7.8).
A
VO2 В
 С
С
|
|
Рис. 7.8. Зависимость объ- |
|
|
|
ема кислорода VO2 , выде- |
|
|
α |
ляющегося при |
разложе- |
β |
нии Н2О2, от времени при |
||
|
использовании |
разных |
|
|
|
||
γ |
|
катализаторов (А, В, С) |
|
|
|
|
|
0 |
|
τ |
|
Выполнение опыта
1.Ознакомьтесь с устройством газометрической установки (см.
рис. 7.7).
2.Проверьте герметичность установки. Для этого подсоедините реакционную колбу к измерительной части установки, уравнительный сосуд поднимите вверх, создавая тем самым в системе повышенное давление, и наблюдайте за уровнем жидкости в бюретке. Если после первоначального скачка уровень перестает смещаться, установка герметична. Если он постоянно медленно поднимается, установка негерметична и следует найти место утечки и ликвидировать ее.
3.Убедитесь в отсутствии заметного разложения Н2О2 без катализатора при комнатной температуре. Для этого поместите в колбу перемешивающий стержень и налейте в нее с помощью цилиндра 25 мл воды. Поставьте колбу на рабочую поверхность магнитной мешалки (рис. 7.9), включите мешалку, установив тумблер включения вращения в положение «вкл», и, вращая ручку регулирования скорости, добейтесь умеренного перемешивания
121
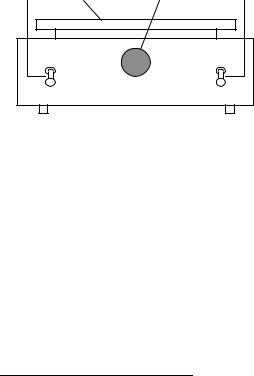
раствора. Затем добавьте в колбу 5 мл раствора Н2О2, соедините колбу с бюреткой и удостоверьтесь, что уровень жидкости в бюретке за 2-3 мин не изменится. Раствор из колбы не выливайте.
4.Научитесь уравнивать давление в системе с атмосферным. Для этого, не отсоединяя колбу, снимите уравнительный сосуд со штатива, поднесите его к бюретке и, перемещая по вертикали, добейтесь совпадения уровней жидкости в бюретке и уравнительном сосуде.
4 |
1 |
3 |
2 |
Рис. |
7.9. Магнитная ме- |
||
|
|
|
|
шалка: |
|
||
|
|
|
|
1 – рабочая поверхность; |
|||
|
|
|
|
2 |
– |
тумблер |
включения |
|
вкл |
|
вкл |
вращения; |
|
||
|
|
|
|
3 |
– |
ручка регулирования |
|
|
нагрев |
|
вращение |
скорости вращения; |
|||
|
|
4 |
– |
тумблер |
включения |
||
|
|
|
|
нагрева |
|
||
5.Изучите влияние указанных преподавателем реагентов на ско-
рость разложения Н2О2. Для этого промойте колбу, поместите в нее перемешивающий стержень, добавьте изучаемый реагент1 и поставьте колбу с реагентом на включенную магнитную мешал-
ку. Затем добавьте 5 мл Н2О2 и сразу подсоедините колбу к бюретке, одновременно включив секундомер. Отметьте положение
уровня жидкости в бюретке (Vτ) при τ = 0; 0,5; 1,0; 2,0 мин, уравнивая при этом давление в системе с атмосферным.
6.Наблюдайте за цветом раствора реагентов при добавлении Н2О2, а в случае использования твердых реагентов – за их количеством. Если цвет раствора изменился, то сразу после завершения измерений, через 2 – 3 мин после начала реакции, перелейте со-
1 Независимо от того, является ли реагент раствором индивидуального вещества или получен в результате смешивания нескольких растворов или твердого вещества и раствора, его суммарный объем во всех опытах должен быть одним и тем же, например 25 мл. В противном случае из-за неодинакового разбавления раствора Н2О2 при смешивании его с реагентом начальная концентрация Н2О2 окажется различной, а, следовательно, результаты опытов будут несопоставимы.
122
держимое колбы в пробирку и оставьте до полного исчезновения пузырьков газа (примерно на 15 – 30 мин). Это необходимо, чтобы выяснить, восстановится ли первоначальный цвет после завершения разложения Н2О2. За время, необходимое для завершения разложения Н2О2, выполните другие опыты.
Оформление опыта
1.Запишите уравнение разложения H2O2, отметьте температуру.
2.Внесите в табл. 7.7 результаты наблюдений и вычислений.
Таблица 7.7
Исходные данные, результаты измерений
|
№ п/п |
|
1 |
2 |
3 |
4 |
|
|
Реагент |
|
- |
|
|
|
|
Положение |
|
τ=0 |
|
|
|
|
|
уровня |
|
|
τ=0,5 мин |
|
|
|
|
Vτ, мл |
|
|
τ=1,0 мин |
|
|
|
|
|
|
|
τ=2,0 мин |
|
|
|
|
Объем |
|
|
τ=0 |
0 |
0 |
0 |
0 |
кислорода |
|
|
τ=0,5 мин |
0 |
|
|
|
VO2 = (Vτ −Vτ=0) , |
|
τ=1,0 мин |
0 |
|
|
|
|
мл |
|
|
|
|
|
|
|
|
|
τ=2,0 мин |
0 |
|
|
|
|
|
|
До смешивания с |
- |
|
|
|
|
|
|
|
H2O2 |
|
|
|
|
Цвет |
|
|
|
|
|
|
|
|
После добавления |
- |
|
|
|
||
реагента |
|
|
Н2О2 |
|
|
|
|
|
|
|
|
|
|
||
|
|
После разложения |
- |
|
|
|
|
|
|
|
Н2О2 |
|
|
|
|
|
|
|
|
|
|
|
|
Наличие реагента |
после окончания |
|
|
|
|
||
реакции (указывается только для твердых |
- |
|
|
|
|||
|
реагентов) |
|
|
|
|
|
|
3.Постройте зависимости VO2 = f(τ) для всех случаев на одном графике.
123
4.На основании зависимостей VO2 =f(τ) отметьте, какие из изученных реагентов ускоряют выделение кислорода.
5.Укажите, какие из реагентов, ускоряющих выделение кислорода, являются катализаторами, а какие – нет. Для этого проверь-
те, совпадают ли цвета реагентов до добавления Н2О2 и после полного прекращения выделения кислорода, а в случае твердых реагентов – присутствуют ли они в системе после завершения реакции. Если это не так, то соответствующие вещества не являются катализаторами.
6.Если выявлено несколько катализаторов, укажите, какой из них обладает наибольшей каталитической активностью, для чего сопоставьте крутизну начальных участков кривых VO2 = f(τ)
(см. рис. 7.8).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Что называется скоростью химической реакции, и от каких факторов она зависит?
2.Что называется энергией активации? Каков диапазон значений энергии активации?
3.Что называется общим и частными порядками реакции? Какие значения они могут принимать?
4.Какие реакции называются простыми и сложными (с точки зрения механизма)? Для каких из них частные порядки обязательно совпадают со стехиометрическими коэффициентами?
5.Что называется катализатором? К каким по механизму реакциям (простым или сложным) относятся каталитические реакции?
124

Р а б о т а 8
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: ознакомление с окислительно-восстано- вительными свойствами элементов и их соединений; освоение методики составления уравнений окислительно-восстанови- тельных реакций (ОВР) и определения направления ОВР.
Приборы и реактивы: стеклянные пластины для капельных реакций; сульфат марганца(II) (0,5 М), гидроксид натрия (0,5 М), дихромат калия (0,1 М), сульфит натрия (0,5 М), серная кислота (1 М), сульфат меди(II) (0,1 М), иодид калия (0,1 М), нитрит натрия (0,5 М), перманганат калия (0,1 М), пероксид водорода (5 %), крахмал (1 %), металлы: цинк, железо, медь.
Окислительно-восстановительные реакции протекают со смещением или полным переходом электронов от одних атомов или ионов к другим, в результате чего изменяются степени окисления элементов. Под степенью окисления понимают
условный заряд атома элемента в соединении, вычисленный в предположении, что все связи ионные, т.е. все электронные пары его химических связей смещены в сторону более электроотрицательного атома. Например, в соединениях
KCl, Cl2, KClO, KСlO2, KСlO3, KСlO4 степени окисления хлора
равны |
соответственно –1, 0, +1, +3, +5, +7 и обозначаются |
||||
−1 |
0 |
+1 |
+3 |
+5 |
+7 |
Cl, Cl, Cl, Cl, Cl, Cl .
Высшая степень окисления элементов обычно соответствует номеру группы. Исключение составляют фтор, кислород, d- элементы первой и восьмой групп, а также f-элементы.
В зависимости от того, находятся ли атомы окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или различных веществах, все ОВР можно разделить на
125
три типа: межмолекулярные, внутримолекулярные и диспро-
порционирования.
Реакции, в которых окислители и восстановители представляют собой разные вещества, называют межмолекулярными. Например, в реакции
Cu + 2FeCl3 → CuCl2 + 2FeCl2
электроны от восстановителя – атома Cu переходят к окислителю – иону Fe3+.
Если окислителями и восстановителями служат атомы или ионы одной и той же молекулы, то такие реакции называют внутримолекулярными. Например, реакции термического разложения
−3 +6 |
0 |
|
+3 |
(NH4)2Cr2O7 |
t |
+ Cr2O3 + 4H2O. |
|
→ N2 |
|||
Реакции диспропорционирования |
протекают с одно- |
||
временным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, отвечающих одной из промежуточных степеней окисления данного элемента:
0 |
−1 |
+1 |
Cl2 + H2O → HCl + HClO |
||
+5 |
+7 |
−1 |
4KClO3 |
t |
|
→ 3KClO4 + KCl. |
||
Окислительно-восстановительные свойства элементов и соединений зависят от их положения в периодической таблице и могут быть оценены на основании таких характеристик, как энергия ионизации I или энергия сродства к электрону Еср. Мерой восстановительной активности (способности терять электроны) является энергия ионизации, а окислительной – энергия сродства к электрону.
Об окислительно-восстановительной активности элементов можно судить также по их относительной электроотрицательно-
126
сти. Восстановителями являются элементы, обладающие низкими значениями энергии ионизации или электроотрицательности, большим радиусом и малым числом электронов на внешнем слое, например s-металлы I и II групп. Окислителями являются элементы с большой электроотрицательностью, малым радиусом и большим числом электронов на внешнем слое, например р-элементы VI и VII групп.
Количественной характеристикой окислительной и восстановительной способности ионов в растворе являются окислитель- но-восстановительные (электродные) потенциалы. Чем ниже электродный потенциал восстановителя, тем выше его восстановительная активность, и, наоборот, чем выше электродный потенциал окислителя, тем выше его окислительная активность. Зависимость значения электродного потенциала Е от активности окисленной и восстановленной форм выражается уравнением
Нернста:
E = E o + |
|
0,059 |
lg |
aок |
, |
|
|
|
|||
|
|
n |
aвос |
||
где Е0 – стандартное |
значение потенциала при aок = aвос= |
||||
= 1 моль/л; aок, aвос − активность окисленной и восстановленной форм вещества; n – число молей электронов, участвующих в процессе окисления или восстановления.
Если в окислительно-восстановительной реакции принимают участие ионы Н+, то потенциал системы зависит в этом случае не только от отношения активностей окисленной и восстановленной форм, но и от активности ионов Н+, которая возводится при этом в соответствующую степень. Так, потенциал системы
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
может быть найден по формуле:
Е = Е0 + |
0.059 lg |
aMnO4− aH8 |
+ |
. |
aMn2+ |
|
|||
|
5 |
|
|
127
В большинстве случаев для ориентировочных расчетов можно использовать стандартные окислительно-восстановительные потенциалы, приведенные в литературе [4].
При составлении уравнений ОВР применяются методы электронного баланса и электронно-ионный.
При использовании метода электронного баланса окисление и восстановление выражают электронными уравнениями, в которых указывают изменение степени окисления атома восстановителя и окислителя, а также число отданных или принятых электронов. Коэффициенты подбирают таким образом, чтобы соблюдался баланс отданных и принятых электронов. Например:
0 |
0 |
+3 −2 |
|
|
|
|
Cr + O2 |
→ Cr2O3 |
|
|
|
|
|
0 |
|
+3 |
|
|
|
|
Cr -3e- |
→ Cr |
|
х 4 |
− окисление |
||
|
||||||
0 |
|
−2 |
|
|
|
|
O2 +4e- |
→ 2O |
|
х 3 |
− восстановление |
||
|
|
|
|
|
||
4Cr + 3O2 → 2Cr2O3 |
|
|
− суммарное уравнение |
|||
Для |
процессов, протекающих с участием ионов, при- |
|||||
меняется электронно-ионный метод. По данному методу составляют уравнения (полуреакции) для окисления и восстановления с последующим суммированием их в общее уравнение. Такие полуреакции приводятся в таблицах стандартных окис- лительно-восстановительных потенциалов [9] и их использование позволяет точнее предсказать продукты реакции. В уравнениях полуреакций реагенты записываются в том виде, в котором они существуют в растворе: либо в виде ионов, либо в виде молекул.
В качестве примера рассмотрим порядок подбора коэффициентов по методу электронно-ионного баланса в уравнении реакции
KMnO4 + Na2SO3 + H2SO4 →
128
Составим уравнения полуреакций для процессов восстановления и окисления:
MnO4− + 8H+ + 5e- → Mn2+ + 4H2O |
|
х2 − восстановление |
|
||
SO32-− + H2O –2e- → SO42- + 2H+ |
|
х5 − окисление |
|
|
|
2MnO4− + 5SO32− + 6H+ → 2Mn2+ + 5SO42− + 3H2O − суммар-
ное ионное уравнение.
Материальный баланс атомов кислорода в левой и правой частях полуреакции достигается за счет участия во взаимодействии ионов H+ (в кислой и нейтральной среде) и молекул H2O. Так, в случае восстановления иона MnO4− в кислой среде избыток атомов кислорода в левой части связывается с катионами H+ в молекулы воды. При окислении иона SO32− недостаток атомов кислорода в левой части пополняется из молекул воды.
Количество электронов, участвующих в каждой полуреакции, определяется на основании равенства суммарных зарядов частиц в левой и правой частях уравнения. Коэффициенты подбирают из условия баланса отданных и принятых электронов.
Молекулярное уравнение составляют на основании суммарного ионного уравнения, для этого к каждому иону дописывают ион с противоположным по знаку зарядом:
2KMnO4+5Na2SO3+3H2SO4→2MnSO4+5Na2SO4+K2SO4+3H2O.
Направление ОВР определяют термодинамическим ме-
тодом. На основании табличных значений |
G0обр рассчитыва- |
ют G0 реакции, и если она меньше нуля ( |
G0 < 0), то реакция |
протекает в прямом направлении. |
|
О направлении ОВР, протекающих в водных растворах
при обычной температуре, можно судить по стандартным
электродным потенциалам окислителя Е0ок и восстановителя Е0вос.
129
П р и м е р. |
|
|
|
|
|
|
|
|
|
|
Cu + 2Fe3+→ Cu2+ + 2Fe2+ |
|
|
|
|
|
|
|
|
||
Fe3+ + e- → Fe2+ |
|
х 2 |
Eоко = Ео 3+ |
/Fe |
2+ |
|
= +0,77 |
B |
||
|
|
|||||||||
Cuо – 2e- → Cu2+ |
|
|
Fe |
|
|
|
|
|
||
|
х 1 |
Eвосо = Ео |
2+ |
/Cu |
o |
= +0,34 |
B |
|||
|
|
|
Cu |
|
|
|
|
|
||
1.Электродвижущая сила реакции EОВР = Е0ок–Е0вос = 0,43B.
2.Энергия Гиббса реакции
G0 = G0обр(Cu2+) + 2 G0обр(Fe2+) – 2 G0обр(Fe3+) = 65,56 + + 2 (-84,88) – 2 (-10,53) = -83,14 кДж.
ОВР идет в прямом направлении, если G0 < 0, а E0ОВР > 0, так как величины эти связаны между собой соотношением:
G0 = - nFEООВР = -96500 nEООВР Дж,
где n – число молей электронов, участвующих в реакции; F = 96500 Кл – число Фарадея.
Следовательно, G0 = - 96500 2 0,43 = - 83000 Дж.
Константа равновесия ОВР связана с ЭДС ОВР соотношением:
|
|
|
|
nFEо |
|
nEо |
|
|
|
lg К = |
ОВР |
= |
ОВР |
, |
|
|
|
2,3RT |
0,059 |
||||
|
|
|
|
|
|
||
где |
0,059 = |
2,3RT |
при T= 298 К. |
|
|||
F |
|
||||||
|
|
|
|
|
|
|
|
ОПЫТ 8.1. ТИПИЧНЫЕ ОКИСЛИТЕЛИ
Типичными окислителями являются:
− простые вещества, атомы которых обладают большой электроотрицательностью и большими значениями окислитель-
но-восстановительных потенциалов Е0ок/вос (p-элементы VI и VII групп, наиболее активны фтор, кислород, хлор);
130
