
Методичка_1курс
.pdfРешение
При сливании растворов Pb(NO3)2 и KI идет обменная реакция:
? |
↓ +2KNO3 |
Pb(NO3 )2 + 2KI →← PbI2 |
Pb2+ + 2I- →?← PbI2 ↓
Малорастворимое соединение PbI2 выпадет в виде осадка, если произведение концентраций ионов свинца и иода в растворе (в соответствующих степенях) окажется больше ПРPbI2 :
ПКPbI2 эксп > ПРPbI2 .
Для проверки этого условия необходимо рассчитать ПКPbI2эксп, сравнить его с табличным значением ПРPbI2 . C этой
целью определим концентрации ионов Pb2+ и I- в растворе.
1. Расчет СPb 2 +эксп .
При сливании растворов нитрата свинца и иодида калия концентрация исходного раствора Pb(NO3 )2 уменьшилась, однако коли-
чество вещества Pb(NO3 )2 в системе не изменилось. Рассчитаем, исходя из этого экспериментальную концентрацию ионов Pb2+:
CPb2+ эксп (VPb(NO3 )2 исх +VKI исх) = CPb2+исх VPb(NO3 )2 исх, CPb2+исх = CPb(NO3 )2 исх = 0,5 моль/л.
Отсюда
C |
Pb |
2+ |
эксп |
= |
CPb2+исх VPb(NO3)2 |
исх |
= |
0,5 5,0 |
= 0,25 моль / л . |
||||||||
V |
Pb(NO3)2 исх |
+V |
KI исх |
10,0 |
|
||||||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2. Расчет СI-эксп . |
|
|
|
|
|
|
|
|
|
|
|||||||
|
CI-эксп = |
|
CI-исх VKI исх |
|
|
= |
0,5 5,0 |
|
= 0,25 моль / л . |
||||||||
|
V |
KI исх |
+V |
Pb(NO3)2 |
исх |
10,0 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
91

Так как KI − сильный электролит, то СI-исх = СK I исх = = 0,5 моль/л.
Используя значения СPb 2 +эксп и СI-эксп , проверим, выполняется ли условие образования осадка PbI2 :
ПКPbI2 эксп = CPb2+эксп СI2-эксп = 0,25 (0,25)2 =1,56 10−2 , ПКPbI2 эксп =1,56 10−2 ; ПРPbI2 = 1,1 10−9.
Так какПКPbI2 эксп > ПРPbI2 , то в данном растворе выпадет осадок иодида свинца PbI2 .
Таким образом, ориентируясь на величину ПР, можно оценить, будет ли образовываться в данной системе осадок, а также насколько исследуемое вещество растворимо в воде, т.е. используя ПР можно определить растворимость вещества.
Растворимость (C , моль/л) – это концентрация вещества в его насыщенном растворе (при T = const).
Так как от растворимости вещества зависит концентрация его ионов в растворе, то величина ПР может быть выражена через растворимость ( C ) и соответственно, наоборот, по ПР можно рассчитать растворимость вещества.
Пример 6.2. Определите растворимость Pb(SCN)2 и концен-
трации ионов Pb2+ и SCN− в насыщенном растворе, если
ПРPb(SCN)2 =2,0 10–5.
Решение
Запишем уравнение гетерогенного равновесия, которое устанавливается в растворе соли Pb(SCN)2 , и выразим через раствори-
мость ( C ) равновесные концентрации ионов соли ([ Pb2+ ], [ SCN− ]):
|
С |
|
→ |
|
|
2+ |
+2SCN |
− |
. |
|
Pb(SCN)2(тв) |
← Pb |
|
|
|
|
|||||
|
|
|
|
|||||||
|
|
|
|
C |
2C |
|
|
|||
равновесные концентрации ионов, моль/л
92
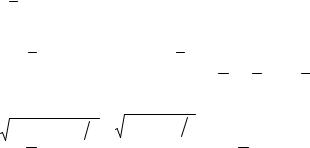
Если C − это то количество Pb(SCN)2, которое растворяется, то оно же полностью распадается на ионы. В этом случае равновесные концентрации ионов соли будут равны:
[ Pb2+ ] = C , моль/л; [ SCN− ] = 2 C , моль/л.
Тогда ПРPb(SCN)2 = [Pb2+ ] [SCN - ]2 = C (2C )2 = 4C 3 .
Отсюда растворимость и концентрации ионов соли в растворе:
|
|
= 3 ПР |
|
4 = 3 |
2,0 10−5 |
4 =1,71 10−2 |
моль / л; |
C |
Pb(SCN)2 |
||||||
|
|
|
|
|
|
|
[Pb2+ ] = C = 1,71 10−2 моль / л; [SCN− ] = 2C = 3,42 10−2 моль / л.
Используя величину растворимости, можно предсказать, будет ли происходить переосаждение одного малорастворимого соединения в другое при добавлении соответствующего реагента. Как правило, самопроизвольно процессы идут в направлении образования вещества с меньшей растворимостью.
Пример 6.3. Определите, произойдет ли переосаждение, если к 1 мл насыщенного раствора с осадком PbCrO4 прилили 0,5 мл
0,2 М раствора KSCN . ПРPbCrO4 =4,8 10–10. ПРPb(SCN)2 =2,0 10–5.
Решение
PbCrO 2KSCN ? Pb(SCN) K CrO
4 ↓ + →← 2 ↓ + 2 4
насыщеный раствор с осадком
Переосаждение, т.е. превращение исходного осадка PbCrO4 в новое малорастворимое вещество Pb(SCN)2 , произойдет, если в системе созданы условия для образования этого нового осадка. Для проверки условия образования осадка Pb(SCN)2 рассчитаем экспе-
риментальные концентрации ионов Pb2+ и SCN− в исследуемой системе.
93
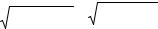
1. |
Расчет СPb 2 +эксп . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Так как ионы свинца |
Pb2+ |
образуются в растворе за счет рас- |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
|
→ |
|
|
2+ |
2− |
|
||||
творения и диссоциации соли: |
Pb Cr O4 |
|
|
|
, |
|||||||||||||||||||||||
(тв) ← Pb |
|
|
+ CrO 4 |
|
||||||||||||||||||||||||
|
|
|
|
|
|
= [Pb2+ ] = |
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|||||
то C |
|
|
|
|
|
|
|
. Следовательно, |
|
|
|
|
|
|
|
|||||||||||||
Pb |
2+ |
эксп |
C |
PbCrO4 |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ПРPbCrO4 = [Pb2+ ] [CrO42−] = |
|
2 , |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
C |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
= |
ПРPbCrO4 = |
4,8 10−10 = 2,2 10−5 |
моль/л, |
|
|
|
||||||||||||||||||||
C |
|
|
|
|||||||||||||||||||||||||
CPb2+эксп = |
|
|
PbCrO4 = 2,2 10−5 моль/л. |
|
|
|
|
|
|
|
|
|||||||||||||||||
C |
|
|
|
|
|
|
|
|
||||||||||||||||||||
2. |
Расчет |
С |
- |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
SCN эксп |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
C |
|
|
V |
|
|
0,2 |
0,5 |
|
|
|
||||||||
CSCN-эксп |
= |
|
SCN- исх |
KSCN исх |
|
= |
=0,66 |
моль/л, |
||||||||||||||||||||
V |
KSCN исх |
+V |
|
|
|
|
|
|
1,5 |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
PbCrO4 насыщ |
|
|
|
|
|
|
|
|
||||||||||
CSCN-исх = CKSCN исх = 0,2 моль/л, так как |
KSCN − сильный |
|||||||||||||||||||||||||||
электролит.
3. Проверка условия образования осадкаPb(SCN)2 .
ПКPb(SCN)2 эксп = CPb2+эксп СSCN2 -эксп =
= 2,2 10−5 (0,66)2 = 2,0 10−6 ,
ПКPb(SCN)2 эксп = 2,0 10−6 ; ПРPb(SCN)2 = 2,0 10−5.
Так как ПКPb(SCN)2 эксп ПРPb(SCN)2 , то осадок Pb(SCN)2 не
может образоваться в данном растворе, и, следовательно, переосаждение не произойдет:
PbCrO4 ↓ +2KSCN→/ Pb(SCN)2 ↓ +K2CrO4.
94
Выполнение опыта
Получение малорастворимых соединений свинца
В три пробирки из бюретки налейте по 0,5 мл 0,1 М Pb(NO3 )2 .
Затем в первую пробирку прилейте 0,5 мл 0,01 М раствора KSCN , во вторую − 0,5 мл 0,2 М раствора KSCN , в третью − 0,5 мл 0,2 М раствора KI . В четвертую пробирку налейте 0,6 мл 0,1 М раствора Pb(NO3 )2 , а затем добавьте туда же 0,4 мл 0,1 М раствора
Na3PO4 . Отметьте цвета осадков, пробирки с осадками сохраните
для следующего опыта, запомнив, в какой пробирке какое малорастворимое вещество находится.
Переосаждение малорастворимых соединений свинца
К пробиркам с осадками тиоцианата свинца Pb(SCN)2 и ортофосфата свинца Pb3 (PO4 ) 2 прилейте по 0,5 мл 0,2 М раствора иодида калия KI. Пробирку с осадком иодида свинца PbI2 оставь-
те для сравнения. Отметьте, в каких случаях произошло изменение цвета первоначально выпавших осадков.
Оформление опыта
Получение малорастворимых соединений свинца
Запишите ионно-молекулярные уравнения химических процессов и докажите расчетом возможность (невозможность) образования малорастворимых соединений свинца (см. пример 6.1).
Табличные значения ПР:
ПРPb(SCN)2 =2,0 10–5; ПРPbI2 =1,1 10–9; ПРPb3(PO4 )2 = 7,9 10-43.
Пробирка 1.
?
+ → ↓
Pb(NO3 )2 2KSCN ←Pb(SCN)2 + 2KNO3
Pb2+ + 2SCN − →←? |
Pb(SCN)2 ↓ |
|
|
||
СPb 2 +эксп = |
ПКPb(SCN)2 |
эксп = |
|||
С |
- |
= |
ПРPb(SCN) |
2 |
=2,0 10–5 |
SCN эксп |
|
|
|||
|
|
|
95 |
|
|
На основании сравнения ПКPb(SCN)2 эксп и ПРPb(SCN)2 сде-
лайте вывод о возможности (невозможности) образования малорастворимого соединения Pb(SCN)2 в данной системе.
Аналогично рассмотрите следующие системы:
Пробирка 2.
Pb(NO ) KSCN ?
3 2 + →←
Пробирка 3.
Pb(NO ) KI ?
3 2 + →←
Пробирка 4.
?
→
Pb(NO 3 ) 2 + K 3 PO 4 ←
Переосаждение малорастворимых соединений свинца
1. Запишите ионно-молекулярные уравнения процессов и докажите расчетом возможность (невозможность) переосаждения (см. пример 6.3).
Pb(SCN) +KI ?
2 ↓ →←
?
→
Pb3(PO4)2 + KI ←
2. Ответьте на следующие вопросы (письменно): а) что такое растворимость;
б) как уменьшить растворимость малорастворимого соединения, например Pb(SCN)2 ?
ОПЫТ 6.4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ СОЛЕЙ. ГИДРОЛИЗ
Гидролизом солей называется процесс взаимодействия солей с водой, сопровождающийся образованием слабодиссоциирующего электролита. Так как при гидролизе происходит связывание ионов
96
водорода или гидроксид-ионов воды в слабый электролит, то в результате может измениться рН раствора по сравнению с чистой водой.
Гидролизу подвергаются соли, имеющие в своем составе либо катионы слабого основания, либо анионы слабой кислоты, либо те и другие ионы.
Гидролизу по катиону подвергаются соли, образованные катионами слабого основания и анионами сильной кислоты, напри-
мер NH4Cl:
NH 4Cl + H 2O →← NH4OH + HCl
+ |
→ |
+ |
(pH < 7). |
или N H 4 |
+ H 2 O ← NH 4 OH + H |
|
Если катион многовалентный, то гидролиз идет ступенчато. 1-я ступень: 2ZnSO4 + 2H 2O →← (ZnOH)2 SO4 + H 2SO4
или Zn 2 + + H 2 O →← ZnOH + + H + (рН < 7).
При стандартных условиях гидролиз солей, образованных слабыми основаниями 1,2,3-валентных металлов, практически протекает по первой ступени. Для того чтобы в заметной степени протекали последующие ступени, необходимо создать соответствующие условия, например повысить температуру, разбавить раствор.
2-я ступень: (ZnOH)2 SO4 + 2H 2O →← 2Zn(OH)2 + H2SO4
или ZnO H |
+ |
→ |
+ H |
+ |
. |
|
+ H 2 O ← Zn(OH) 2 |
|
Гидролизу по аниону подвергаются соли, образованные катионами сильного основания и анионами слабой кислоты:
KCN + H2O →← HCN + KOH |
|
или CN − + H 2 O →← HCN + OH− |
(рН > 7). |
Если анион многоосновной кислоты, то гидролиз идет ступенчато.
1-я ступень: Na 2CO3 + H2O →← NaHCO3 + NaOH
или CO 32− + H 2 O →← HCO 3− + OH − (рН > 7).
Гидролиз солей, образованных слабыми одно-, двух-, трехосновными кислотами, при стандартных условиях так же практически идет по первой ступени. Для того чтобы последующие ступени
97
протекали в заметной степени, необходимо создать соответствующие условия для смещения равновесия.
2-я ступень: NaHCO3 + H 2O →← H 2CO3 + NaOH
− |
→ |
+ OH |
− |
. |
или HCO 3 |
+ H 2 O ← H 2 CO 3 |
|
Соли, образованные слабым основанием и слабой кислотой, подвергаются гидролизу и по катиону, и по аниону:
(NH4 )2 S + H2O →← NH4HS + NH4OH NH 4HS + H 2O →← H2S + NH4OH
Al2S3 + 6H2O →2Al(OH)3 ↓ +3H2S ↑ (полный, необратимый
гидролиз).
Процесс гидролиза часто представляет собой обратимый равновесный процесс. По этой причине при нормальных условиях гидролиз солей одно-, двух- и трехвалентных металлов протекает в основном по первой ступени; четырехвалентных – по двум ступеням, а шестивалентных – по четырем. В соответствии с законом действия масс процесс гидролиза можно сместить в любом направлении (усилить, подавить).
Основными количественными характеристиками, определяющими глубину протекания процесса гидролиза, является степень гидролиза (h) и константа гидролиза ( KГ ).
Например, для гидролиза Na3PO4 по 1-й ступени
PO34− + H 2O →← HPO 24− + OH −
степень гидролиза представляет собой отношение концентрации гидролизованной соли (С) к исходной концентрации соли в растворе ( C0 ):
h = C C o = CO H −
C o = CO H − 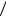 Co ,
Co ,
а константа гидролиза − отношение равновесных концентраций компонентов:
Kг1 = |
CHPO42−COH− |
|
|
. |
|
|
||
|
CPO43− |
|
98

Константу гидролиза соли можно рассчитать через константу ионного произведения воды ( K в = C OH − C H + = 10 −14 ) и констан-
ту диссоциации продукта гидролиза – слабого электролита. Продуктом гидролиза Na3PO4 по первой ступени является сла-
бодиссоциирующий анион HPO24− − это анион ортофосфорной ки-
слоты, и его диссоциация, следовательно, характеризуется константой диссоциации Н3РО4 по 3-й ступени:
HPO 42− →← H |
+ |
+ PO |
3− |
, Kд3 |
= |
CPO34− CH+ |
. |
|
|
4 |
CHPO42− |
||||||
|
|
|
|
|
|
|
Kд3 в выражение для |
|
Заменив C OH − |
= K в |
C H + |
и подставив |
|||||
константы гидролиза Na3PO4 , получим формулу для расчета Kг1 :
|
СНРО2- К |
В |
|
К |
в |
|
К |
в |
|
Кг = |
4 |
= |
|
= |
|
. |
|||
СРО34- СН+ |
СРО34- СН+ СНРО42- |
|
|
||||||
1 |
|
|
Кд3 |
||||||
Аналогичным образом можно получить выражение для расчета константы гидролиза любой соли и для любой ступени.
Например, для гидролиза ZnSO4 по 1-й ступени: |
|
||||||||||||||||||||
Zn 2 + |
+ H 2 O →← ZnOH+ +H+, Kг |
|
= |
|
|
Kв |
= |
10−14 |
|
|
= 2,04 10−8, |
||||||||||
|
|
|
|
4,9 10−7 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
Kд2 |
|
||||||
по 2-й ступени: ZnOH |
+ |
+ H 2 O |
|
→ |
|
|
|
|
2+ |
+ |
H |
+ |
, |
||||||||
|
|
← Zn(OH) |
|
|
|
||||||||||||||||
Kг2 |
= |
Kв |
= |
|
10−14 |
=8,3 10 |
−10 |
, |
|
|
|
|
|
|
|
||||||
Kд |
|
1,2 10−5 |
|
|
|
|
|
|
|
|
|
|
|||||||||
где Kд |
|
1 |
– константы диссоциации основания Zn(OH)2 |
||||||||||||||||||
и Kд |
2 |
||||||||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
по 1-й и 2-й ступеням: |
|
|
|
|
|
|
|
CZnOH+ COH− |
|
||||||||||||
Zn(OH)2 →← ZnOH+ + OH - , K д |
|
= |
, |
||||||||||||||||||
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
CZn(OH)2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
99 |
|
|
|
|
|
|
|
|
|
|
|
||

ZnOH+ →← Zn 2+ + OH - , K д2 |
= |
CZn2+ C OH- |
. |
|
|||
|
|
CZnOH+ |
|
Таким образом, для ZnSO4 константа гидролиза по 1-й ступени больше константы гидролиза по 2-й ступени. Такое соотношение ступенчатых констант справедливо для любых гидролизующихся солей:
Kг1 > Kг2 .
Взаимосвязь константы гидролиза и степени гидролиза выражается законом Оствальда:
h =  K г
K г  C о .
C о .
Гидролиз средних солей при стандартных условиях
Выполнение опыта
На полоски универсальной индикаторной бумаги нанесите раздельно по 1 капле растворов следующих солей: карбоната натрия, силиката натрия, сульфата натрия, хлорида калия, хлорида алюминия, сульфата цинка. Определите рН растворов указанных солей, используя шкалу универсального индикатора, значения занесите в таблицу.
Оформление опыта
1. Заполните таблицу, указав для каждой соли, какими кислотами и основаниями (сильными или слабыми) они образованы; склонны они к гидролизу или нет и по какому иону (аниону или катиону).
|
|
|
|
|
Таблица 6.3 |
|
№ |
Соль |
Происхождение соли |
Склонность к |
|
pН |
|
п/п |
|
Кислота |
Основание |
гидролизу |
|
раствора |
1 |
Na2CO3 |
H2CO3-слабая |
NaOH-сильное |
Гидролиз по аниону |
|
|
2 |
Na2SiO3 |
|
|
|
|
|
3 |
Na2SO4 |
|
|
|
|
|
4 |
KCl |
|
|
|
|
|
5 |
AlCl3 |
|
|
|
|
|
6 |
ZnSO4 |
|
|
|
|
|
100
