
Буферная емкость
Способность буферного раствора сохранять рН по мере прибавления сильной кислоты или щелочи приблизительно на постоянном уровне далеко не беспредельна и ограничена величиной так называемой буферной емкости.
Буферная емкость раствора – это величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении сильных кислот или щелочей. Это мера буферного действия.
Буферная емкость измеряется количеством моль эквивалентов кислоты или щелочи, добавление которых к 1 л буферного раствора изменяет рН на единицу. Обозначается В и измеряется в моль/л.
Различают буферную емкость по кислоте и по щелочи.
Буферная емкость по кислоте:
Вк
=
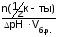
численно равна количеству моль-эквивалентов сильной кислоты, которое нужно добавить к 1 л буферного раствора, чтобы рН изменился на единицу.
Буферная емкость по щелочи:
Вщ
=
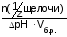
численно равна количеству моль-эквивалентов щелочи, которое нужно добавить к 1 л буферного раствора, чтобы рН изменился на единицу.
Буферная
емкость раствора возрастает по мере
увеличения концентрации его компонентов
(буферная емкость по кислоте определяется
концентрацией акцептора протона, а
буферная емкость по щелочи определяется
концентрацией донора протона) и
приближения соотношения компонентов
к единице.
При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации всех компонентов раствора.
Важным показателем для физиологических сред является буферная емкость по кислоте, т.к. в результате метаболизма (совокупность химических реакций, протекающих в живых клетках) в человеческом организме образуется больше кислотных продуктов, чем основных.
Зона буферного действия
Буферное действие сохраняется в определенном интервале значений рН. Рабочий участок буферной системы, т.е. способность противодействовать изменению рН при добавлении кислот и щелочей, имеет протяженность одну единицу рН с каждой стороны. Вне этого интервала буферная емкость быстро падает до 0.
Интервал рН = рК 1 называется зоной буферного действия. Таким образом, на основе кислоты, имеющей определенное значение рК, можно приготовить буферные растворы, поддерживающие значение рН в диапазоне от рК – 1 до рК + 1. Где рК = –lgК
Пример: область действия ацетатного буфера 3,8 – 5,8; область действия гидрокарбонатного буфера 5,4 – 7,4, область действия гидрофосфатного буфера 6,2 – 8,2, область действия аммиачного буфера 8,2 – 10,2.
Установлено, что выраженное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более чем в 10 раз.
Буферные системы крови
Поскольку кровь – не просто внеклеточная жидкость, а взвесь клеток в жидкой среде, то ее кислотно-щелочное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови, главным образом эритроцитов. Различают следующие буферные системы крови: плазменные (гидрокарбонатная, фосфатная, органических фосфатов и белковая) и эритроцитарная (гемоглобиновая, гидрокарбонатная, фосфатная).
Главным буфером плазмы крови является гидрокарбонатная система Н2СО3 / НСО3–
Гидрокарбонатная(бикарбонатная) буферная система
Она состоит из угольной кислоты и гидрокарбонатов (NaHCO3 – во внеклеточной жидкости, КНСО3 – внутри клеток). В организме угольная кислота возникает в результате гидратации диоксида углерода – продукта окисления углеводов, белков и жиров. Причем процесс этот ускоряется под действием фермента карбоангидразы.
СО2 + Н2О ⇄ СО2·Н2О ⇄ Н2СО3
Отношение концентраций компонентов в гидрокарбонатной буферной системе крови [Н2СО3] / [НСО3–] = 1 / 20. Следовательно, гидрокарбонатная система имеет буферную емкость по кислоте значительно больше буферной емкости по основанию. Т.е. этот буфер особенно эффективно компенсирует действие веществ, увеличивающих кислотность крови. К числу таких веществ прежде всего относят молочную кислоту, избыток которой образуется в результате интенсивной физической нагрузки. (В замкнутых помещениях часто испытывают удушье – нехватку кислорода, учащение дыхания. Однако удушье связано не столько с недостатком кислорода, сколько с избытком СО2. Избыток СО2 в атмосфере приводит к дополнительному растворению СО2 в крови, а это соответственно приводит к понижению рН, т.е к ацидозу.)
