
Химия, Шпоры
.docx|
1)Данную теорию Бор базировал на планетарной модели строения атома Резерфорда, квантовой теории Планка, квантавой теории Эйнштейна.Теория Планка: изменение и поглощение энергии происходит не непрерывно, а определенными порциями - квантами.Теория Эйнштейна: электромагнитная энергия существует только в форме квантов и представляет собой поток неделимых материальных частиц - фотонов.E=mc2 λ=h/mc, где h- постоянная Планка, m- масса электрона, с- скорость света.Постулаты теории Бора:Условие квантования арбит. Электрон может вращаться не по любым орбитам, а только по орбитам с определенным радиусом.Условие частот. При переходе электрона с одной стационарной орбиты на другую атом испускает или поглощает квантовое излучение.E= - (2 π2 m e4)/h2*1/n2, где m- масса электрона, e- заряд электрона, n- количество протонов.
|
2) Принцип наименьшей энергии: заполнение электронами АО(атомной оболочки) происходит в порядке возрастания их энергии. Установлена энергетическая диаграмма для различных АО в много-е нейтральных атомов, находящихся в основном состоянии(с наименьшей энергией). Е=n+l . Принцип Паули: в атоме не м.б. 2 е с одинаковым значением 4х квантовых чисел. Этот набор значений полностью определяет энергетическое состояние е. 2 е, находящихся на одной АО называются спаренными. Общее число орбиталей на эн. уроне со зн. n = n*2. Следовательно, max электронная емкость = 2n*2.Правило Хунда: максимальное значение суммарного спина атома соответствует наименьшей энергии.
|
|
3) Ковалентная связь - химическая связь между двумя атомами, возникающая при обобществлении электронов, принадлежавших этим атомам. Ковалентной связью соединены атомы в молекулах простых газов. МВС базируется на: каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих е пар. Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь. Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав. Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков. Гибридизация – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. |
4) Ковалентная связь – связь, осуществляемая за счет образования е пар, принадлежащих обоим атомам. Различают полярную и неполярную. В случае полярной: в чистом виде может возникать только между одинаковыми атомами за счет объединения е с различными спинами в е пары. Ковалентная полярная связь возникает между атомами разных элементов, обладающих различной е-отрицательностью. Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2. |
|
5) Донорно-акцепторная связь: химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Донорно-акцепторная связь образуется часто при комплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору). Ко́мплексные соединения: частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемыхлигандами. |
6) Ковалентная связь - химическая связь между двумя атомами, возникающая при обобществлении электронов, принадлежавших этим атомам. Ковалентной связью соединены атомы в молекулах простых газов. Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов. В узлах кристаллической решётки расположены положительные ионы металла. Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей. Межмолекулярное взаимодействие имеет электростатическую природу. |
|
7) Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. |
8) КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ вещества, характеризуется наличием дальнего порядка в расположении частиц (атомов, ионов, молекул). ВК. с. существует и ближний порядок, к-рый характеризуется постоянными координац. числами, валентнымиуглами и длинами хим. связей. Анизотропность - Это свойство называется еще неравносвойственностью. Выражается она в том, что физические свойства кристаллов (твердость, прочность, теплопроводность, электропроводность, скорость распространения света) неодинаковы по разным направлениям. Однородность-выражается в том, что любые элементарные объемы кристаллического вещества, одинаково ориентированные в пространстве, абсолютно одинаковы по всем своим свойствам: имеют один и тот же цвет, массу, твердость и т.д. таким образом, всякий кристалл есть однородное, но в то же время и анизотропное тело. Постоянная температура плавления-Выражается в том, что при нагревании кристаллического тела температура повышается до определенного предела; при дальнейшем же нагревании вещество начинает плавиться, а температура некоторое время остается постоянной, так как все тепло идет на разрушение кристаллической решетки. Элементарная ячейка – это мысленно выделенная часть кристаллической решетки, включающая все элементы симметрии данного кристалла, праллельная трансляция которой по всем направлениям дает тело кристалла.
|
|
9) Кристаллы молекулярные- Примерами таких кристаллов являются кристаллы затвердевших инертных газов- неона, аргона, криптона, ксенона. Кристаллы с ковалентной связью. Взаимодействие между частицами в таких кристаллах обусловлено тем, что два электрона принадлежат одновременно двум атомам. Примерами таких кристаллов являются кристаллы кремния, алмаза. Кристаллы с водородной связью. Эта связь обусловлена наличием водорода в веществах. Примерами таких кристаллов являются кристаллы льда. Кристаллы с ионной связью. Эта связь обусловлена взаимодействием ионов. Примерами таких кристаллов являются кристаллы поваренной соли NaCl, фторида лития LiF. Кристаллы с металлической связью. Примерами таких кристаллов являются кристаллы всех металлов. |
10) Термодинамическая система — выделяемая (реально или мысленно) для изучения макроскопическая физическая система, состоящая из большого числа частиц и не требующая для своего описания привлечения микроскопических характеристик отдельных частиц. Единицей измерения числа частиц в термодинамической системе обычно служит число Авогадро. Система называется полуизолированной, если она допускает обмен либо теплотой, либо работой. Система называется неизолированной, если она допускает обмен со сре-дой и теплотой, и работой. Система, имеющая во всех своих частях одинаковый состав и физические свойства, называется физически однородной. Первое начало термодинамики выражает универсальный закон сохранения энергии применительно к задачам термодинамики и исключает возможность созданиявечного двигателя первого рода, то есть устройства, способного совершать работу без соответствующих затрат энергии.
|
|
11) Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Тепловой эффект – разности сумм теплот образования продуктов реакции и исходных реагентов. Закон Гесса -Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
|
12)Второе начало термодинамики.Самопроизвольные процессы – неравновесные процессы,которые протекают без воздействия внешней силы в направлении достижения равновесия.1)Единственным результатом любой совокупности процессов не может быть переход тепла от тела менее нагретого к телу более нагретому.2)Энтропия – обращенная внутрь. Она выражает ту часть энергии системы, которую нельзя извлечь из нее ни при каких условиях. |
|
13)Термодинамические потенциалы - определённые функции объёма (V), давления (р), темп-ры (Т), энтропии (S), числа ч-ц системы (N) и др.макроскопич. параметров (xi), характеризующих состояние термодинамической системы. К П. т. относятся:внутренняя энергия U=U(S, V, N, xi), энтальпия H=H(S, p, N, xi), Гельмгольца энергия |
14) Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.Изобарический порцесс:H=U+pV. Изохорический процесс: Q=дельтаU. |
|
15) ) Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Химическое равновесие смещается в ту или иную сторону при изменении любого из следующих параметров:1) температуры системы, т.е. при её нагревании или охлаждении 2)давления в системе, т.е. при её сжатии или расширении3) концентрации одного из участников обратимой реакции
|
16) Гетерогенная система – это разнородная система, состоящая из двух или более частей, отличающихся по свойствам, между которыми есть поверхность раздела, где свойства системы резко меняются. Гетерогенное равновесие – это равновесие, устанавливающееся на границе раздела фаз. Гетерогенные системы:1) Жидкая+твердая (осадок (твердая фаза), находящийся в равновесии с насыщенным раствором того же химического вещества (жидкая фаза))2)Жидкая+жидкая (две жидкие фазы, не смешивающиеся друг с другом, между которыми распределенорастворенноевещество, находящееся в равновесии с обеими жидкими фазами).Диаграмма воды:
|
|
17)
Скорость химической реакции —
изменение количества одного из
реагирующих веществ за единицу времени
в единице реакционного пространства. V
= ± ((С2 - С1) / (t2 - t1)). Зако́н
де́йствующих масс устанавливает
соотношение между массами реагирующих
веществ в химических реакциях
при равновесии,
а также зависимость скорости химической
реакции от концентрации исходных
веществ.
|
18) v - скорость реакции k - константа скорости реакции С - текущая концентрация исходного вещества СО - начальная концентрация исходного вещества. Нулевого порядка: Первого порядка: Второго порядка:
|
|
19)Температура Зависимость скорости от температуры описывается правилом Вант Гоффа. При повышении температуры на каждые 10 градусов, скорость реакции увеличивается в 2-4 раза.Уравнение Аррениуса: К= К0*e–Ea/RT . Энергия активации — минимальное количество энергии, которое требуется сообщить системе ,чтобы произошла реакция.
|
20)
скорость химической реакции в гомогенной
среде
|
|
21)Температура Зависимость скорости от температуры описывается правилом Вант Гоффа. При повышении температуры на каждые 10 градусов, скорость реакции увеличивается в 2-4 раза. Теория активных столкновений основана на подсчете числа столкновений между реагирующими частицами, которые представляются в виде твердых сфер. Предполагается, что столкновение приведет к реакции, если выполняются два условия: 1) поступательная энергия частиц превышает энергию активации EA; 2) частицы правильно ориентированы в пространстве относительно друг друга. Теория соударений – теория расчета скорости химических реакций, в которой предполагается, что скорость равна количеству соударений между частицами реагентов, имеющих энергию, достаточную для преодоления активационного барьера. Поскольку в реальности не все соударения приводят к реакции, то для расчета скорости вводится стерический фактор – множитель, отражающий долю соударений частиц с достаточной энергией, ведущих к реакции.
|
22) Гетерогенные реакции, хим. реакции с участием веществ, находящихся в различных фазах и составляющих в совокупности гетерогенную систему. Типичные гетерогенные реакции: термическое разложение солей с образованием газообразных и твердых продуктов (например, СаСО3 -> СаО + СО2), восстановление оксидов металлов водородом илиуглеродом (например, РbО + С -> Рb + СО), растворение металлов в кислотах (например, Zn + H2SO4 -> ZnSO4 + Н2), взаимодействие твердых реагентов (Аl2О3 + NiO -> NiAl2O4).Если система состоит из нескольких фаз и реакция протекает на границе раздела фаз.Если реакция протекает в твердом теле, то она фактически всегда гетерогенна,т.к. в результате обрзуется новая фаза. |
|
23) При гетерогенном катализе катализатор находится в другой фазе и химическая реакция идет на поверхности фазы, образуемой катализатором и реагирующими веществами, причем исходные вещества на поверхности катализатора участвуют в образовании активного комплекса или неустойчивого химического соединения с катализатором. Когда взаимодействующие вещества и катализатор находятся в одинаковом агрегатном состоянии, говорят о гомогенном катализе. При гетерогенном катализе реагирующие вещества и катализатор находятся в различных агрегатных состояниях; обычно катализатор в твердом, а реагирующие вещества - в жидком или газообразном. |
24) Раствор – это гомогенная система состоящая из двух или более компонентов независимых друг от друга, соотношение между которыми может меняться. Раств. по агрегатному состоянию: Жидкие – морская вода., твердые – сплавы(сталь(железо + углерод), чугун(железо + углерод(но меньше угл)), латунь(медь + олово, цинк)),газообразные – воздух. Растворителем считается то вещество которое преобладает в данной системе. Растворенное то которого меньше. Растворы однородны в различных частях объема. Растворение вещества часто происходит с выделением или поглощение тепла иногда с изменением объема. Сольватация – окружение и взаимодействие частиц растворенного вещества с растворителем. Гидротация – окружение молекулами воды. Распод вещества на сольватированные ионы – ионизация(электролитическая диссоциация). Насыщенный – это раствор находящийся в равновесии с твердой фазой растворенного вещества и содержащий максимальное кол-во возможных при данных условиях Ненасыщенный – раствор концентрация которого меньше насыщенного. Перенасыщенный – конц. вещества больше чем концентрация насыщенного. Концентрированный – раствор содержащий большое кол-во растворенного вещества. Разбавленный – содержащий малое кол-во раств. вещ-ва.
|
|
25) Неэлектролиты-Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы. Электрический
ток не проводят газы, твердые вещества
(неметаллы), органические соединения
(сахароза, бензин, спирт).
Электроли́т — вещество,
которое проводит электрический
ток вследствие диссоциации на ионы,
что происходит врастворах и расплавах,
или движения ионов в кристаллических
решётках твёрдых
электролитов. Примерами электролитов
могут служить водные
растворы кислот, солей и оснований и
некоторые кристаллы.
Массовая доля:
|
26) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах). 1)гидролиз по катиону (в реакцию с водой вступает только катион); 2)гидролиз по аниону (в реакцию с водой вступает только анион); 3)совместный гидролиз (в реакцию с водой вступает и катион, и анион);
|
|
27) Закон Рауля.Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента. Следствия из закона Рауля: 1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы. 2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества. 3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения. Δtкип=Э x Смоляльн, где Э – эбуллиоскопическая константа, +0,52. Δtзам=К x Смоляльн
|
28) РАСТВОРЫ ЭЛЕКТРОЛИТОВ , содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Р. э. обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные св-ва бесконечно разбавленных Р. э. (т. е. св-ва, зависящие только от концентрации растворенного в-ва, но не от его природы) существенно отличаются от тех же св-в растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа (см. Осмос), понижение давления пара р-рителя над р-ром в сравнении с предсказываемым Рауля законом и др. Основные положения теории Аррениуса (физической теории слабых электролитов): 1.Электролиты способны при растворении в некоторых растворителях самопроизвольно распадаться на ионы – противоположно заряженные частицы. Этот распад был назван диссоциацией – отсюда и название теории. 2. Электролиты при растворении распадаются не полностью. Доля молекул, распавшихся на ионы, отвечает степени электролитической диссоциации и зависит в данном электролите при данной темепратуре от природы вещества и от его концентрации. 3. Силы взаимодействия между ионами отсутствуют, и растворы ведут себя подобно идеальным газовым системам. (Это положение авторами теории не высказывалось, но оно лежит в основе всех ее количественных соотношений).
|
|
29) Диссоциация воды - разложение воды на составляющие химические элементы, иногда происходящая с созданием новых элементов, изначально в разлагаемом растворе не содержащихся, или содержащихся до начала разложения в меньшем количестве, чем после завершения процесса диссоциации. Диссоциация воды является эндотермической реакцией. Водоро́дный показа́тель, pH (лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичномулогарифму активности водородных ионов, выраженной в молях на один литр:
|
30) Тео́рия си́льных электроли́тов Деба́я — Хю́ккеля — предложенная Петером Дебаем и Эрихом Хюккелем в 1923 году статистическая теория плазмы и разбавленных растворов сильных электролитов, согласно которой каждый ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемую ионное облако. Активность иона a – это величина, подстановка которой в термодинамические соотношения идеальных растворов вместо концентрации, делает пригодными эти соотношения для описания реальных растворов. Активность связана с концентрацией соотношением: γ =а/С , где γ есть коэффициент активности. |
|
31) Растворы солей, кислот и оснований обладают способностью проводить электрический ток. Это является следствием электролитической диссоциации, то есть распад нейтральных молекул на положительно заряженные ионы (катионы) и на отрицательно заряженные ионы (анионы) В разбавленных растворах сильных электролитов рост электропроводности обусловлен увеличением концентрации ионов. Однако в концентрированных растворах с ростом концентрации увеличиваются силы электростатического взаимодействия между ионами, и электропроводность уменьшается. При определенном значении концентрации влияние уменьшения скорости больше влияния увеличения концентрации ионов. В результате электропроводность уменьшается. В растворах слабых электролитов силы электростатического притяжения малы. |
32) Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния/для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л). Кипячение устраняет только временную (карбонатную) жёсткость. При обычных условиях s-металлы находятся в кристаллическом состоянии. Металлы I группы — мягкие и имеют небольшую плотность по сравнению с другими. Литий, натрий и калий легче воды и плавают на ее поверхности, реагируя с ней. Металлы II группы тверже и плотнее щелочных. Низкие значения температур плавления и кипения s-металлов объясняются сравнительно слабыми металлическими связями в кристаллических решетках этих металлов. |
|
33) Алюминий (лат. Aluminium), Al, химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815; серебристо-белый легкий металл. Состоит из одного стабильного изотопа 27Al. Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие ыфтеплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1.Германий - При обычных условиях устойчив к кислороду, парам воды, разбавленным кислотам. В присутствии сильных комплексообразователей или окислителей, при нагревании германий реагирует с кислотами:Ge + H2SO4 (конц) = Ge(SO4)2 + 2SO2↑ + 4H2O,Олово: В соответствии с конфигурацией внешних электронов атома 5s25р2 Олово имеет две степени окисления: +2 и +4; последняя более устойчива; соединения Sn (II) - сильные восстановители. Сухим и влажным воздухом при температуре до 100 °С Олово практически не окисляется: его предохраняет тонкая, прочная и плотная пленка SnO2. По отношению к холодной и кипящей воде Олово устойчиво.Свинец: Конфигурация внешних электронных оболочек атома Pb 6s26р2, в соответствии с чем он проявляет степени окисления +2 и +4. Свинец сравнительно мало активен химически. Металлический блеск свежего разреза Свинца постепенно исчезает на воздухе вследствие образования тончайшей пленки РbО, предохраняющей от дальнейшего окисления.С кислородом образует ряд оксидов Рb2О, РbО, РbО2, Рb3О4 и Рb2О3.В соответствии с положением Кремния в периодической системе Менделеева 14 электронов атома Кремния распределены по трем оболочкам: в первой (от ядра) 2 электрона, во второй 8, в третьей (валентной) 4; конфигурация электронной оболочки 1s22s22p63s23p2. Химическая связь атома Кремния с другими атомами осуществляется обычно за счет гибридных sр3-орбиталей, но возможно также вовлечение двух из его пяти (вакантных) 3d-орбиталей
|
34) Эти элементы называют еще переходными т.к. у них электроны заполняют не внешний а предвнешний (n-1) подуровень. Электроны внешнего уровня и d орбиталей предвнешнего уровня близки по запасу энергии следоват. валентные считаются электроны внешнего и предвнешнего уровней. На внешнем уровне имеют 1-2 электрона и большое количество вокантных орбиталей что опред металлич. характер. В группе сверху вниз:Радиус увелич, энерг. актив уменьш, восс. свойства увелич, окислит. свой-ва уменьш. В периоде слева на право энергия ионизации увелич. что объясняется действием эффекта проникновения электронов внешнего уровня под экран d подуровня. Для большинства d элементов характерно наличие множества степеней окисления зависящей от стабильности соответствующих электронных оболочек. Соединения Элементы образуют простые вещества металлического типа. Это объясняется тем, что на внешнем уровне их атомов присутствует 1 - 2 электрона, которые принимают участие в образовании сильно делокализованной, многоцентровой связи. Кроме того, этому способствует наличие большого количества вакантных орбиталей и относительно небольшие значения первых энергий ионизации. Mn + 2 HCl = Mn Cl 2 + H 2 ( 0 (Mn 2 + / Mn) = - 1, 19 B). Mn + 8 HNO 3 = 3 Mn (NO 3 ) 2 + 2 NO 2 + 4 H 2 O, Mn + 2 H 2 SO 4 (конц.) = MnSO 4 + SO 2 + 2 H 2 O. Mn + 2 H2O = Mn(OH) 2 + H 2 (при нагревании), щелочами 2Re+4NaOH+3O2=2Na2Re(+4)O4+2H2O Сu(OH)3+3NaOH=Na3[Cr(OH)6] ; CrO+HCl=CrCl2+H2O
|


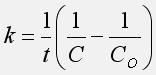
 КОНСТАНТА
СКOРОСТИ реакции,
коэффициент пропорциональности в
кинетич. ур-нии хим. реакции, выражающем
зависимость скорости реакции v
от концентрации к.-л.
из компонентов реакц. Смеси.константа
скорости реакции: kпр =
Aпр*exp(-Eпр/RT);
Факторы,
влияющие на скорость химической
реакции.Для гомогенных, гетерогенных
реакций:1) концентрация реагирующих
веществ;2) температура;3) катализатор;4)
ингибитор.Только для гетерогенных:1)
скорость подвода реагирующих веществ
к поверхности раздела фаз;2) площадь
поверхности.
КОНСТАНТА
СКOРОСТИ реакции,
коэффициент пропорциональности в
кинетич. ур-нии хим. реакции, выражающем
зависимость скорости реакции v
от концентрации к.-л.
из компонентов реакц. Смеси.константа
скорости реакции: kпр =
Aпр*exp(-Eпр/RT);
Факторы,
влияющие на скорость химической
реакции.Для гомогенных, гетерогенных
реакций:1) концентрация реагирующих
веществ;2) температура;3) катализатор;4)
ингибитор.Только для гетерогенных:1)
скорость подвода реагирующих веществ
к поверхности раздела фаз;2) площадь
поверхности.