
- •Предисловие
- •Глава 1. Аминокислоты и белки
- •1.1 Общая характеристика
- •1.2 Классификация аминокислот
- •1.3 Модификация аминокислот
- •1.4 Ионизация аминокислот
- •1.5 Пептидная связь
- •1.6 Пептиды и белки
- •1.7 Функции белков
- •1.8 Уровни структурной организации белков
- •А Первичная структура белка
- •Б Вторичная структура белка
- •В Третичная структура белка
- •Д Четвертичная структура белка
- •1.9 Глобулярные и фибриллярные белки
- •А Кератин
- •1.10 Простые и сложные белки
- •1.11 Денатурация и ренатурация белков
- •1.12 Методы работы с белками
- •А Очистка и выделение белка
- •Б Высаливание
- •В Диализ
- •Д Аналитические методы работы с белками
- •Термины
- •Вопросы к семинарскому занятию (1-я часть)
- •Вопросы к семинарскому занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- • Аминокислоты
- •Вопросы для самопроверки
- •Глава 2. Ферменты
- •2.1 Общая характеристика
- •2.2 Номенклатура ферментов
- •2.3 Свойства ферментов
- •2.4 Строение фермента
- •2.5 Специфичность ферментов
- •А Модель «ключ-замок»
- •Б Модель индуцированного соответствия
- •2.7 Термодинамика ферментативных реакций
- •2.8 Кинетика ферментативных реакций
- •А Вывод уравнения Михаэлиса-Ментен (по Бергу)
- •В Уравнение Лайнуивера-Берка
- •2.9 Механизмы ферментативного катализа
- •2.10 Влияние факторов среды на скорость протекания ферментативной реакции
- •А Концентрация субстрата
- •2.12 Мультисубстратные реакции
- •А Последовательный механизм
- •Б Механизм «пинг-понг»
- •2.13 Ингибирование ферментов
- •Б Бесконкурентные ингибиторы
- •В Неконкурентные ингибиторы
- •2.14 Кооперативные взаимодействия внутри молекул ферментов
- •А Параллельная модель
- •2.15 Аллостерическая регуляция активности ферментов
- •2.16 Регуляция активности ферментов с помощью ковалентной модификации
- •2.17 Анти-, мульти- и изоферменты
- •2.18 Ферменты в медицине
- •А Энзимодиагностика
- •Термины
- •Вопросы к занятию (1-я часть)
- •Вопросы к занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 3. Нуклеиновые кислоты
- •3.1 Общая характеристика
- •3.2 Строение нуклеотида
- •3.3 Первичная структура ДНК
- •3.4 Вторичная структура ДНК
- •3.5 Денатурация и ренатурация ДНК
- •3.6 Третичная структура ДНК
- •3.7 Четвертичная структура ДНК
- •3.8 Виды РНК и их функции
- •3.9 Первичная структура РНК
- •3.10 Вторичная структура РНК
- •3.11 Третичная структура РНК
- •3.12 Четвертичная структура РНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 4. Репликация
- •4.1 Общая характеристика
- •4.2 Инициация репликации у прокариот
- •4.3 Элонгация репликации у прокариот
- •Б Механизм ферментативной реакции
- •4.4 Терминация репликации у прокариот
- •4.5 Репликация у эукариот
- •4.6 Проблемы репликации
- •Б Проблема высокой точности процесса
- •4.7 Плазмиды
- •В Типы плазмид
- •Д Механизмы репликации кольцевых плазмид
- •4.8 Репликация вирусов
- •Б Репликация генома РНК-вирусов
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 5. Транскрипция
- •5.1 Организация генетической информации
- •5.2 Общая характеристика транскрипции
- •5.3 Гипотеза Жакоба и Моно
- •5.4 Строение РНК-полимераз
- •5.5 Инициация транскрипции у прокариот
- •5.6 Элонгация транскрипции у прокариот
- •5.7 Терминация транскрипции у прокариот
- •5.8 Инициация транскрипции у эукариот
- •5.9 Элонгация транскрипции у эукариот
- •5.10 Терминация транскрипции у эукариот
- •А Кэпирование
- •Б Полиаденилирование
- •В Сплайсинг
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 6. Трансляция
- •6.1 Общая характеристика
- •6.2 Свойства генетического кода
- •6.3 Основные этапы биосинтеза белка
- •А Этап 1. Активация аминокислот
- •Д Этап 5. Фолдинг и посттрансляционная модификация
- •6.4 Рибосомы
- •6.5 Инициация у прокариот
- •6.6 Инициация у эукариот
- •6.7 Элонгация у прокариот
- •6.8 Элонгация у эукариот
- •6.9 Терминация у прокариот
- •6.10 Терминация у эукариот
- •6.11 Гипотеза «качания»
- •6.12 Фолдинг и посттрансляционная модификация белков
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 7. Регуляция биосинтеза белка
- •7.1 Регуляция экспрессии генов у прокариот
- •В Катаболическая репрессия. Лактозный оперон
- •Д Аттенуация. Триптофановый оперон
- •Е «Сильные» и «слабые» промоторы
- •Ж σ-Субъединица РНК-полимеразы
- •7.2 Регуляция экспрессии генов у эукариот
- •Хроматин-перестраивающие комплексы
- •Архитектурные белки высокомобильной группы
- •Ковалентная модификация гистонов
- •Метилирование ДНК
- •В Регуляция с помощью факторов транскрипции
- •7.3 Регуляция на уровне трансляции у про- и эукариот
- •А Дискриминация мРНК
- •Б Трансляционная репрессия
- •7.4 Другие механизмы регуляции у эукариот
- •Б РНК-интерференция
- •Интерференция с помощью малых интерферирующих РНК
- •Интерференция с помощью микроРНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Регуляция на уровне транскрипции (прокариоты)
- •Вопросы для самопроверки
- •Глава 8. Мутации и репарация
- •8.1 Мутации
- •8.2 Классификация мутаций по вызвавшим их причинам
- •8.3 Классификация мутаций по степени изменений генома
- •8.4 Классическая классификация
- •8.5 Репарация
- •А Прямая репарация
- •8.6 Эксцизионная репарация оснований (BER)
- •8.7 Эксцизионная репарация нуклеотидов (NER)
- •8.8 Мисметч репарация
- •8.9 Репарация двунитевых разрывов
- •8.10 Негомологичное соединение цепей ДНК при двунитевых разрывах
- •8.11 SOS-репарация (SOS-ответ)
- •8.12 Рекомбинационная репарация
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 9. Иммунитет и антитела
- •9.1 Иммунитет: его виды и элементы
- •9.2 Врожденный (неспецифический) иммунитет
- •В Химические медиаторы врожденного иимунитета
- •Е Классический путь активации комплемента
- •Ж Альтернативный путь активации комплемента
- •З Активация терминальных компонентов комплемента
- •И Как фагоциты отличают чужеродные клетки от «своих»?
- •9.3 Приобретенный (специфический) иммунитет
- •А T-лимфоциты
- •В Антитела
- •Е Вторичный иммунный ответ
- •Ж Активация гуморального иммунитета
- •9.4 Группы крови
- •9.5 Трансфузионные реакции
- •9.6 Правила переливания
- •9.7 Резус-фактор (Rh)
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 10. Биологические мембраны
- •10.1 Строение биомембран
- •В Липиды биомембран
- •10.2 Функции мембран
- •10.3 Мембранный транспорт
- •10.4 Эндо- и экзоцитоз
- •10.5 Трансмембранная передача сигнала
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 11. Энергетический обмен
- •11.1 Энергия в клетке
- •11.2 Дыхательная цепь митохондрий
- •11.3 Сопряжение дыхания и окислительного фосфорилирования
- •11.4 Разобщение дыхания и окислительного фосфорилирования
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 12. Введение в метаболизм
- •12.1 Общая характеристика
- •А Метаболические пути
- •Б Метаболиты
- •В Гомеостаз
- •12.2 Функции метаболических путей
- •А Образование энергии
- •Б Катаболизм органических соединений
- •Переваривание
- •Гликолиз
- •Окисление жирных кислот
- •Катаболизм аминокислот
- •В Синтез органических соединений и предшественников макромолекул
- •Глюконеогенез: синтез глюкозы
- •Синтез жирных кислот
- •Синтез гема
- •Креатинфосфат
- •Гликоген
- •Жиры или триацилглицеролы
- •Д Выведение потенциально опасных соединений
- •Цикл мочевины
- •Синтез желчных кислот
- •Катаболизм гема
- •Е Образование регуляторных молекул
- •12.3 Ключевые положения всех метаболических путей
- •А АТФ — донор энергии для синтеза
- •В Эссенциальные органические соединения
- •Д Взаимосвязи метаболических путей
- •Е Нелинейность метаболических путей
- •Ж Локализация метаболических путей в клетке
- •З Тканеспецифичность метаболических путей
- •И Метаболизм при голодании
- •12.4 Интеграция метаболизма
- •Состояние насыщения
- •Состояние голодания
- •Б Интеграция метаболизма в различных физиологических состояниях
- •Состояние голодания
- •Продолжительное голодание
- •Состояние насыщения
- •Физические нагрузки
- •В Регуляция метаболизма
- •Инсулин
- •Глюкагон
- •Адреналин
- •Гидрокортизон
- •Адипоцитокины
- •Рекомендуемая литература
- •Приложение 1. Аминокислоты и белки
- •Классификация аминокислот
- •Приложение 2. Ферменты
- •Строение химотрипсина
- •Приложение 3. Нуклеиновые кислоты
- •Приложение 4. Репликация
- •Приложение 5. Транскрипция
- •Приложение 6. Трансляция
- •Приложение 7. Регуляция биосинтеза белка
- •Приложение 8. Мутации и репарация
- •Приложение 9. Иммунитет и антитела
- •Приложение 10. Биологические мембраны
- •Приложение 11. Энергетический обмен
- •Оглавление
Вторичная структура ДНК 75
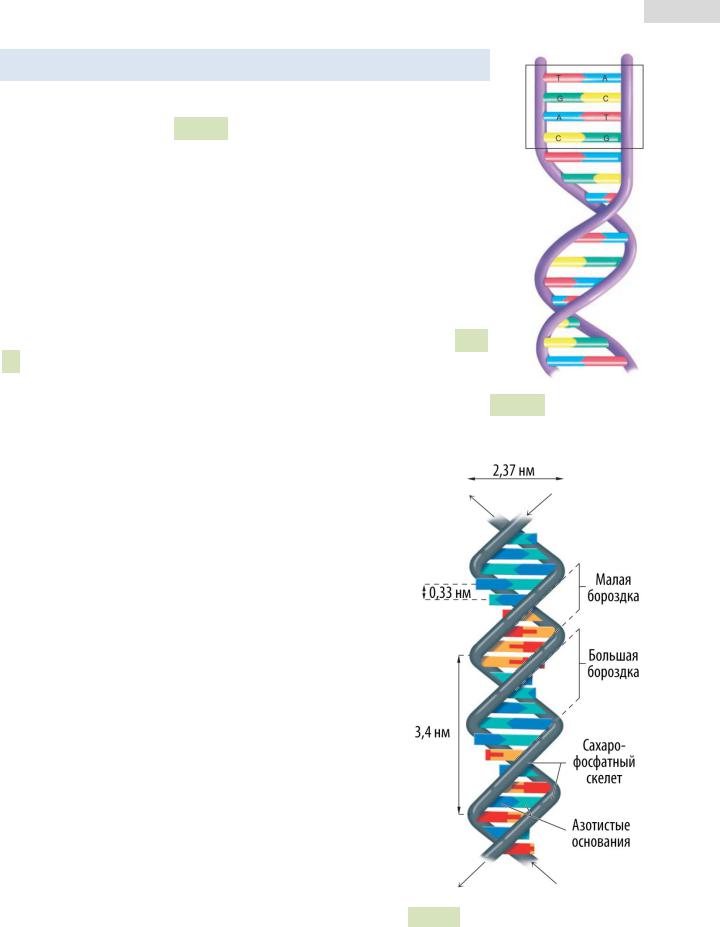
3.4 Вторичная структура ДНК
Вторичная структура ДНК представляет собой двухцепочечную спираль (см. Рис. 50 ), из двух длинных полинуклеотидных цепей, закрученных относительно общей оси. Сахарофосфатный скелет обеих цепей обращён наружу от оси спирали, а азотистые основания обращены внутрь спирали.
Две цепи удерживаются вместе с помощью водородных связей между азотистыми основаниями (аденин образует две связи с тимином, а гуанин — три связи с цитозином), гидрофобных связей, стэкинг-взаимодействий и ионных связей. Одна цепь ДНК комплементарна другой, при этом цепи антипараллельны.
Структурные особенности двойной спирали ДНК (см. Рис.
51 ):
1.Две антипараллельные цепи являются правозакрученными вдоль общей оси, диаметр спирали
~23,7 Å (2,37 нм).
2.Плоскости, в которых лежат азотистые основания, образующие водородные связи, почти перпендикулярны оси спирали. В B-ДНК основания занимают центральную часть спирали, а сахарофосфатный скелет закручен и обращён наружу. Только края оснований контактируют с растворителем.
3.Каждое основание имеет приблизительно одну ширину, что придает спирали ДНК практически полную симметрию независимо от состава самих оснований. Основания в парах можно поменять местами без каких-либо последствий для спирали: Г ≡ Ц можно изменить на Ц ≡ Г или А = Т на Т = А.
Рис. 50. Вторичная структура ДНК.
Рис. 51. Вторичная структура ДНК: двойная спираль и её параметры.
75
76 |
Глава 3 |
Нуклеиновые кислоты |
4.Каноническая (идеальная) форма B- ДНК имеет 10 пар оснований в одном шаге (в одном повороте спирале). При этом на каждую пару приходится 36° (если быть точным, то число пар в шаге — 10,4, следовательно, угол составляет 34,6°). Пары оснований уло-
жены в спирали «стопками». Шаг спирали составляет 34 Å (3,4 нм).
ДНК обладает структурной гибкостью и существует в нескольких формах: A-ДНК, B-ДНК (классическая Уотсон-Криковская двойная спираль), Z-ДНК и др. A- и B-ДНК являются правозакрученными спиралями. В B-ДНК азотистые основания располагаются почти перпендикулярно к оси вращения спирали. Z-ДНК представляет собой левозакрученную спираль. Бо́льшая часть ДНК клетки находится в B-форме (см. Приложение 3).
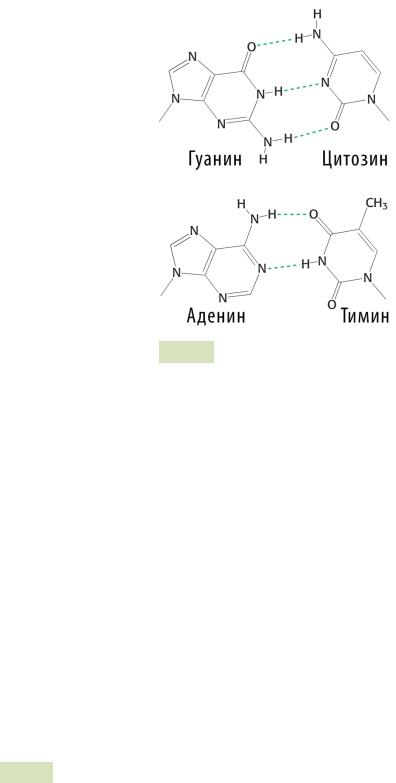
В двойной спирали различают большую и малую бороздки — это расстояния между сахарофосфатными остовами обеих цепей в двойной спирали.
Рис. 52. Уотсон-Криковские пары комплементарных осно-
ваний: пунктиром отмечены водородные связи между атомами
H, O и N.
Длину ДНК измеряют в килоба́зах, т.е. тысячах пар нуклеотидов: 1 кб = 1 000 пар нуклеотидов. Геном одной клетки человека (т.е. все 46 хромосом клетки) имеет длину 3,2 × 106 кб (или 3,2 × 109 пар нуклеотидов).
Химические связи, стабилизирующие вторичную структуру ДНК:
1.Стэкинг-взаимодействия: пары оснований, уложенные в спирали «стопками» удерживаются силами Ван-дер-Ваальса. И несмотря на то, что связи между 2 парами оснований крайне слабые, их большое количество во всей молекуле ДНК является важным фактором её стабилизации.
2.Гидрофобные связи: гидрофобные азотистые основания «погружены» внутрь спирали и взаимодействуют друг с другом, это придаёт спирали дополнительную стабильность.
3.Водородные связи образуются между азотистыми основаниями цепей. Между аденином и тимином — 2 водородных связи, а между гуанином и цитозином — 3 (см. Рис. 52 ).
4.Электростатические взаимодействия: электростатическое отталкива-
ние между отрицательно заряженными остатками фосфорной кислоты дестабилизирует спираль ДНК, однако эти эффекты минимизированы присутствием ионов Mg2+ и катионных белков (богатых лизином и аргинином).

Денатурация и ренатурация ДНК 77
3.5 Денатурация и ренатурация ДНК
ДНК в клетке термодинамически стабильна и спирализована, однако некоторые её области подвергаются «плавлению» (т.е. двойная спираль разматывается) изза происходящих процессов репликации, транскрипции, репарации и рекомбинации. Полное расплетение цепей и их разделение называют денатурацией. Денатурация происходит только in vitro (см. Рис. 53 ).
Двухцепочечная ДНК может быть денатурирована воздействием высоких температур или хаотропных агентов, таких как мочевина или гуанидин хлорид.
При медленном повышении температуры двойная спираль ДНК денатурирует постепенно, за счет нарушения стэкинг и водородных связей. Две цепи постепенно расплетаются и наконец полностью диссоциируют (разделяются). Температура, при которой половина молекулы ДНК подверглась денатурации, называется
точкой плавления Tm.
Ренатурацией называется процесс восстановления нативной кон-
формации ДНК. Ренатурация происходит самопроизвольно при охлаждении раствора, в котором содержатся диссоциировавшие цепи ДНК.
ДНК и РНК могут образовывать гибриды по принципу комплементарности (например, матричная цепь ДНК и транскрибированная с неё пре-мРНК). Кроме того, если смешать в одном растворе денатурированные цепи ДНК различных видов, они тоже будет образовывать гибриды, но в силу того, что полностью нуклеотидные последовательности этих цепей некомплементарны (ввиду генетической изменчивости и разнообразия), такие гибриды будут считаться неполными: помимо спирализованных участков будут образовываться «вздутия», не имеющие спиральной укладки.
Степень денатурации можно измерить с помощью абсорбции ультрафиолетовых лучей. Одноцепочечные ДНК при длине волны 260 нм поглощают 12-40% света. Разумеется, области, богатые парами A = T быстрее подвергаются плавлению, чем Г ≡ Ц участки.
77
78Глава 3 Нуклеиновые кислоты
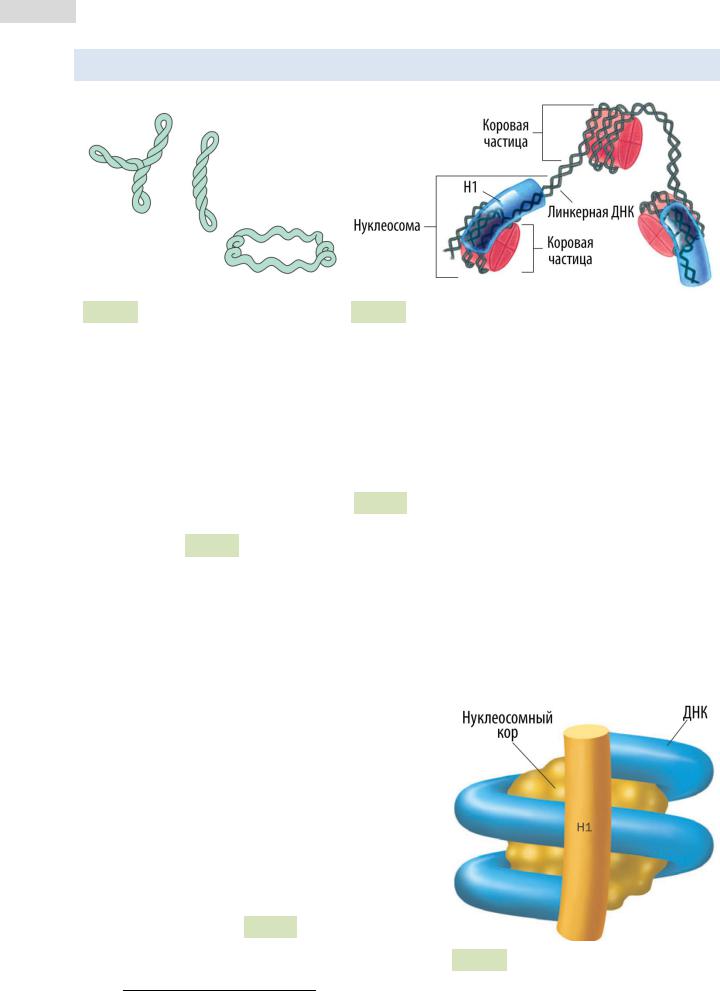
3.6Третичная структура ДНК
Рис. 54. Отрицательные супер- Рис. 55. Строение нуклеосомной нити витки в кольцевой бактериальной ДНК (слева) и их постепенное раскручивание (справа)
Третичная структура ДНК — это пространственная форма, которую принимает молекула ДНК по мере своего сворачивания и компактизации. Третичная структура ДНК про- и эукариот различается. Прокариотическая ДНК связана лишь с небольшим количеством белков, среди которых есть и гистоноподобные. Она обычно свёрнута в суперспираль округлой формы (см. Рис. 54 ▲). У эукариот степень упаковки ДНК гораздо выше, поскольку их цепи связаны с гистоновыми белками, образующими нук-
леосо́мы (см. Рис. 55 ▲). Нуклеосома — это комплекс нуклеосомного ко́ра и накру-
ченного на него участка ДНК. Каждый нуклеосомный кор состоит из 4 пар гисто́нов (всего 8 белковых субъединиц): H2A, H2B, H3 и H4. Гистоны — положительно заряженные белки (из-за обилия остатков аргинина и лизина), взаимодействующие с отрицательно заряженной ДНК. Комплекс гистонов и ДНК стабилизирован водород-
ными связями, ионными связями (или солевыми мостиками), диполь-дипольными взаи-
модействиями1 (связь между положительно заряженным концом одной молекулы и отрицательно заряженным концом другой).
Вокруг одной нуклеосомной частицы ДНК делает 2,5 оборота (1,75 × 2). Длина участка ДНК, связанного с нуклеосомным кором, составляет 146 пар нуклеотидов. Фрагмент спирали ДНК, находящийся между двумя нуклеосомными частицами и связывающий их, называют линкерным (линкерная ДНК). Гистон H1 в состав нуклеосомного кора не входит, однако связан с молекулой ДНК, которая оборачивается вокруг нуклеосомного кора, в области её «вхождения» и «выхода» из кора (см. Рис. 56 ). Роль H1 заклю-
чается в поддержании плотности упаковки ДНК Рис. 56. Гистон H1 и нуклеосома.
1 См. Таблица 2 (стр. 12) и Рис. 127 (стр. 191)
