
- •Предисловие
- •Глава 1. Аминокислоты и белки
- •1.1 Общая характеристика
- •1.2 Классификация аминокислот
- •1.3 Модификация аминокислот
- •1.4 Ионизация аминокислот
- •1.5 Пептидная связь
- •1.6 Пептиды и белки
- •1.7 Функции белков
- •1.8 Уровни структурной организации белков
- •А Первичная структура белка
- •Б Вторичная структура белка
- •В Третичная структура белка
- •Д Четвертичная структура белка
- •1.9 Глобулярные и фибриллярные белки
- •А Кератин
- •1.10 Простые и сложные белки
- •1.11 Денатурация и ренатурация белков
- •1.12 Методы работы с белками
- •А Очистка и выделение белка
- •Б Высаливание
- •В Диализ
- •Д Аналитические методы работы с белками
- •Термины
- •Вопросы к семинарскому занятию (1-я часть)
- •Вопросы к семинарскому занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- • Аминокислоты
- •Вопросы для самопроверки
- •Глава 2. Ферменты
- •2.1 Общая характеристика
- •2.2 Номенклатура ферментов
- •2.3 Свойства ферментов
- •2.4 Строение фермента
- •2.5 Специфичность ферментов
- •А Модель «ключ-замок»
- •Б Модель индуцированного соответствия
- •2.7 Термодинамика ферментативных реакций
- •2.8 Кинетика ферментативных реакций
- •А Вывод уравнения Михаэлиса-Ментен (по Бергу)
- •В Уравнение Лайнуивера-Берка
- •2.9 Механизмы ферментативного катализа
- •2.10 Влияние факторов среды на скорость протекания ферментативной реакции
- •А Концентрация субстрата
- •2.12 Мультисубстратные реакции
- •А Последовательный механизм
- •Б Механизм «пинг-понг»
- •2.13 Ингибирование ферментов
- •Б Бесконкурентные ингибиторы
- •В Неконкурентные ингибиторы
- •2.14 Кооперативные взаимодействия внутри молекул ферментов
- •А Параллельная модель
- •2.15 Аллостерическая регуляция активности ферментов
- •2.16 Регуляция активности ферментов с помощью ковалентной модификации
- •2.17 Анти-, мульти- и изоферменты
- •2.18 Ферменты в медицине
- •А Энзимодиагностика
- •Термины
- •Вопросы к занятию (1-я часть)
- •Вопросы к занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 3. Нуклеиновые кислоты
- •3.1 Общая характеристика
- •3.2 Строение нуклеотида
- •3.3 Первичная структура ДНК
- •3.4 Вторичная структура ДНК
- •3.5 Денатурация и ренатурация ДНК
- •3.6 Третичная структура ДНК
- •3.7 Четвертичная структура ДНК
- •3.8 Виды РНК и их функции
- •3.9 Первичная структура РНК
- •3.10 Вторичная структура РНК
- •3.11 Третичная структура РНК
- •3.12 Четвертичная структура РНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 4. Репликация
- •4.1 Общая характеристика
- •4.2 Инициация репликации у прокариот
- •4.3 Элонгация репликации у прокариот
- •Б Механизм ферментативной реакции
- •4.4 Терминация репликации у прокариот
- •4.5 Репликация у эукариот
- •4.6 Проблемы репликации
- •Б Проблема высокой точности процесса
- •4.7 Плазмиды
- •В Типы плазмид
- •Д Механизмы репликации кольцевых плазмид
- •4.8 Репликация вирусов
- •Б Репликация генома РНК-вирусов
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 5. Транскрипция
- •5.1 Организация генетической информации
- •5.2 Общая характеристика транскрипции
- •5.3 Гипотеза Жакоба и Моно
- •5.4 Строение РНК-полимераз
- •5.5 Инициация транскрипции у прокариот
- •5.6 Элонгация транскрипции у прокариот
- •5.7 Терминация транскрипции у прокариот
- •5.8 Инициация транскрипции у эукариот
- •5.9 Элонгация транскрипции у эукариот
- •5.10 Терминация транскрипции у эукариот
- •А Кэпирование
- •Б Полиаденилирование
- •В Сплайсинг
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 6. Трансляция
- •6.1 Общая характеристика
- •6.2 Свойства генетического кода
- •6.3 Основные этапы биосинтеза белка
- •А Этап 1. Активация аминокислот
- •Д Этап 5. Фолдинг и посттрансляционная модификация
- •6.4 Рибосомы
- •6.5 Инициация у прокариот
- •6.6 Инициация у эукариот
- •6.7 Элонгация у прокариот
- •6.8 Элонгация у эукариот
- •6.9 Терминация у прокариот
- •6.10 Терминация у эукариот
- •6.11 Гипотеза «качания»
- •6.12 Фолдинг и посттрансляционная модификация белков
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 7. Регуляция биосинтеза белка
- •7.1 Регуляция экспрессии генов у прокариот
- •В Катаболическая репрессия. Лактозный оперон
- •Д Аттенуация. Триптофановый оперон
- •Е «Сильные» и «слабые» промоторы
- •Ж σ-Субъединица РНК-полимеразы
- •7.2 Регуляция экспрессии генов у эукариот
- •Хроматин-перестраивающие комплексы
- •Архитектурные белки высокомобильной группы
- •Ковалентная модификация гистонов
- •Метилирование ДНК
- •В Регуляция с помощью факторов транскрипции
- •7.3 Регуляция на уровне трансляции у про- и эукариот
- •А Дискриминация мРНК
- •Б Трансляционная репрессия
- •7.4 Другие механизмы регуляции у эукариот
- •Б РНК-интерференция
- •Интерференция с помощью малых интерферирующих РНК
- •Интерференция с помощью микроРНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Регуляция на уровне транскрипции (прокариоты)
- •Вопросы для самопроверки
- •Глава 8. Мутации и репарация
- •8.1 Мутации
- •8.2 Классификация мутаций по вызвавшим их причинам
- •8.3 Классификация мутаций по степени изменений генома
- •8.4 Классическая классификация
- •8.5 Репарация
- •А Прямая репарация
- •8.6 Эксцизионная репарация оснований (BER)
- •8.7 Эксцизионная репарация нуклеотидов (NER)
- •8.8 Мисметч репарация
- •8.9 Репарация двунитевых разрывов
- •8.10 Негомологичное соединение цепей ДНК при двунитевых разрывах
- •8.11 SOS-репарация (SOS-ответ)
- •8.12 Рекомбинационная репарация
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 9. Иммунитет и антитела
- •9.1 Иммунитет: его виды и элементы
- •9.2 Врожденный (неспецифический) иммунитет
- •В Химические медиаторы врожденного иимунитета
- •Е Классический путь активации комплемента
- •Ж Альтернативный путь активации комплемента
- •З Активация терминальных компонентов комплемента
- •И Как фагоциты отличают чужеродные клетки от «своих»?
- •9.3 Приобретенный (специфический) иммунитет
- •А T-лимфоциты
- •В Антитела
- •Е Вторичный иммунный ответ
- •Ж Активация гуморального иммунитета
- •9.4 Группы крови
- •9.5 Трансфузионные реакции
- •9.6 Правила переливания
- •9.7 Резус-фактор (Rh)
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 10. Биологические мембраны
- •10.1 Строение биомембран
- •В Липиды биомембран
- •10.2 Функции мембран
- •10.3 Мембранный транспорт
- •10.4 Эндо- и экзоцитоз
- •10.5 Трансмембранная передача сигнала
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 11. Энергетический обмен
- •11.1 Энергия в клетке
- •11.2 Дыхательная цепь митохондрий
- •11.3 Сопряжение дыхания и окислительного фосфорилирования
- •11.4 Разобщение дыхания и окислительного фосфорилирования
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 12. Введение в метаболизм
- •12.1 Общая характеристика
- •А Метаболические пути
- •Б Метаболиты
- •В Гомеостаз
- •12.2 Функции метаболических путей
- •А Образование энергии
- •Б Катаболизм органических соединений
- •Переваривание
- •Гликолиз
- •Окисление жирных кислот
- •Катаболизм аминокислот
- •В Синтез органических соединений и предшественников макромолекул
- •Глюконеогенез: синтез глюкозы
- •Синтез жирных кислот
- •Синтез гема
- •Креатинфосфат
- •Гликоген
- •Жиры или триацилглицеролы
- •Д Выведение потенциально опасных соединений
- •Цикл мочевины
- •Синтез желчных кислот
- •Катаболизм гема
- •Е Образование регуляторных молекул
- •12.3 Ключевые положения всех метаболических путей
- •А АТФ — донор энергии для синтеза
- •В Эссенциальные органические соединения
- •Д Взаимосвязи метаболических путей
- •Е Нелинейность метаболических путей
- •Ж Локализация метаболических путей в клетке
- •З Тканеспецифичность метаболических путей
- •И Метаболизм при голодании
- •12.4 Интеграция метаболизма
- •Состояние насыщения
- •Состояние голодания
- •Б Интеграция метаболизма в различных физиологических состояниях
- •Состояние голодания
- •Продолжительное голодание
- •Состояние насыщения
- •Физические нагрузки
- •В Регуляция метаболизма
- •Инсулин
- •Глюкагон
- •Адреналин
- •Гидрокортизон
- •Адипоцитокины
- •Рекомендуемая литература
- •Приложение 1. Аминокислоты и белки
- •Классификация аминокислот
- •Приложение 2. Ферменты
- •Строение химотрипсина
- •Приложение 3. Нуклеиновые кислоты
- •Приложение 4. Репликация
- •Приложение 5. Транскрипция
- •Приложение 6. Трансляция
- •Приложение 7. Регуляция биосинтеза белка
- •Приложение 8. Мутации и репарация
- •Приложение 9. Иммунитет и антитела
- •Приложение 10. Биологические мембраны
- •Приложение 11. Энергетический обмен
- •Оглавление
4
Глава 1. Аминокислоты и белки
1.1 Общая характеристика
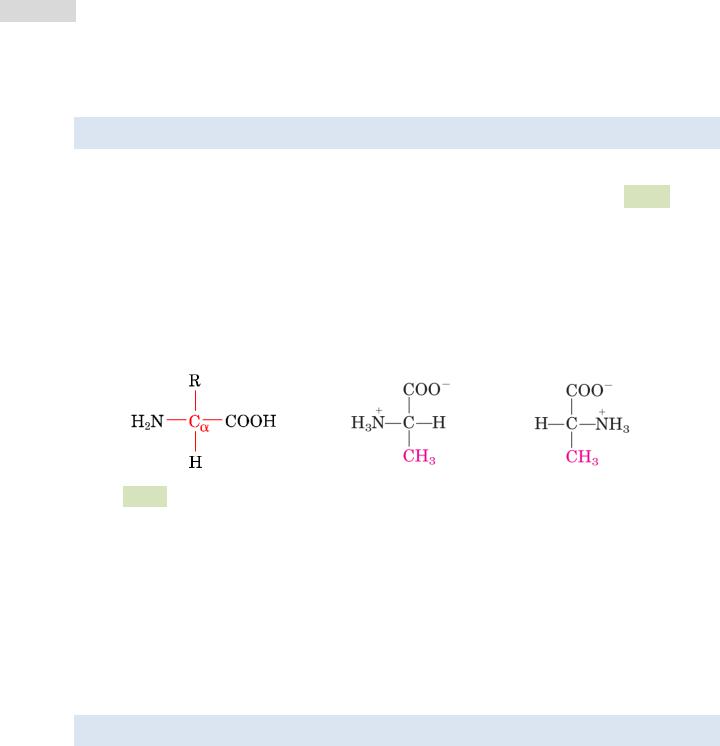
Аминокислоты — это органические соединения, содержащие карбоксильную группу (–COOH), аминогруппу (NH2–) и боковую цепь — радикал (см. Рис. 1 ▼). Их
назвали так потому, что они являются аминопроизводными карбоновых кислот. Аминокислоты — мономеры, из которых состоят белки. Различия между ами-
нокислотами объясняются свойствами их радикалов. Все аминокислоты кроме глицина существуют в двух формах — L- и D-форме. Эти стереоизомеры являются зеркальными отражениями друг друга и отличаются положением атомов в пространстве. В белках обнаруживают, как правило, лишь L-аминокислоты, однако в природе существуют и D-аминокислоты.
Рис. 1. Общая структурная формула аминокислоты (слева) и стереоизомеры ами-
нокислоты аланин (в центре и справа): в центре — L-аланин, а справа — D-аланин.
Белки принимают участие во многих клеточных процессах, выполняя самые различные функции. Белки — самые многочисленные биологические макромолекулы, обнаруживаемые в клетке. Разнообразие белков очень велико: в одной клетке могут находиться тысячи видов белков. Все белки строятся из 20 аминокислот: белковая (полипептидная) цепь представляет собой их линейную последовательность. Аминокислоты связаны между собой с помощью пептидных связей (ковалентные амидные связи).
1.2 Классификация аминокислот
Аминокислоты классифицируют исходя из свойств их боковых цепей: полярности и наличия кислых или осно́вных групп в составе самого радикала (см. таблицу ниже).
1.Неполярные аминокислоты — это аминокислоты с неполярными радикалами; их боковые цепи имеют алифатическую или ароматическую природу: глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан и метионин.
2.Полярные незаряженные аминокислоты — это аминокислоты с электро-
нейтральными радикалами, содержащими атомы кислорода, азота или серы: серин, треонин, тирозин, цистеин, глутамин и аспарагин.
3.Полярные заряженные отрицательно (кислые аминокислоты) — это аминокислоты, имеющие карбоксильную группу в составе радикала —

Классификация аминокислот 5
глутаминовая кислота (глутамат) и аспарагиновая кислота (аспар-
тат).
4. Полярные заряженные положительно (осно́вные аминокислоты) — это аминокислоты с осно́вными боковыми цепями: гистидин, лизин, ар-
гинин.
Существуют и другие принципы классификации аминокислот. В основе одного из них — деление аминокислот на гидрофобные, гидрофильные и амфипатические (одна часть молекулы гидрофобна, а другая — гидрофильна):
1.Гидрофобные аминокислоты: аланин, глицин, валин, лейцин, изолейцин, фенилаланин, пролин.
2.Гидрофильные аминокислоты: аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, гистидин, серин, треонин.
3.Амфипатические аминокислоты: лизин, метионин, триптофан, тиро-
зин.
Лизин может быть отнесён к амфипатическим аминокислотам, поскольку его радикал состоит из алифатической боковой цепи, которая может взаимодействовать с гидрофобными аминокислотами в составе белковой цепи, и аминогруппы, положительно заряженной при физиологических pH. Метионин — наименее полярная из амфипатических аминокислот, но атом серы в составе его радикала способен эффективно взаимодействовать с ионами металлов в белках. Цистеин может быть депротонирован при pH > 7. Образующийся при данном депротонировании тиоловый анион является самым сильным нуклеофильным агентом среди всех 20 биогенных аминокислот.
5

6 Глава 1 Аминокислоты и белки
|
Таблица 1 |
|
|
Биогенные аминокислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Название аминокислоты |
|
|
Структурная |
|
|
|
Молекулярная |
|
|
Средняя частота |
|
|
pK1 |
|
|
|
pK2 |
|
|
|
pKR |
|
|
|
Трёхбуквенный код |
|
|
|
|
|
|
|
встречаемости |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
формула1 |
|
|
|
масса2 |
|
|
|
|
α-COOH |
|
|
|
α-NH3 |
|
|
|
Радикала |
|
|||
|
Однобуквенный код |
|
|
|
|
|
|
|
в белках3 |
(%) |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Аминокислоты с неполярными радикалами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глицин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gly |
|
|
|
|
75 |
|
7,1 |
|
|
2,35 |
|
|
9,78 |
|
|
|
|
|
|||||
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аланин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ala |
|
|
|
|
89,1 |
|
8,3 |
|
|
2,35 |
|
|
9,87 |
|
|
|
|
|
|||||
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Val |
|
|
|
|
117,1 |
|
6,9 |
|
|
2,29 |
|
|
9,74 |
|
|
|
|
|
|||||
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лейцин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Leu |
|
|
|
|
131,2 |
|
9,7 |
|
|
2,33 |
|
|
9,74 |
|
|
|
|
|
|||||
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изолейцин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ile |
|
|
|
|
131,2 |
|
6,0 |
|
|
2,32 |
|
|
9,76 |
|
|
|
|
|
|||||
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Метионин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Met |
|
|
|
|
149,2 |
|
2,4 |
|
|
2,13 |
|
|
9,28 |
|
|
|
|
|
|||||
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
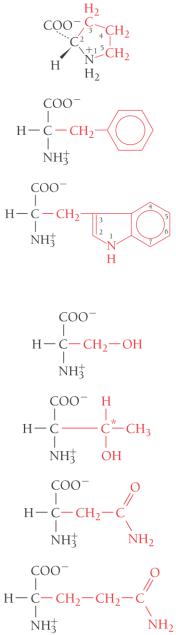
Классификация аминокислот |
|
|
|
|
7 |
|||
|
|
|
|
|
|
|
|
|
|
Пролин |
|
|
|
|
|
|
|
|
|
Pro |
|
115,1 |
|
4,7 |
1,95 |
10,64 |
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фенилаланин |
|
|
|
|
|
|
|
|
|
Phe |
|
165,2 |
|
3,9 |
2,20 |
9,31 |
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Триптофан |
|
|
|
|
|
|
|
|
|
Trp |
|
204,2 |
|
1,1 |
2,46 |
9,41 |
|
|
|
W |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аминокислоты с полярными незаряженными радикалами |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Серин |
|
|
|
|
|
|
|
|
|
Ser |
|
105,1 |
|
6,5 |
2,19 |
9,21 |
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Треонин |
|
|
|
|
|
|
|
|
|
Thr |
|
119,1 |
|
5,3 |
2,09 |
9,10 |
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аспарагин |
|
|
|
|
|
|
|
|
|
Asn |
|
132,1 |
|
4,0 |
2,14 |
8,72 |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глутамин |
|
|
|
|
|
|
|
|
|
Gln |
|
146,1 |
|
3,9 |
2,17 |
9,13 |
|
|
|
Q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
8 |
|
Глава 1 |
Аминокислоты и белки |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
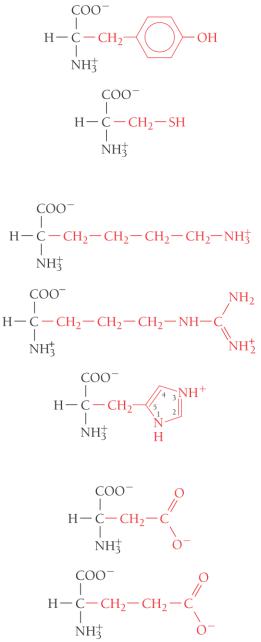
Тирозин |
|
|
|
|
|
|
|
|
|
|
|
|
Tyr |
|
|
181,2 |
2,9 |
|
2,20 |
|
9,21 |
|
10,46 |
|
|
Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цистеин |
|
|
|
|
|
|
|
|
|
|
|
|
Cys |
|
|
121,1 |
1,4 |
|
1,92 |
|
10,70 |
|
8,37 |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аминокислоты с полярными положительно заряженными радикалами |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лизин |
|
|
|
|
|
|
|
|
|
|
|
|
Lys |
|
|
146,2 |
5,9 |
|
2,16 |
|
9,06 |
|
10,54 |
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аргинин |
|
|
|
|
|
|
|
|
|
|
|
|
Arg |
|
|
174,2 |
5,5 |
|
1,82 |
|
8,99 |
|
12,48 |
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гистидин |
|
|
|
|
|
|
|
|
|
|
|
|
His |
|
|
155,1 |
2,3 |
|
1,80 |
|
9,33 |
|
6,04 |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аминокислоты с полярными отрицательно заряженными радикалами |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
Аспарагиновая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
Asp |
|
|
133,1 |
5,4 |
|
1,99 |
|
9,90 |
|
3,90 |
|
|
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глутаминовая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
Glu |
|
|
147,1 |
6,8 |
|
2,10 |
|
9,47 |
|
4,07 |
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
1 В таблице приведены структурные формулы ионизированных аминокислот при физиологических значениях pH (кроме гистидина, для него pH ≈ 6). |
|
|||||||||
|
|
2 Значения молекулярной массы выражены в дальто́ нах (Да). 1 дальтон = 1 г/моль. |
|
|
|
|
|
|
|
|||
|
|
3 Данные о средней частоте встречаемости в белках взяты из базы данных SWISS-PROT (http://www.expasy.ch/sprot/relnotes/relstat.html). |
|
|
|
|||||||
