
- •Теория комплексных соединений.
- •Основные положения теории комплексных соединений а. Вернера
- •Комплексы могут быть:
- •Номенклатура комплексных соединений.
- •Метод валентных связей в описании комплексных соединений.
- •Диссоциация комплексных соединений
- •Изомерия комплексных соединений
- •Хелатные комплексы
Теория комплексных соединений.
План
Основные положения теории комплексных соединений А. Вернера
Классификация и номенклатура комплексных соединений
Метод валентных связей в описании комплексных соединений.
Изомерия комплексных соединений
Диссоциация комплексных соединений.
Хелаты и комплексоны.
Основные положения теории комплексных соединений а. Вернера
После создания учения о валентности, все соединения условно стали разделять на: простые или атомные, или первого порядка, и комплексные или молекулярные или высшего порядка. Такое деление вызвано прежде всего тем, что многие молекулы уже с реализованными химическими связями способны вступать в дальнейшее взаимодействие с образованием более сложных соединений, проявляющих абсолютно новые химические свойства, нехарактерные для соединений первого порядка. Такие соединения получили названия комплексных.
В настоящее время не существует какого либо однозначного определения этих соединений, которые могло полно охарактеризовать их структуру и химические свойства.
Некоторые из них:
Комплексными называются определенные молекулярные соединения, при сочетании компонентов которых образуются положительно или отрицательно заряженные ионы, способные к существованию, как в кристалле, так и в растворе.
Комплексными называются молекулярные соединения, не показывающие в растворе всех свойств характерных для их соединений первого порядка.
Комплексными называются соединения, в узлах кристаллов которых находятся комплексные ионы, способные самостоятельно существовать в растворах.
Комплексные соединения – это самый обширный класс неорганических соединений, имеющих огромное биологическое значение: хлорофиллы в растениях, гемоглобин у животных, различные цитохромы, витамины.
Первой удачной теорией, позволяющей объяснить образование комплексных соединений из валентнонасыщенных простых молекул, была координационная теория Альфреда Вернера, предложенная в 1893 году.
Согласно этой теории, атомы могут проявлять не только обычную «главную» валентность (число электронов, которые принимают участие в образование химической связи по обменному механизму), но и «побочную», связанную с наличием вакантных атомных орбиталей или не поделенных электронных пар. Главная валентность у катионов металлов насыщается только противоионами, побочная противоионами или нейтральными молекулами.
Главная и побочная валентность в комплексном ионе не различаются по своей природе. В частности все атомы водорода в катионе аммония одинаковы как по расположению, так и по энергии связи.
В каждом комплексном ионе имеется центральный атом, вокруг которого располагаются координированные им ионы или нейтральные молекулы. Внутренняя сфера комплекса всегда обозначается [ ]. Общая формула внутренней сферы комплекса выглядит следующим образом:
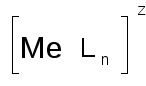
Ме – ион- комплексообразователь
L– координированная частица (ион или нейтральная молекула).
z- заряд внутренней сферы
Число ионов или молекул, которые координированы вокруг центрального атома, называется координационным числом. К.Ч. связано с зарядом центрального атома.
Заряд +1 +2 +3 +4
К.Ч. 2 2, 4 4, 6 8
Координированные атомы, ионы или молекулы находящиеся вокруг центрального атома называются лигандами или адендами. Совокупность центрального атома и лигандов называется внутренней сферой. Если внутренняя сфера заряжена, то имеется еще и внешняя сфера, которая представлена противоионом. В целом молекула комплексного соединения электронейтральна.
