
Теория комплексных соединений
.pdf
Теория комплексных соединений.
План Основные положения теории комплексных соединений А. Вернера
Классификация и номенклатура комплексных соединений
Метод валентных связей в описании комплексных соединений. Изомерия комплексных соединений Диссоциация комплексных соединений.
Хелаты и комплексоны.
Основные положения теории комплексных соединений А. Вернера
После создания учения о валентности, все соединения условно стали разделять на: простые или атомные, или первого порядка, и комплексные или молекулярные или высшего порядка. Такое деление вызвано прежде всего тем, что многие молекулы уже с реализованными химическими связями способны вступать в дальнейшее взаимодействие с образованием более сложных соединений, проявляющих абсолютно новые химические свойства, нехарактерные для соединений первого порядка. Такие соединения получили названия комплексных.
В настоящее время не существует какого либо однозначного определения этих соединений, которые могло полно охарактеризовать их структуру и химические свойства.
Некоторые из них:
Комплексными называются определенные молекулярные соединения, при сочетании компонентов которых образуются положительно или отрицательно заряженные ионы, способные к существованию, как в кристалле, так и в растворе.
Комплексными называются молекулярные соединения, не показывающие в растворе всех свойств характерных для их соединений первого порядка.
Комплексными называются соединения, в узлах кристаллов которых находятся комплексные ионы, способные самостоятельно существовать в растворах.
Комплексные соединения – это самый обширный класс неорганических соединений, имеющих огромное биологическое значение: хлорофиллы в растениях, гемоглобин у животных, различные цитохромы, витамины.
Первой удачной теорией, позволяющей объяснить образование комплексных соединений из валентнонасыщенных простых молекул, была координационная теория
Альфреда Вернера, предложенная в 1893 году.
1.Согласно этой теории, атомы могут проявлять не только обычную «главную» валентность (число электронов, которые принимают участие в образование химической связи по обменному механизму), но и «побочную», связанную с наличием вакантных атомных орбиталей или не поделенных электронных пар. Главная валентность у катионов металлов насыщается только противоионами, побочная противоионами или нейтральными молекулами.
Главная и побочная валентность в комплексном ионе не различаются по своей природе. В частности все атомы водорода в катионе аммония одинаковы как по расположению, так и по энергии связи.
2.В каждом комплексном ионе имеется центральный атом, вокруг которого располагаются координированные им ионы или нейтральные молекулы. Внутренняя сфера комплекса всегда обозначается [ ]. Общая формула внутренней сферы комплекса выглядит следующим образом:
|
|
|
z |
Me L |
|
|
Ме – ионкомплексообразователь |
|
|
L – координированная частица (ион или нейтральная |
|
|
|
|
|
|
n |
молекула). |
|
|
|
|
z- заряд внутренней сферы |
|
|
|
|
3.Число ионов или молекул, которые координированы вокруг центрального атома, называется координационным числом. К.Ч. связано с зарядом центрального атома.
Заряд |
+1 |
+2 |
+3 |
+4 |
К.Ч. |
2 |
2, 4 |
4, 6 |
8 |
4.Координированные атомы, ионы или молекулы находящиеся вокруг центрального атома называются лигандами или адендами. Совокупность центрального атома и лигандов называется внутренней сферой. Если внутренняя сфера заряжена, то имеется еще и внешняя сфера, которая представлена противоионом. В целом молекула комплексного соединения электронейтральна.
Комплексы могут быть:
а) катионные [Cu(NH3)4]2+ , [Co(H2O)6]2+, если внутренняя сфера является катоном; б) анионные [Al(OH)6]3-, [Fe(CN)6]4-, если внутренняя сфера является анионом;
в) нейтральные [Fe(CO)5], [Cr(NH3)3Cl3], если внутренняя сфера не несет заряда; В зависимости от того, чем представлен лиганд, выделяют:
Аквакомплексы – в качестве лиганда выступает молекула воды Н2О;
Ацидокомплексы- в качестве лиганда выступают анионы кислот (Cl-, NO2-, SO42- и т.д.); Аммиакаты - если лигандом выступает молекула аммиака (NH3);
Амминаты - если лиганд содержит аминогруппу (NH2); Карбонилы - если лиганд представлен группой (СО); Гидроксокомплексы - если лиганд гидроксогруппа ОН- .
Номенклатура комплексных соединений.
1)Комплексные соли называются также как обычные - анион, потом катион
[Cr(NH3)6](NO3)3 - нитрат гексамминхрома(III)
2) Лиганды называются следующим образом:
нейтральные - как молекулы, кроме H2O - аква, NH3 - аммин;
анионы - суффикс “o” - хлоро, нитро; сульфито; сульфато
катионы - суффикс “иум” - гидразиниум.
3) Порядок лигандов: сначала анионы, потом нейтральные молекулы, и наконец, катионы. Внутри каждой группы в порядке увеличения сложности.
[Pt(NH3)4(NO2)Cl]SO4 - сульфат хлоронитротетрамминплатины (IV) (NH4)[Cr(NH3)2(NCS)4] – тетраизотиоцианатодиамминхромат (III) аммония.
4) Числовые приставки - ди-, три-, тетра-, пента-, гекса- … Но если в названии лиганда присутствует уже диили три-, (этилендиамин), для благозвучия договорились количество лигандов обозначать бис-, трис-, тетракис-.
K3[Al(C2O4)3] - триоксалатоалюминат(III) калия, но
2
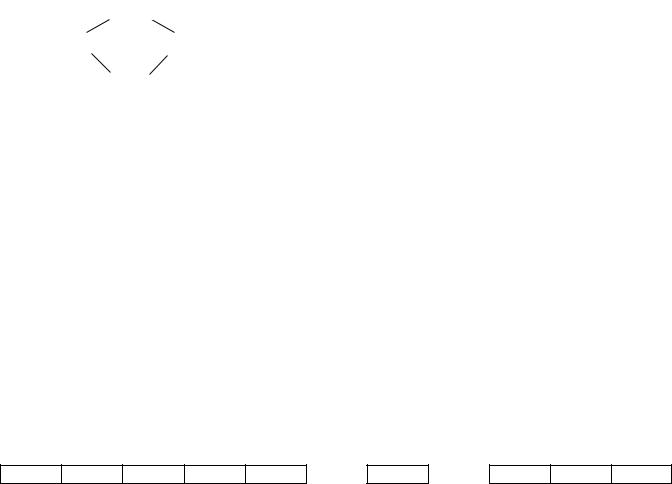
[Co(en)2Cl]SO4 - сульфат хлоро-бис-этилендиаминкобальта(III)
5) Окончания - анионные комплексы кончаются на -ат, как обычные анионы, катионные - как обычные катионы, нейтральные - как металл.
Сa2[Fe(CN)6] - гексацианоферрат(II) кальция,
[Fe(H2O)6]SO4 - сульфат гексаакважелеза(II),
[Ni(СО)4] - тетрокарбонилникель(II)
6) Степень окисления металла (высчитывается из общей электронейтральности всей молекулы комплексного соединения) - римские цифры в скобках. Но в комплексах бывают и необычные степени окисления металлов - 0, -1. Они пишутся арабскими цифрами.
Na[Co(CO)4] - тетракарбонилкобальтат(-1) натрия.
В зависимости от того сколько связей образует лиганд с центральным атомом различают монодентантные, би и полидентантые лиганды. Многие многоатомные лиганды способны образовывать координационную связь с комплексообразователем разными атомами. Такие лиганды получили названия амбидентантных. Например: анион NCS- способен образовывать связь азотом и серой.
Существует еще одна разновидность лигандов – мостиковые К таким лигандам могут относится частицы, имеющие несколько атомов доноров, либо
несколько донорных электронных пар в одном атоме: NCS-, I-, OH-, NH2- Такие лиганды связывают комплоексообразователи между собой.
|
|
|
|
NH - |
|
|
На рисунке изображен двуядерный комплекс где |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
мостиковые лиганды NH2- и OH- два иона- |
||
|
|
|
2 |
|
|
|
комплексообразователя (Со3+) |
|
(NH ) |
Co |
|
OH- |
|
Co(NH ) |
|||
|
|
|
||||||
3 3 |
|
|
|
|
3 3 |
|
||
|
|
|
NH - |
|
|
|
||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Метод валентных связей в описании комплексных соединений.
Комплексными называются соединения, имеющие хотя бы одну связь, образованную по донорно-акцепторному механизму.
Согласно методу ВС каждый лиганд является донором электронов, а комплексообразователь – акцептором электронов. Лиганд размещает свои электроны на вакантных атомных орбиталях комплексообразователя. Пространственное расположение лигандов зависит от типа гибридизации центрального атома.
Sp3d2 – октаэдр Spd2 –квадрат Sp3 – тетраэдр
Естественно, что при этом метод ВС рассматривает образование только сигма – связей.
Примеры: |
|
|
|
|
Комплексный ионн гексаамминохрома(III) |
|
|
||
[Cr(NH3)6]3+ |
|
|
|
|
Электронная конфигурация атома хрома 3d54s14p0 иона хрома 3d34s04p0 |
|
|||
|
|
3d |
4s |
4p |
↑ |
↑ |
↑ |
|
|
3
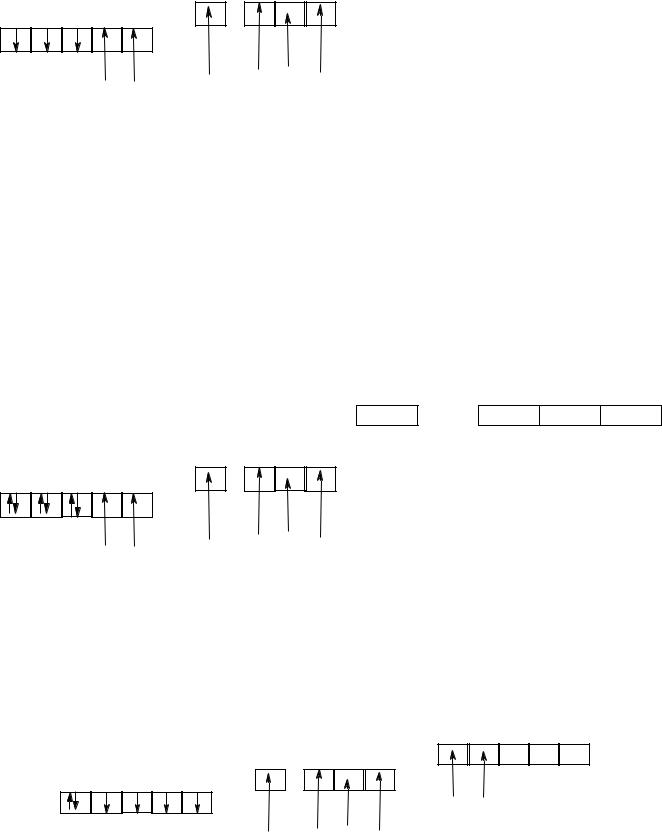
Согласно методу ВС этот комплекс должен быть парамагнитен, так как содержит три не спаренных электрона. Для образования координационной связи используются 2 –d, 1-s, 3 –p орбитали атома хрома , где он выступает в роли акцептора. Азот в аммиаке, имея не поделенную электронную пару, выступает в роли донора.
4s 4p
3d
NH |
NH |
NH3 NH3 |
NH |
|
NH3 |
|
3 |
||
3 |
|
3 |
|
|
Так как в процессе образования связи число неспаренных электронов в атоме хрома остается постоянным, то такой комплекс называется спин-свободным или высокоспиновым.
[Co(NH3)6]3+
Ион гексо амминокобальта (III)
Электронная конфигурация кобальта 3d74s24p0, иона кобальта (+3) 3d64s04p0
|
|
3d |
|
|
|
4s |
|
4p |
||
↑↓ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|
|
Чтобы в комплексе было октаэдрическое строение и возможно присоединение шести лигандов необходимо освободить две ячейки. Это возможно осуществить двумя путями:
-промотировать два электрона на более высокий энергетический уровень на пример на 4d или 5s
-спарить, что энергетически более выгодно 3d электроны.
3d |
4s |
4p |
↑↓ |
↑↓ |
↑↓ |
|
|
В освобожденных орбиталях располагают свои электронные пары атомы азота.
3d
NH |
NH |
NH3 NH3 |
NH |
|
NH3 |
|
3 |
||
3 |
|
3 |
|
|
Данный комплекс относится к числу спин-спаренных или низкоспиновых комплексов. Однако, не все октоэдрические комплексы кобальта построены так гексоамминат.
Например гексофторособальт (III) [Co(F)6]3+ является спин-свободным или высокоспиновым. Также он проявляет парамагнитные свойства. Для описания этого явления выводится понятия внутри и внешнеорбитальных комплексов.
Выше рассмотренные комплексы относятся к типу внутриорбитальных, так как в образовании координационной связи принимают участие орбитали предвенешнего подуровня.
Для внешнеорбитальных комплексов характерно участие только внешних орбиталей
4d
4s 4p
3d
F F
F F F F
4
Большинство внешнеорбитальных комплексов являются спин-свободными (высокоспиновыми) и парамагнитными.
Диссоциация комплексных соединений
В водных растворах комплексные соединения подвергаются диссоциации
[Cr(H2O)6]Cl3 = [Cr(H2O)6]3+ + Cl-
Наряду с этим комплексный ион так же подвергается распаду на составные части
[Cr(H2O)6]3+ = Сr3+ + 6H2O
Так как в этой системе наступает состояние динамического равновесия, то к нейприменим закон действующих масс:
К р |
|
Сr3 H |
O 6 |
К нест 9.8 10 9 |
||
Cr(H |
2 |
|
3 |
|||
|
|
O) |
|
|
|
|
|
|
2 |
6 |
|
|
|
Чем меньше значение константы нестойкости, тем прочнее комплекс.
Величина обратная константе нестойкости, называется константой устойчивости. Для большинства комплексов этих параметры определены и отображены в химических справочниках.
Изомерия комплексных соединений
1)Ионизационная [Co(NH3)5Br]SO4 - [Co(NH3)5SO4]Br
2)Координационная [Co(NH3)6] [Cr(C2O4)3] - [Cr (NH3)6] [Co(C2O4)3]
3)Связевая [(NH3)5Co-NO2]Cl2 - [(NH3)5Co-ONO]Cl2
4)Гидратная [Cr(H2O)6]Cl3 - [Cr(H2O)5Cl]Cl2×H2O
5)Пространственная - цистрансизомерия
Хелатные комплексы
Особое место среди комплексных соединений занимают так называемые внутрикомплексные соединения. По типу этих соединений построены многочисленные металлпротеиды: гемоглобин, хлорофилл и др.
Хелатные или клешневидные комплексы построены по типу циклических соединений, в которых существуют два типа связей: ионные и координационные. Т.Е. лиганд образует с ионом-комплексообразователем как ионную, так и координационную связь.
Типичным примером таких комплексов является гиколят меди [Cu(NH2CH2COO)2]
5

[Cu(NH2CH2COO)2]
H2N CH2 COO -
 Cu2+
Cu2+
-OOC CH2 NH2
В аналитической практике широко применяются вещества способные образовывать различные внутрикомплексные соединения. Наиболее широкое применение получили предложенные в 1944 г. Шварценбахом аминополикарбоновые кислоты, названн ые комплексонами:
Комплексон I – нитрилотриуксусная кислота
CH2COOH N CH2COOH CH2COOH
Комплексон II –этилендиаминтетроуксусная кислота
HOOCH2C |
|
|
|
CH2COOH |
||
N |
|
CH2 |
|
CH2 |
|
N |
|
|
|
||||
HOOCH2C |
|
|
|
CH2COOH |
||
Комплексон III – этилендиаминтетроацетат натрия
HOOCH2C |
|
|
|
CH2COONa |
||
N |
|
CH2 |
|
CH2 |
|
N |
|
|
|
||||
NaOOCH2C |
|
|
|
CH2COOH |
||
Трилон Б – один из самых применимых химических реактивов в аналитической химии, т.к. он обладает способностью связывать в прочные комплексы большинство металлов. На рисунке приведена структура этилендиаминтетроацетата меди (II)
|
H2 |
H2 |
CH2COOH |
||
HOOCH2C |
C |
|
C |
||
|
|||||
N |
|
N |
|||
H2C |
|
||||
|
|
2+ |
CH2 |
||
|
Cu |
|
|
||
COO |
|
|
|
||
|
OOC |
||||
|
|
|
|
||
Комплексон IV –диаминциклогексантетроуксусная кислота.
CH2COOH
N
CH2COOH
N
CH2COOH
CH2COOH
6
