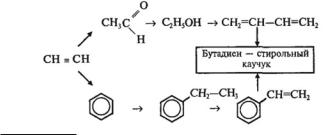
5.Назовите вещества, которые получаются в результате присоединения к 1 молю изопрена: а) одного моля Br2, б) двух молей Br2.
6.Из каких мономеров можно получить полимеры указанного строения:
а) (–СН –С==С–СН –) |
|
б) (–СН –С=СН–СН |
–) |
|
2 |
| | |
2 |
n |
2 |
| |
2 |
|
n |
|
CH3 СН3 |
|
|
|
СН3 |
|
|
|
в) (–СН–СН=СН–СН–)n
||
CH3 СН3 Назовите эти мономеры.
7.Сколько литров (молей) водорода необходимо для гидрирования
20 л смеси углеводорода С4Н8 и бутадиена-1,3 до бутана, если известно, что углеводород С4Н8, содержащийся в исходной смеси, получен (с выходом 80 %) дегидратацией 22,2 г спирта С4Н10О?
8.Сколько литров хлора потребуется для получения тетрахлорида
СnН2n_2Сl4 из 21,6 г диенового углеводорода СnН2n–2, если известно, что на бромирование одной двойной связи 16,2 г этого диена пошло
48 г брома?
§9.7. Алкипы (ацетиленовые УВ)
•Алкины — это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации
исвязаны друг с другом тройной связью: —С С—.
Общая формула: СпН2п–2, где п 2.
Длина связи С С в алкинах равна 0,120 нм.
Каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами и может присоединять еще два атома.
Гомологический ряд
Молекулярная |
Название алкена |
формула алкина |
Международная |
Рациональная |
CnH2n–2 |
номенклатура |
номенклатура |
С2Н2 |
Этин |
Ацетилен |
С3Н4 |
Пропин |
Метилацетилен |
С4Н6 |
Бутин |
|
C5H8 |
Пентин |
|