
- •Фармацевтический анализ по функциональным группам и общие титриметрические методы анализа
- •Часть I. Фармацевтический анализ по функциональным группам Введение
- •Анализ лекарственных веществ по фг Спиртовый гидроксил
- •Химические свойства
- •Реакции подлинности
- •VNaOh(контрольный опыт) - vNaOh(на определение)
- •Фенольный гидроксил
- •Карбонильная (альдегидная и кетонная) группа
VNaOh(контрольный опыт) - vNaOh(на определение)
fэкв (вещества)=1/n, где n – количество спиртовых гидроксилов в молекуле вещества. fэкв (ментола)=1.
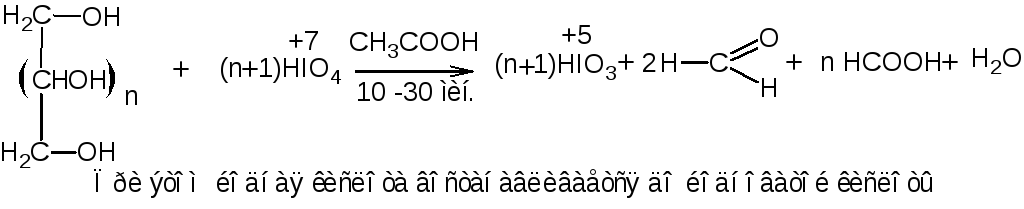
2. Перйодатный метод (для многоатомных спиртов). Основан на свойстве многоатомных спиртов окисляться йодной кислотой в кислой среде с образованием формальдегида и муравьиной кислоты по общей схеме:
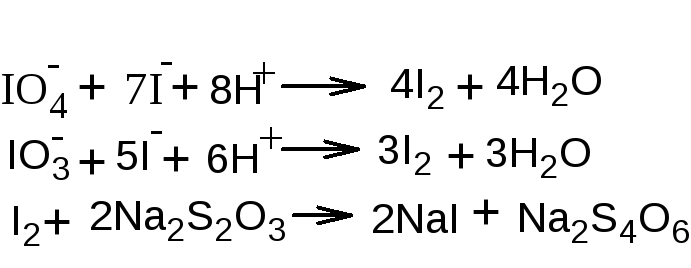 При окислении
двух групп
При окислении
двух групп
![]() образуются две молекулы формальдегида,
на что расходуется одна молекула йодной
кислоты, а из группы
образуются две молекулы формальдегида,
на что расходуется одна молекула йодной
кислоты, а из группы![]() получается муравьиная кислота, для
образования которой требуется также
одна молекула йодной кислоты. Избыток
йодной кислоты определяют йодометрическим
методом: прибавляют раствор калия йодида
и выделившийся йод титруют раствором
натрия тиосульфата (индикатор крахмал).
Параллельно проводят контрольный опыт.
При титровании раствора после окисления,
наряду с не вошедшим в реакцию перйодатом,
определяется также образовавшийся
йодат:
получается муравьиная кислота, для
образования которой требуется также
одна молекула йодной кислоты. Избыток
йодной кислоты определяют йодометрическим
методом: прибавляют раствор калия йодида
и выделившийся йод титруют раствором
натрия тиосульфата (индикатор крахмал).
Параллельно проводят контрольный опыт.
При титровании раствора после окисления,
наряду с не вошедшим в реакцию перйодатом,
определяется также образовавшийся
йодат:
Реакция среды должна быть кислая, чтобы не окислился йодом выделившийся формальдегид. В расчётах учитывают количество раствора натрия тиосульфата, израсходованное на определение и контрольный опыт: Vнатр. тиосульфата (контр. опыт) - Vнатр. тиосульфата (на определение спирта).
Фактор эквивалентности
зависит от числа гидроксильных групп
в молекуле спирта. Расчёт проводится
косвенным способом, по изменению степени
окисления реагента. Каждая молекула
реагента в ходе реакции принимает два
электрона
![]() .
.
1 молекула спирта
(n+1)
молекул
![]()
(n+1)
молекул
(n+1)
молекул![]()
fэкв
(спирта)=1/2(n+1),
где n
– число групп
![]() в молекуле спирта.
в молекуле спирта.
3. Куприметрический метод. Основан на свойстве спиртов образовывать с меди (II) сульфатом в щелочной среде устойчивые комплексные соединения (прямое титрование, индикатор – мурексид). Метод используется при внутриаптечном контроле препаратов хлорамфеникола (левомицетина).
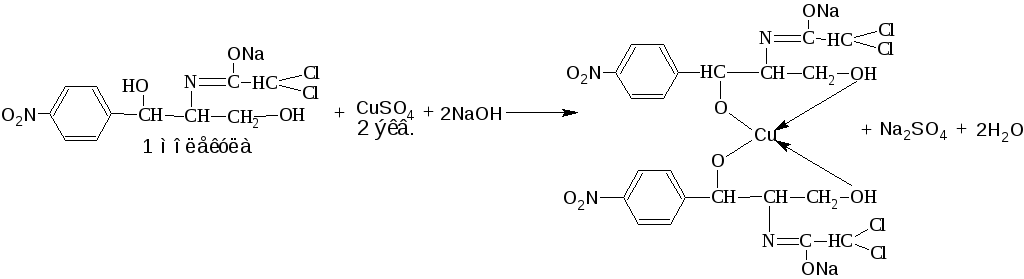
![]()
fэкв (хлорамфеникола)= 2
Фенольный гидроксил
 Гидроксил,
связанный с ароматическим циклом.
Гидроксил,
связанный с ароматическим циклом.
Химические свойства
1. Реакция этерификации (аналогично спиртовому гидроксилу).
2. Окислительно-восстановительные. Фенолы проявляют сильные восстановительные свойства, очень легко окисляется даже слабыми окислителями. Образуются окрашенные соединения хиноидной структуры.
3. Кислотно-основные. Электронная пара гидроксила смещена в сторону ароматического цикла, поэтому кислотные свойства более сильные, чем у спиртов (рКа фенола 9,89). Образуют соли со щелочами (при рН ~ 12-13), комплексные соединения с железа (III) хлоридом (в нейтральных, слабощелочных, кислых растворах).
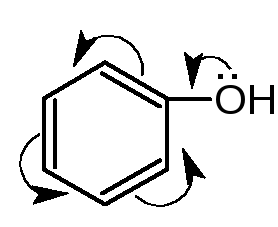
4. Реакции электрофильного замещения атома водорода в ароматическом кольце (бромирования, конденсации с альдегидами, сочетания с солями диазония, нитрования, нитрозирования, йодирования и др.) Способность фенолов вступать в реакции электрофильного замещения объясняется взаимодействием неподелённой электронной пары атома кислорода с - электронами бензольного кольца. Электронная плотность смещается в сторону ароматического кольца. Наибольший избыток электронной плотности наблюдается у атомов углерода в о- и п- положениях по отношению к фенольному гидроксилу (ориентанту 1 рода).
Реакции подлинности
1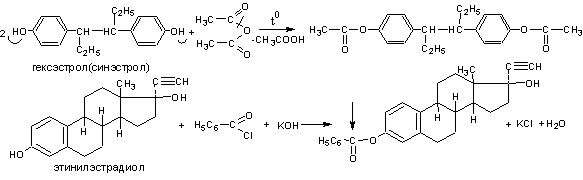 .Реакция
этерификации (ацилирования).
Реакция основана на свойстве фенолов
образовывать сложные эфиры (ацильные
производные) с ангидридами и
галогенангидридами кислот, выпадающие
в осадок и имеющие чёткую температуру
плавления.
.Реакция
этерификации (ацилирования).
Реакция основана на свойстве фенолов
образовывать сложные эфиры (ацильные
производные) с ангидридами и
галогенангидридами кислот, выпадающие
в осадок и имеющие чёткую температуру
плавления.
Методика. К 0,25 г гексэстрола (синэстрола) прибавляют 1 мл уксусного ангидрида и 2 мл безводного пиридина. Кипятят с обратным холодильником 15 минут, охлаждают, добавляют 50 мл воды и тщательно встряхивают. Осадок отфильтровывают, промывают водой, сушат при 100-105 и определяют температуру плавления. Температура плавления выделенного диацетата синэстрола 137-139С.
2. Реакции окисления. Примером реакции окисления является индофеноловая проба. Проба проводится в растворе аммиака при взаимодействии с такими окислителями, как хлорамин, хлорная известь, бромная вода.
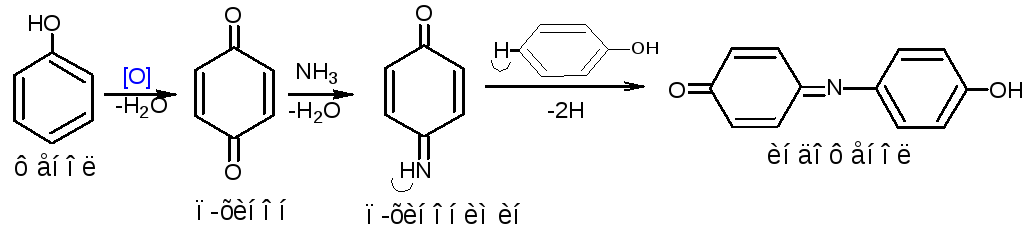
Методика. 0,05 лекарственного вещества (фенола, тимола, резорцина) растворяют в 0,5 мл раствора аммиака и добавляют 3-4 капли раствора хлорамина, нагревают смесь на кипящей водяной бане. Через несколько минут появляется окрашивание, изменяющееся при добавлении кислот. Фенол образует сине-зелёное окрашивание, переходящее при добавлении кислот в красное; тимол – слабо-розовое, переходящее в жёлтое; резорцин – буровато-желтое, переходящее в красное.
3. Реакция комплексообразования с ионами железа (III). В зависимости от количества фенольных гидроксилов, наличия в молекуле фенола других функциональных групп, их взаимного расположения, рН среды, температуры, образуются комплексные соединения различного состава и окраски (исключение составляет тимол). Фенол даёт синее окрашивание, резорцин - сине-фиолетовое, кислота салициловая - сине-фиолетовое или красно-фиолетовое, осалмид (оксафенамид) и натрия пара-аминосалицилат - красно-фиолетовое, хинозол - синевато-зелёное. Реакция является фармакопейной для большинства фенольных соединений.
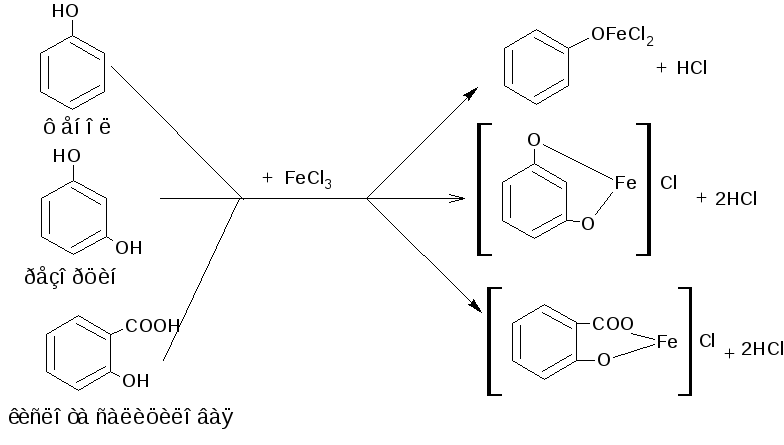
Методика. К 1 мл водного раствора (1:100) фенола, резорцина, хинозола, натрия пара-аминосалицилата, натрия салицилата, спиртового раствора парацетамола, осалмида (оксафенамида), кислоты салициловой прибавляют 2 капли раствора железа (III) хлорида; наблюдают эффект реакции.
4. Реакции электрофильного замещения.
4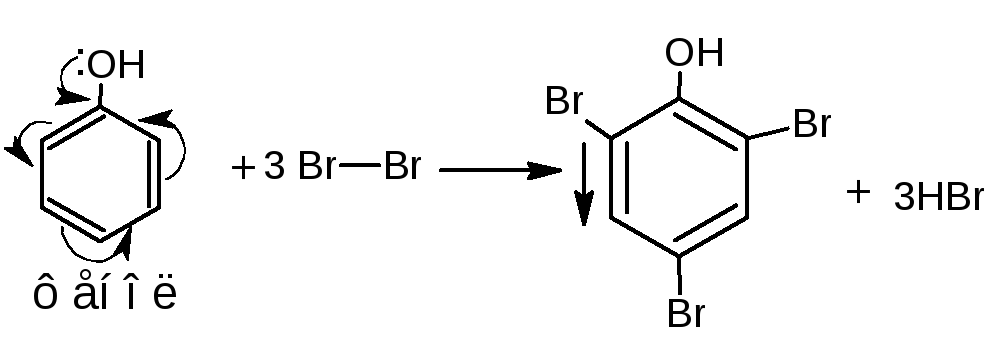 .1.Реакция
бромирования.
При бромировании бромной водой образуются
белые или желтые осадки бромпроизводных.
.1.Реакция
бромирования.
При бромировании бромной водой образуются
белые или желтые осадки бромпроизводных.
При наличии заместителей в о- и п-положениях ароматического кольца в реакцию вступают незамещённые атомы водорода ароматического кольца:
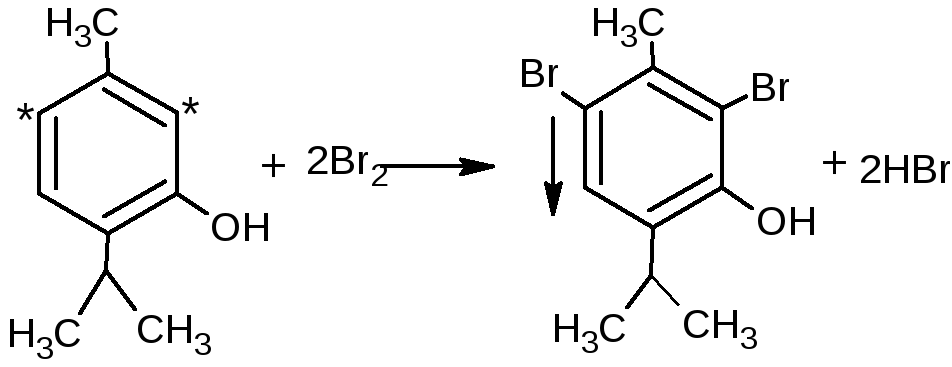
Если в о- и п-положениях по отношению к фенольному гидроксилу находится карбоксильная группа, то при действии избытка брома происходит декарбоксилирование:
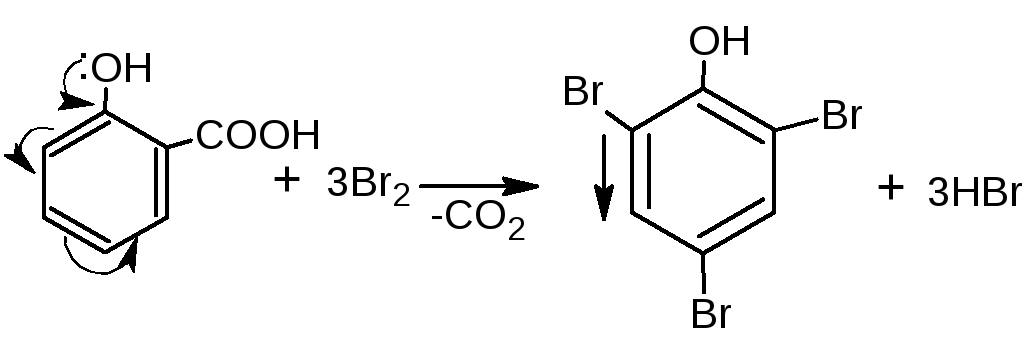
Е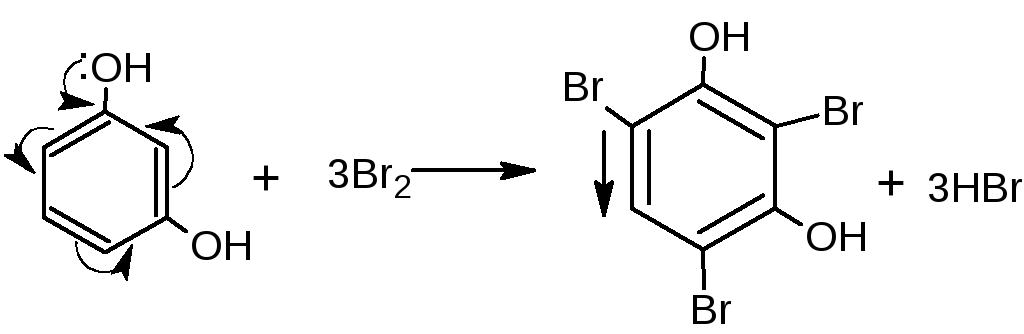 сли
соединение содержит два фенольных
гидроксила в м-положении, то при действии
брома образуются трибромпроизводные
(согласованная ориентация):
сли
соединение содержит два фенольных
гидроксила в м-положении, то при действии
брома образуются трибромпроизводные
(согласованная ориентация):
Если две гидроксильные группы расположены по отношению друг к другу в о- или п-положениях, то реакция бромирования не протекает (несогласованная ориентация):
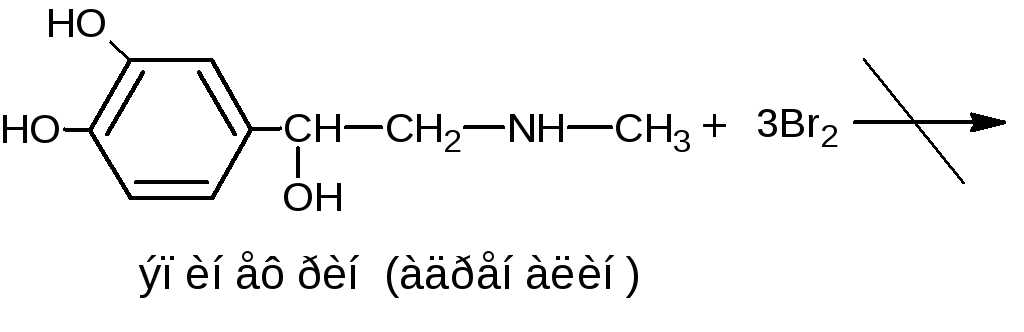
Методика. К водному или спиртовому раствору (1:100-1:200) натрия салицилата, натрия пара-аминосалицилата, резорцина, тимола, хинозола прибавляют несколько капель бромной воды и разведённой серной кислоты; образуются осадки бромпроизводных.
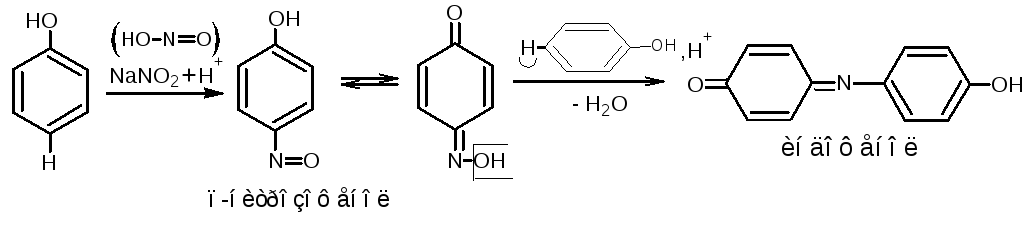 4.2.Реакция
нитрозирования (нитрозореакция
Либермана).
Реакция характерна для фенолов, не
имеющих заместителей в о- или п- положениях.
При действии нитрита натрия в кислой
среде образуется п-нитрозофенол,
изомеризующийся в монооксим п- бензохинона,
который, реагируя с избытком фенола в
кислой среде, даёт индофенол. Реакцию
нитрозирования можно рассматривать
как разновидность индофеноловой реакции
(см. «Фенолы», п.2).
4.2.Реакция
нитрозирования (нитрозореакция
Либермана).
Реакция характерна для фенолов, не
имеющих заместителей в о- или п- положениях.
При действии нитрита натрия в кислой
среде образуется п-нитрозофенол,
изомеризующийся в монооксим п- бензохинона,
который, реагируя с избытком фенола в
кислой среде, даёт индофенол. Реакцию
нитрозирования можно рассматривать
как разновидность индофеноловой реакции
(см. «Фенолы», п.2).
Методика. 0,01 г фенола, тимола, резорцина, гексэстрола (синэстрола) помещают на предметное стекло, смачивают 2-3 каплями 1% раствора натрия нитрита в концентрированной серной кислоте. Наблюдается окрашивание, изменяющееся при добавлении раствора щёлочи. Фенол образует тёмно-зелёное окрашивание, переходящее в вишнёво-красное; тимол - сине-зелёное, переходящее в фиолетовое; резорцин - фиолетово-чёрное, переходящее в фиолетовое; гексэстрол (синэстрол) - красно-фиолетовое, переходящее в вишнёвое.
4.3. Реакция нитрования. Фенолы вступают в реакцию с разведённой азотной кислотой при комнатной температуре с образованием о- и п- нитропроизводных. Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциируемой соли:
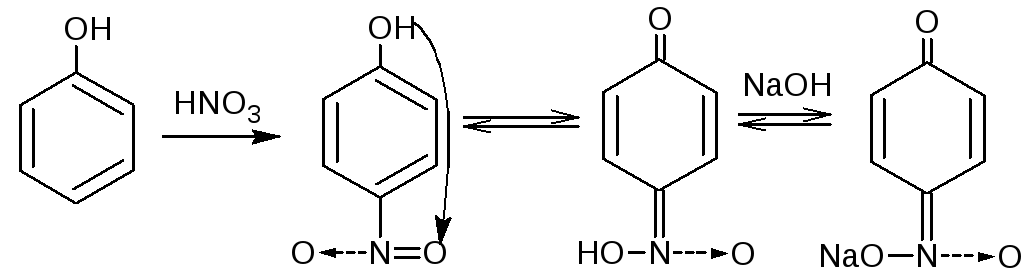
Методика. К 0,001 г лекарственного вещества (фенола, тимола, резорцина), растворённого в 2 мл воды или в 2 мл 95% спирта (синэстрол), добавляют 1-2 мл разведённой азотной кислоты и нагревают на водяной бане. Постепенно появляется жёлтое окрашивание.
4 .4.Реакция
азосочетания фенолов с солью диазония
в щелочной среде. При
взаимодействии фенолов с солью диазония
при рН 9-10 образуются азокрасители,
окрашенные в жёлто-оранжевый или красный
цвет. Реакция азосочетания протекает
в о- и п- положениях по отношению к
фенольному гидроксилу. В качестве
диазореактива обычно применяют
диазотированную сульфаниловую кислоту.
.4.Реакция
азосочетания фенолов с солью диазония
в щелочной среде. При
взаимодействии фенолов с солью диазония
при рН 9-10 образуются азокрасители,
окрашенные в жёлто-оранжевый или красный
цвет. Реакция азосочетания протекает
в о- и п- положениях по отношению к
фенольному гидроксилу. В качестве
диазореактива обычно применяют
диазотированную сульфаниловую кислоту.
Методика. К 1мл водного раствора (1:100) натрия салицилата, хинозола, натрия пара-аминосалицилата, резорцина; спиртового раствора кислоты салициловой, гексэстрола (синэстрола) добавляют 0,5 мл раствора аммиака и 4 капли диазореактива - наблюдается красное или оранжево-красное окрашивание.
4.5. Реакции конденсации с альдегидами.
4.5.1. Реакция с реактивом Марки. При нагревании фенолов с раствором формальдегида в присутствии концентрированной серной кислоты образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя.

Методика. Около 0,02 г лекарственного вещества (резорцина, кислоты салициловой, кислоты ацетилсалициловой) помещают в фарфоровую чашку, прибавляют 1 каплю формалина и 2-3 капли концентрированной серной кислоты. При стоянии или после лёгкого нагревания образуется красное окрашивание.
4.5.2. Реакция с хлороформом в щелочной среде. При нагревании фенолов с хлороформом в щелочной среде образуются аурины – трифенилметановые красители. Реакция является фармакопейной на тимол.
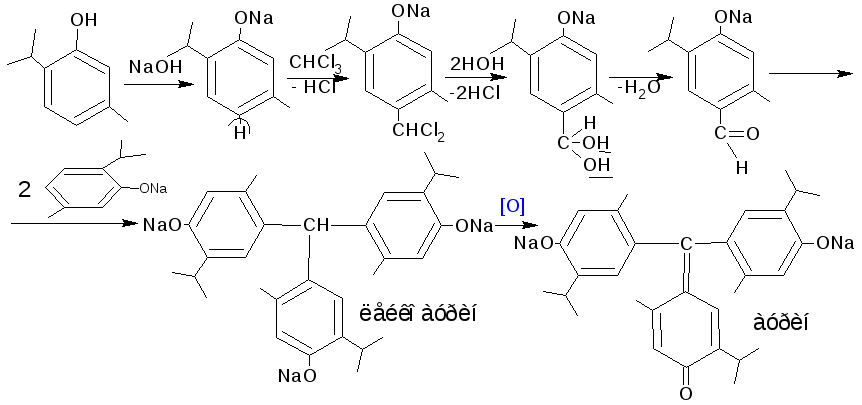
![]()
Методика. 0,2 г тимола или резорцина нагревают на водяной бане с 1 мл раствора натрия гидроксида. К подогретому раствору прибавляют 2-3 капли хлороформа и взбалтывают; появляется красно- фиолетовое окрашивание.
Количественное определение
1. Методы галогенирования. Основаны на реакции электрофильного замещения атомов водорода ароматического кольца на атомы галогена.
1.1.Броматометрический метод.
1.1.1. Прямое титрование раствором калия бромата в присутствии калия бромида (индикатор метиловый оранжевый или метиловый красный). В точке эквивалентности избыточная капля калия бромата образует бром, который необратимо окисляет индикатор и происходит обесцвечивание раствора. Метод является фармакопейным для тимола.
![]()

f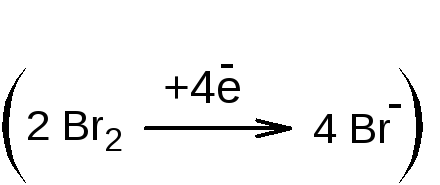 экв
(тимола)=1/4,
т.к. 1 молекула тимола взаимодействует
с двумя молекулами брома, которые
соответствуют 4 экв.
экв
(тимола)=1/4,
т.к. 1 молекула тимола взаимодействует
с двумя молекулами брома, которые
соответствуют 4 экв.
В общем виде: fэкв (вещества)=1/n, где n – число атомов галогена, реагирующих с одной молекулой вещества.
1.1.2. Обратное титрование. К лекарственному веществу добавляют избыток титрованного раствора калия бромата и калия бромид, раствор подкисляют серной или хлороводородной кислотой. Образующийся бром вступает в реакцию электрофильного замещения с фенолом. Через 10-15 минут избыток брома определяют йодометрическим методом: добавляют калия йодид
и выделившийся йод титруют раствором натрия тиосульфата (индикатор - крахмал). Иногда вместо крахмала применяют хлороформ – в этом случае титруют при сильном взбалтывании раствора до обесцвечивания хлороформного слоя. Обратное титрование используется, согласно ФС, для определения фенола, кислоты салициловой, раствора гексэстрола (синэстрола) в масле для инъекций.
![]()

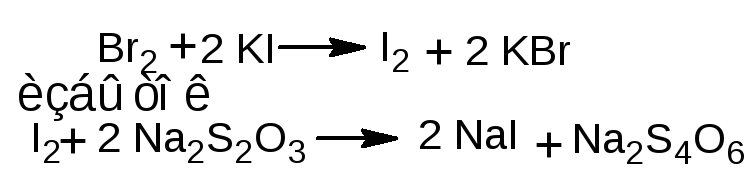
fэкв (резорцина, фенола, кислоты салициловой)=1/6; fэкв (гексэстрола)=1/8.
1.2. Йодометрический метод (прямое и обратное титрование). Т.к. реакция йодирования является обратимой, определение проводят в присутствии натрия гидрокарбоната или натрия ацетата для связывания выделяющегося йодоводорода.

fэкв (фенола)=1/ 6
П![]() ри
прямом титровании титруют до синего
окрашивания, при обратном - избыток йода
оттитровывают раствором натрия
тиосульфата до обесцвечивания (индикатор
- крахмал).
ри
прямом титровании титруют до синего
окрашивания, при обратном - избыток йода
оттитровывают раствором натрия
тиосульфата до обесцвечивания (индикатор
- крахмал).
1.3. Йодхлорметрический метод (обратное титрование). При взаимодействии фенолов с йодмонохлоридом образуются йодпроизводные фенолов. Избыток йодмонохлорида определяют йодометрическим методом: прибавляют калия йодид и выделившийся йод титруют раствором натрия тиосульфата (индикатор крахмал). Йодмонохлорид, в отличие от брома, на вытесняет карбоксильную группу, находящуюся в о- и п- положениях по отношению к фенольному гидроксилу.
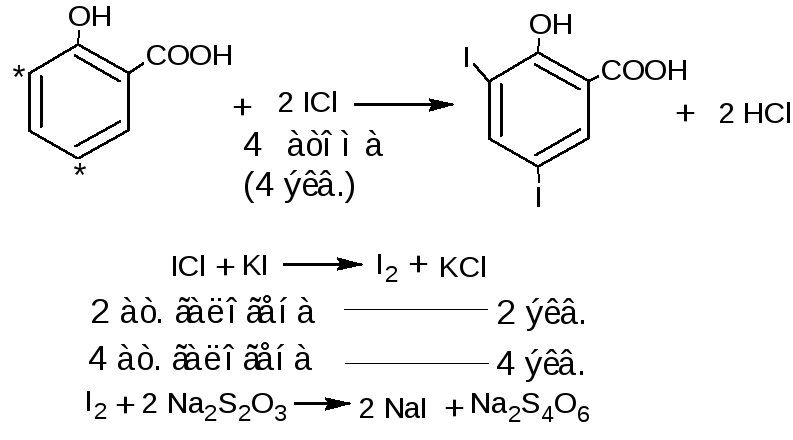
fэкв (кислоты салициловой)=1/4
2.Метод ацетилирования. Основан на свойстве фенолов образовывать при взаимодействии с уксусным ангидридом нерастворимые сложные эфиры.
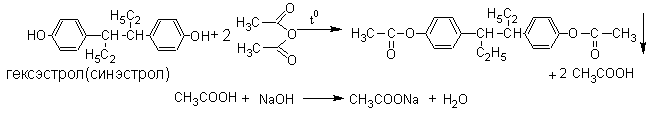
Метод является фармакопейным для гексэстрола (синэстрола). Условия определения и способы расчёта указаны в методах количественного определения спиртов (п.1).
3.Фотоколориметрический и спектрофотометрический методы с использованием цветных реакций (комплексообразования с железа (III) хлоридом, азосочетания с солями диазония и др.)
