
fizika / Мицелла
.docxСтроение коллоидных частиц
-
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[BaSO4]∙nSO42-∙2(n-x)H+}2x-∙2xH+ - мицеллярная формула

 агрегат
агрегат
ядро
 гранула
гранула
-
AgNO3 + KBr → AgBr↓ + KNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[AgBr]∙ nAg+∙ (n-x)NO3-}x+ ∙ xNO3- - мицеллярная формула

 агрегат
агрегат
ядро
 гранула
гранула
Стабилизаторами являются ионы (n-x)NO3-
-
H2S + ZnCl2 → ZnS↓ + 2HCl


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[ZnS]∙nS2-∙2(n-x)H+}2x-∙2xH+ - мицеллярная формула
 агрегат
агрегат
 ядро
ядро
 гранула
гранула
В зависимости от условий получения, гранулы золя заряжаются либо положительно, либо отрицательно. При избытке H2S гранулы имеют отрицательный заряд, поскольку в этом случае потенциалопределяющими ионами являются ионы nS2-. Противоионы – nH+ располагаются в количестве 2(n - х) в адсорбционном слое и в количестве 2х - в диффузионном.
-
AgNO3 + NaJ AgJ↓ + NaNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[AgJ]∙ nJ-∙ (n-x)Na+}x- ∙ xNa+ - мицеллярная формула
 агрегат
агрегат
 ядро
ядро
 гранула
гранула
На поверхности ядра из дисперсионной внешней среды адсорбируются ионы того или иного знака. Их называют ионогенными группами или ионами, определяющими потенциал. В нашем случае это ионы (n-x)Na+
-
AgNO3 + KBr → AgBr↓ + KNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[AgBr]∙ nAg+∙ (n-x)NO3-}x+ ∙ xNO3- - мицеллярная формула

 агрегат
агрегат
ядро
 гранула
гранула
Гранула имеет положительный заряд, и будет двигаться к катоду.
-
Ba(Cl)2 + Na2SO4 → BaSO4↓ + 2NaCl


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[BaSO4]∙nSO42-∙2(n-x)Na+}2x-∙2xNa+ - мицеллярная формула

 агрегат
агрегат
ядро
 гранула
гранула
Золь BaSO4, содержит отрицательно заряженные гранулы, потенциалопределяющими в данном случае являются ионы nSO42-, а значит в избытоке Na2SO4,
-
AgNO3 + KBr → AgBr↓ + KNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[AgBr]∙ nAg+∙ (n-x)NO3-}x+ ∙ xNO3- - мицеллярная формула

 агрегат
агрегат
ядро
 гранула
гранула
υ(KBr) = C∙V=0,1∙0,008= 8∙10-4 моль
υ(AgNO3) = C∙V=0,1∙0,009= 9∙10-4 моль
AgNO3 в избытке, гранула имеет положительный заряд, и будет двигаться к катоду.
-
AgNO3 + NaJ AgJ↓ + NaNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[AgJ]∙ nJ-∙ (n-x)K+}x- ∙ xK+ - мицеллярная формула
 агрегат
агрегат
 ядро
ядро
 гранула
гранула
υ(KJ) = C∙V= 1,8∙10-4 моль
υ(AgNO3) = C∙V= 1,6∙10-4 моль
KJ в избытке, гранула имеет отрицательный заряд, и будет двигаться к аноду.
-
3Ba(Cl)2 + 2K3PO4 → Ba3(PO4)2↓ + 6KCl


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[Ba3(PO4)2]∙3nBa2+∙6(n-x)Cl-}2x+∙6xCl- - мицеллярная формула
 агрегат
агрегат
 ядро
ядро
 гранула
гранула
Коагулирующая способность электролита сильно возрастает с валентностью иона-коагулятора: ионы высшей валентности имеют порог коагуляции значительно меньше, чем ионы меньшей валентности (согласно правилу Щульце-Гарди), т.е. в нашем случае KJ<CuCl2<Na3PO4
-
ZnBr2 + Na2CO3 → ZnCO3↓ + 2NaBr


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[ZnCO3]∙nZn2+∙2(n-x)Br-}2x+∙2xBr- - мицеллярная формула
 агрегат
агрегат
 ядро
ядро
 гранула
гранула
Для ионов одинаковой валентности коагулирующая способность возрастает с увеличением радиуса иона (или с уменьшением радиуса гидратированного иона). Например, катионы щелочных металлов по коагулирующей способности можно расположить в обычный лиотропный ряд: Cs+ > Rb+ >NH4> K+ > Na+ > Li+, т.е. в нашем случае это NH4Br
-
Na2S + Pb(NO3)2 → PbS2↓ + 2NaNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[PbS]∙nS2-∙2(n-x)Na+}2x-∙2xNa+ - мицеллярная формула
 агрегат
агрегат
 ядро
ядро
 гранула
гранула
Коагулирующая способность электролита сильно возрастает с валентностью иона-коагулятора: ионы высшей валентности имеют порог коагуляции значительно меньше, чем ионы меньшей валентности (согласно правилу Щульце-Гарди), т.е. в нашем случае KJ<CuCl2<Na3PO4
-
Ca(Cl)2 + Na2SO4 → CaSO4↓ + 2NaCl


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[CaSO4]∙nSO42-∙2(n-x)Na+}2x-∙2xNa+ - мицеллярная формула

 агрегат
агрегат
ядро
 гранула
гранула
Коагулирующая способность электролита сильно возрастает с валентностью иона-коагулятора: ионы высшей валентности имеют порог коагуляции значительно меньше, чем ионы меньшей валентности (согласно правилу Щульце-Гарди); Для ионов одинаковой валентности коагулирующая способность возрастает с увеличением радиуса иона (или с уменьшением радиуса гидратированного иона). Например, катионы щелочных металлов по коагулирующей способности можно расположить в обычный лиотропный ряд: Cs+ > Rb+ >NH4> K+ > Na+ > Li+, т.е. в нашем случае CuCl2
!!! Уточнить в задании, может быть не CaCl2 a BaCl2, т.к. CaSO4 – растворимая соль!!!!
-
Na2S + CuSO4 → Na2SO4 + CuS↓


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[CuS]∙nCu2+∙(n-x)SO42-}2x+∙SO42- - мицеллярная формула

 агрегат
агрегат
ядро
 гранула
гранула
Для ионов одинаковой валентности коагулирующая способность возрастает с увеличением радиуса иона (или с уменьшением радиуса гидратированного иона). Например, катионы щелочных металлов по коагулирующей способности можно расположить в обычный лиотропный ряд: Cs+ > Rb+ >NH4> K+ > Na+ > Li+, т.е. в нашем случае это NH4Br
-
AgNO3 + KCl AgCl↓ + KNO3


Адсорбционный слой противоионов
Диффузный слой противоионов
{m[AgCl]∙ nCl-∙ (n-x)K+}x- ∙ xK+ - мицеллярная формула
 агрегат
агрегат
 ядро
ядро
 гранула
гранула
KCl в избытке, гранула имеет отрицательный заряд, и будет двигаться к аноду.
Свойства коллоидных растворов

Дано: Решение
Vзоля = 50∙10-3л KCl ↔ K+ + Cl- ; [KCl] = [ Cl-] = [K+] = 0,1 моль/л Vел-та(KCl) = 5∙10-3л
 [KCl]
= 0,1 моль/л
[KCl]
= 0,1 моль/л 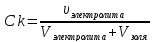 ;
;
Ck
-
? Vk
- ?

Коагулирующая способность (Vk) – величина, обратная порогу коагуляции, т.е Vk = 1/ Ck =111л/моль

Дано: Решение
Vзоля(+) = 50∙10-3л K2SO4 ↔ 2K+ + SO42- ;
Vел-та(K2SO4) = 25∙10-3л [K2SO4] = [SO42-] = 0,01 моль/л
 [K2SO4]
= 0,01 моль/л
[K2SO4]
= 0,01 моль/л 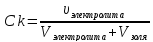
Ck
-
? 
Коагулирующей часть электролита является тот ион, который несет заряд противоположный по знаку коллоидной частицы золя, т.е. в нашем случае SO42-.

Дано: Решение
Vзоля(+)(Al(OH)3) = 10∙10-3л K2SO4 ↔ 2K+ + SO42- ;
Vел-та(K2SO4) = 1,2∙10-3л [K2SO4] = [SO42-] = 0,01 моль/л
 [K2SO4]
= 0,01 моль/л
[K2SO4]
= 0,01 моль/л
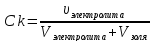
Ck
-
?
 Коагулирующая
способность электролита сильно возрастает
с валентностью иона-коагулятора: ионы
высшей валентности имеют порог коагуляции
значительно меньше, чем ионы меньшей
валентности (согласно правилу
Щульце-Гарди),
т.е. в нашем случае KJ<CuCl2<Na3PO4
Коагулирующая
способность электролита сильно возрастает
с валентностью иона-коагулятора: ионы
высшей валентности имеют порог коагуляции
значительно меньше, чем ионы меньшей
валентности (согласно правилу
Щульце-Гарди),
т.е. в нашем случае KJ<CuCl2<Na3PO4
Дано: Решение
Vзоля(+)(AgJ) = 80∙10-3л CaCl2 ↔ Ca2+ + 2Cl- ;
Vел-та(CaCl2) = 10∙10-3л [Cl-] = 2[CaCl2] = 0,1 моль/л
 [CaCl2]
= 0,05 моль/л
[CaCl2]
= 0,05 моль/л 
Ck
-
?
 Коагулирующей
часть электролита является тот ион,
который несет заряд противоположный
по знаку коллоидной частицы золя, т.е.
в нашем случае Cl-
Коагулирующей
часть электролита является тот ион,
который несет заряд противоположный
по знаку коллоидной частицы золя, т.е.
в нашем случае Cl-

Дано: Решение
Vзоля(-)(CaCO3) = 55∙10-3л Mg(NO3)2 ↔ Mg 2+ + 2 NO3- ;
Vел-та(Mg(NO3)2) = 10∙10-3л [ Mg(NO3)2] = [Mg 2+ ]= 0,01 моль/л
 [
Mg(NO3)2]
= 0,01 моль/л
[
Mg(NO3)2]
= 0,01 моль/л

Ck
-
?
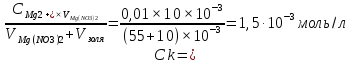
Коагулирующей часть электролита является тот ион, который несет заряд противоположный по знаку коллоидной частицы золя, т.е. в нашем случае Mg 2+
Дано: Решение
Vзоля(+)
(CaCO3)=
20∙10-3л 
Vел-та=
1,5∙10-3л
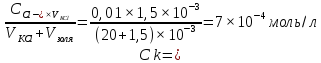
 [ел-та]
= 0,01 моль/л
[ел-та]
= 0,01 моль/л
Ck - ?
Коагулирующая способность электролита сильно возрастает с валентностью иона-коагулятора: ионы высшей валентности имеют порог коагуляции значительно меньше, чем ионы меньшей валентности (согласно правилу Щульце-Гарди), т.е. в нашем случае KJ<CuCl2<Na3PO4
 Дано: Решение
Дано: Решение
Vзоля
=60∙10-3л 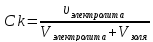
Vел-та(NH4Cl)=
1,5∙10-3л
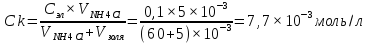
 [
NH4Cl]
= 0,01 моль/л
[
NH4Cl]
= 0,01 моль/л
Ck - ? Vk - ?
Коагулирующая способность (Vk) – величина, обратная порогу коагуляции, т.е Vk = 1/ Ck =130 л/моль
Дано: Решение
Vзоля(+)= 50∙10-3л Na2SO4 ↔ 2Na+ + SO42- ;
Vел-та(Na2SO4) = 3∙10-3л [Na2SO4] = [SO42-] = 0,05 моль/л
 [Na2SO4]
= 0,05 моль/л
[Na2SO4]
= 0,05 моль/л
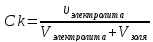
Ck
-
?

Коагулирующей часть электролита является тот ион, который несет заряд противоположный по знаку коллоидной частицы золя, т.е. в нашем случае SO42-.
