
Коноплева 2013
.pdf•реакция Лафона: к водному извлечению прибавляют конц.
H2SO4 и этиловый спирт (в равных объемах), затем прибавляют каплю раствора сернокислого железа. При нагревании появляется синезеленое окрашивание;
•реакция с серной кислотой: к извлечению прибавляют равный объем хлороформа и 6-8 капель концентрированной серной кислоты. Наблюдают окрашивание нижнего хлороформного слоя в жел-
тый цвет.
• стероидные сапонины можно отличить от тритерпеновых по реакции Санье: с 1% раствором сурьмы трёххлористой, кислотой конц. серной, содержащей уксусный ангидрид, образуется жёлтое окрашивание.
3. Реакция, основанная на биологических свойствах
Реакция гемолиза эритроцитов:
Для проведения этой реакции используют эритроциты крови разных животных. Присутствие холестерина в плазме крови может задерживать гемолиз, поэтому кровь необходимо дефибринировать. Концентрация водородных ионов среды оказывает существенное влияние на гемолиз. Учитывая это, готовят: 1% извлечение из ЛРС и 2% взвесь эритроцитов на физиологическом растворе (или на буферной смеси фосфатов с pH=7,4). Смешивают равные объемы извлечения из ЛРС и взвеси эритроцитов, через некоторое время кровь становится прозрачной, ярко-красной (произошел гемолиз).
4. Хроматография
Для хроматографического разделения применяют различные системы растворителей: н-бутанол, кислоту уксусную, хлороформ, метанол, водный аммиак, н-пропиловый спирт и другие в различных соотношениях.
Для обнаружения сапонинов в ЛРС широко используют тонкослойную хроматографию на силикагеле в системе растворителей ХЛОРОФОРМ-МЕТАНОЛ-ВОДА (65:35:10). Для обнаружения зон сорбции сапонинов на хроматограммах используют следующие реактивы:
•пары йода - бурые пятна на желтом фоне;
•насыщенный раствор треххлористой сурьмы в хлороформе
споследующим нагреванием при 90-100°С - розово-фиолетовые пятна;
•спиртовый раствор фосфорно-молибденовой кислоты - синие пятна на желтом или желто-зеленом фоне (окраска фона снимается парами аммиака);
123
•спиртовым раствором кремне-вольфрамовой кислоты с
последующим нагреванием при 100-120°С - розовые, оранжевые, красные, фиолетовые, серые и др. пятна на бесцветном фоне;
•реактив Санье (5% спиртовый раствор ванилина) с нагреванием при 110°С и последующей обработкой 50% водным раствором серной кислоты - спиростаноловые сапонины проявляются в виде желтых пятен, фуростаноловые - зеленых;
•реактив Эрлиха (спиртовый раствор п- диметиламинобензальдегида с добавлением концентрированной HCl) - фуростаноловые сапонины проявляются в виде пятен розового или красного цвета;
•для обнаружения тритерпеновых сапонинов хроматограмму обрабатывают 20% раствором серной кислоты, нагревают в сушильном шкафу при температуре 115-120°С в течение 15 мин - появляются фиолетовые пятна.
КОЛИЧЕСТВЕННОЕОПРЕДЕЛЕНИЕСАПОНИНОВВЛРС
Долгое время основными методами определения тритерпеновых сапонинов в ЛРС являлось определение гемолитического индекса, пенного числа и токсичности для холоднокровных животных.
Результаты этих методов нельзя сравнить, т.к. пенообразование и гемолитические свойства не коррелируют друг с другом. Они не дают представления о процентном содержании сапонинов в сырье и в настоящее время не используются.
Использовавшиеся гравиметрические методы, основанные на образовании их комплексов с гидроксидом бария, солями меди, свинца, холестерином, а также осаждении малополярными растворителями, дают завышенные результаты и малоспецифичны.
В настоящее время используют физико-химические методы. Они основаны на сочетании хроматографического разделения сапонинов с последующим количественным определением их.
1. Спектрофотометрические методы.
•Солодка голая - метод основан на осаждении глицирризиновой кислоты из ацетонового извлечения 25% раствором аммиака с последующим спектрометрическим определением.
•Диоскорея ниппонская - сапонины экстрагируют этанолом, к порции экстракта прибавляют реактив Эрлиха (1% раствор п- диметиламинобензальдегида в 4 н спиртовом растворе HCI), выдерживают 2 часа при 58°С, охлаждают, измеряют оптическую плотность окрашенного раствора на спектрофотометре.
2. Титриметрические (потенциометрическое титрование - аралия маньчжурская).
124
3.Флуориметрические. Стероидные сапонины при проявлении парами ортофосфорной кислоты ТСХ дают розовые пятна и интенсивную флуоресценцию в УФ-свете, что используется для количественного определения.
4.Диосгенин в корневищах с корнями диоскореи дельтовидной определяют методом газовой хроматографии.
ЗАГОТОВКА, СУШКА И ХРАНЕНИЕ ЛРС
Заготовку подземных органов производят осенью, преимущественно после созревания плодов или ранней весной.
Солодку заготавливают с марта по ноябрь в зависимости от района заготовок.
Выкопанное сырье отделяют от надземных стеблей, очищают от земли, рубят на куски, иногда подвяливают и сушат. Таким образом, получается неочищенный корень солодки. Для медицинских целей наиболее ровные и достаточно толстые куски свежих или слегка подвяленных корней и корневищ очищают от пробки ножами или специальными машинами (получается очищенный корень солодки).
Собирают вполне зрелые осыпавшиеся плоды каштана конского. Семена освобождают от околоплодника и сушат. Листья каштана собирают в течение лета вручную и сушат.
Траву астрагала шерстистоцветкового срезают серпами или ножами в фазу массового цветения до образования плодов. Срывать траву нельзя, так как при этом повреждаются почки возобновления и растение гибнет.
Заготовку травы якорцев проводят в период цветения и плодоношения (июнь-сентябрь). Растение выдергивают с корнями или отрубают надземную часть близ поверхности почвы. Заготовку травы необходимо проводить в рукавицах, так как колючие плоды растения легко травмируют кожу рук.
Сушат сырье в сушилках или в хорошо проветриваемых помещениях, а в хорошую погоду – на открытом воздухе. Например, сырье солодки, диоскореи и семена каштана конского сушат при температуре не выше 50°С; траву астрагала шерстистоцветкового – не выше 55°С; листья каштана и корни аралии – не выше 50-60 °С.
Хранение ЛРС, содержащее сапонины, проводится по общим правилам для гликозидсодержащего сырья (в сухих, хорошо проветриваемых помещениях).
125
ПРИМЕНЕНИЕ САПОНИНОВ В МЕДИЦИНЕ
Сапонины обладают широким спектром фармакологического действия, высокой токсичностью для холоднокровных животных. При попадании в кровь они вызывают гемолиз и паралич ЦНС, прежде всего дыхательного центра.
Все лекарственные средства, содержащие сапонины, применяются перорально, т.к. после гидролиза в ЖКТ до агликонов сапонины теряют гемолитическую активность. При приеме внутрь в больших дозах сапонины могут вызвать тошноту, рвоту, расстройство ЖКТ, головокружение.
Стероидные сапонины обладают антисклеротическим действием. Например, Полиспонин (из диоскореи ниппонской).
Стероидные сапонины (диосгенин) используются для синтеза гормональных препаратов - прогестерона, кортизона.
Тритерпеновые сапонины применяют как стимулирующие, тонизирующие и адаптогенные средства (настойки:
женьшеня, аралии, заманихи; Сапарал (из аралии).
Они усиливают секрецию бронхиальных желез,
разжижают мокроту, применяются как отхаркивающие средства (синюха, солодка - Глицирам).
Сапонины оказывают седативное действие (синюха).
Противовоспалительное, регулирующее водно-солевой обмен, антиаллергическое действие проявляют сапонины солодки.
Сапонины астрагала шерстистоцветкового обладают гипо-
тензивным действием.
Лекарственные средства конского каштана (Эскузан, Эсфлазид, Анавенол, Веноплант) обладают капилляроукрепляющим, венотонизирующим действием. Их применяют при варикозном расширении вен, при поверхностных флебитах.
Сапонины способствуют лучшему всасыванию других ве-
ществ.
Эмульгирующие свойства сапонинов широко используются для приготовления эмульсий, суспензий.
Благодаря пенообразующим свойствам сапонины используют
впищевой промышленности при приготовлении халвы, кондитерских изделий и шипучих напитков.
ФИТОЭКДИЗОНЫ
Экдизоны (Экдистероиды, Фитоэкдизоны) – это природные полигидроксистероидные соединения, обладающие активностью гормонов линьки насекомых и метаморфоза членистоногих.
126
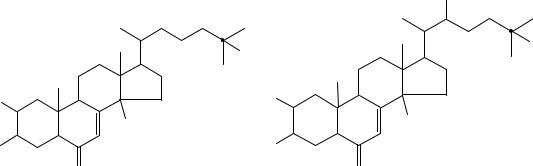
Впервые эти соединения были обнаружены у насекомых и ракообразных. Метаморфоз насекомых контролируется несколькими гормонами, вырабатываемыми специальными железами: α-экдизоном, β-экдизоном (экдистерон).
В основе строения экдизонов лежит циклопентанпергидрофенантрен, где в положении 17 присоединяется алифатическая цепочка из 8 углеродных атомов. Структурными особенностями, общими для всех гормонов линьки, являются ∆7-6- кетогруппа и 14αгидроксильная группа. Число и положение других гидроксильных групп различны.
OH
Î |
Í |
OH |
|
|
|
|
|
|
|
|
|
OH
Î Í
HO |
HO |
|
|
OH |
OH |
HO |
HO |
O |
O |
α-ЭКДИЗОН |
β-ЭКДИЗОН |
|
(ЭКДИСТЕРОН) |
Экдизоны подразделяются на зооэкдизоны (выделены из животных) и фитоэкдизоны (выделены из растений).
Врастениях впервые экдизоны были обнаружены японскими учеными в 1966 г. Из Podocarpus nakaii были выделены понастероны А, В,С; из Podocarpus macrophylla – макистероны А, В, С и D. Кроме покрыто - и голосеменных экдизоны найдены в папоротникообразных.
Внастоящее время известно более 150 соединений этой группы.
Врастительном мире они найдены более чем в 80 семействах:
Амарантовые |
(Amarantaceae), |
Гвоздичные |
(Cariophyllaceae), |
Астровые |
(Asteraceae), |
Мареновые |
(Chenopodiaceae), |
Яснотковые |
(Lamiaceae), |
Лютиковые |
(Ranunculaсeae) и др. |
Накапливаются они во всех органах растений. Содержание их колеблется от 0,01 до 2%. Например, в серпухе сухоцветной (Serratula xeranthemoides Bieb.) экдизонов накапливается до 2%
Экдизоны – это бесцветные кристаллические вещества без запаха, обладающие гидрофильными свойствами: легко растворимы в низших спиртах (этанол, метанол), ацетоне, этилацетате, при нагрева-
127
нии – в воде, плохо – в хлороформе, но нерастворимы в петролейном эфире, бензоле (за исключением сложных эфиров). Оптически активны.
Для экстракции экдистероидов лучше использовать ацетон или метанол. Очистку проводят с помощью хроматографии на оксиде алюминия или силикагеле
МЕТОДЫ ОБНАРУЖЕНИЯ ФИТОЭКДИЗОНОВ В ЛРС
Для обнаружения экдизонов используют их физико-химические свойства и специфические биологические тесты, основанные на окукливании специально препарированных личинок при введении им экстракта растения.
Для выяснения наличия в растениях гормонов линьки существуют биотесты, которые проводят на различных насекомых, главным образом, на мухах-дрозофилах. При этом активность различных экдизонов у различных насекомых неодинакова, поэтому биотесты не коррелируют между собой. Следует также учитывать возможность наличия в растительных экстрактах соединений, с антиэкдизонным действием, к числу которых относится, например, аюгалактон.
Поэтому химические цветные реакции являются более показательными для определения фитоэкдистероидов
Наличие стероидного цикла обнаруживают реакцией Либер- мана-Бурхарда: сухой остаток какого-либо экдистероида растворяют в ледяной уксусной кислоте, прибавляют смесь уксусного ангидрида с рконцентрированной серной кислотой (50:1), появляется розовая окраска, переходящая в зеленую или синюю.
Значительно более чувствительной является реакция Чугаева (безводный хлорид цинка в уксусной кислоте и ацетилхлорид), дающая со стероидами, способными к дегидратации, окрашенные комплексы.
Экдистероиды содержат кетогруппу, сопряженную с двойной связью; наличие ∆7-6-кето-14-гидроксигруппировки в молекуле проявляется в том, что эти соединения не подвергаются каталитическому гидрированию даже в жестких условиях. При нагревании экдистероидов в метанольном или этанольном растворе в присутствии HCl вначале из-за дегидратации с участием 14-гидроксигруппы образуется дважды ненасыщенный кетон с λmax=292-298 нм, который вследствие стерической напряженности кольца В постепенно изомеризуется в несопряженный диенон с λmax=240-248 нм:
128
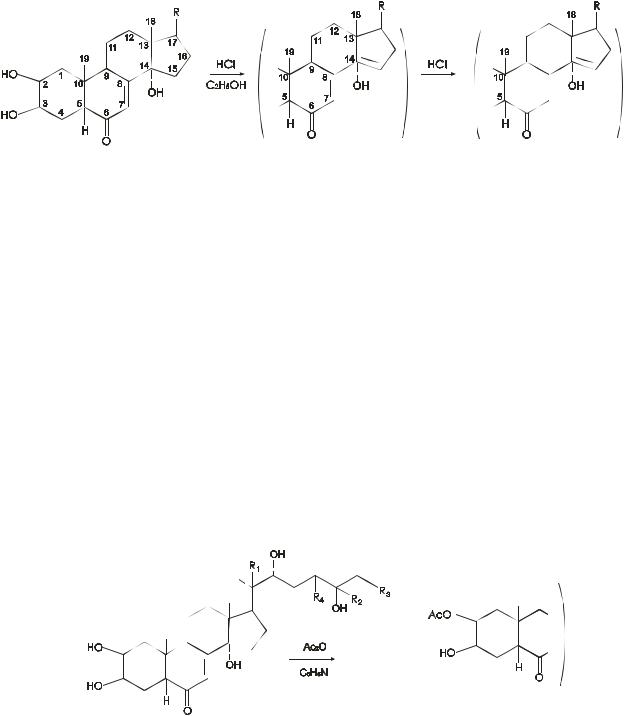
Указанная реакция, устанавливающая наличие в молекуле ∆7-6- кето-14-гидроксигруппировки, является общей для всех экдистероидов, поэтому ее проведение является важным компонентом для их обнаружения
Кетогруппа подтверждается также стандартной реакцией этанольного раствора вещества с 2,4-динитрофенилгидразином по выпадению красно-бурого осадка.
Для выявления вицинальной диольной группировки можно использовать перйодатное окисление экдистероида. При этом в нейтральном водном растворе на холоде расходуется приблизительно 1М/экв., а при 80-90 ОС – 2М/экв. перйодата. Например, в случае экдистерона для окисления расходуется два моля перйодата натрия, при этом ращепляются две диольные группировки (2β, 3β и 20β, 22α).
Вследствие присутствия спиртовых гидроксилов экдизоны способны образовывать ацетаты: ацетилирование экдистерона в мягких условиях (0 ОС) дает 55% 2-моноацетата, а в более жестких – 2, 3, 22, 25-тетраацетат:
129
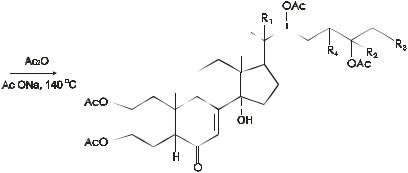
Наличие двух вицинальных диольных группировок подтверждается образованием 2, 3, 20 и 22-диацетонида при нагревании экдистероидов с ацетоном в присутствии фосфорно-молибденовой кислоты.
Количественное определение экдизонов проводят спектрофотометрическим методом после их предварительного разделения в тонком слое силикагеля.
Одним из таких методов является метод, основанный на реакции Чугаева, в результате которой образуются окрашенные продукты. Используют также прямое спектрометрическое определение при длине волны 242 нм.
Содержание 20-гидроксиэкдизона в корневищах с корнями левзеи сафлоровидной определяют хроматоспектрофотометрическим методом (ГФ РБ, Т.2, с.368).
Экстракция суммы экдизонов проводится метанолом в аппарате Сокслета в течение 7 часов. Извлечение упаривают в вакууме при температуре 400С до 5 мл, которое количественно переносят в мерную колбу и доводят объём до 25 мл метанолом (испытуемый раствор).
В качестве раствора сравнения служит раствор 20гидроксиэкдизона в метаноле.
Разделение суммы экдизонов проводят с помощью ТСХ.
ТСХ пластинку с закреплённым слоем силикагеля делят на 5 равных полос. На линию старта первой и второй полос наносят испытуемый раствор, на третьей и четвёртой – раствор сравнения, пятая полоса используется для приготовления компенсационного раствора. Пластинку с нанесёнными пробами помещают в камеру со смесью растворителей ХЛОРОФОРМ-МЕТАНОЛ-АЦЕТОН (6:2:1). После разделения первую и третью полосы пластинки опрыскивают раствором ванилина в серной кислоте. На второй и четвёртой полосах отмечают зоны 20-гидроксиэкдизона, расположенные на уровне проявленных зон на первой и третьей полосах.
Слои сорбента с отмеченных зон на второй и четвёртой полосах переносят в две колбы вместимостью 100 мл, прибавляют по 15 мл метанола, закрывают пробкой и встряхивают в течение 4 ч, фильтруют.
130
Измеряют оптическую плотность элюатов испытуемого раствора и раствора сравнения при 242 нм, используя элюат с пятой полосы в качестве компенсационного раствора.
Далее проводят расчёт результатов.
Определение содержания 20-гидроксиэкдизона в листьях левзеи сафлоровидной проводят ВЭЖХ (ГФ РБ, Т.2, с.369).
Экдизоны можно определить флуориметрическим методом
после обработки смесью серной кислоты и 95 %-ого этанола в соотношении (3:1) (по объему). При этом возникает относительно устойчивая флуоресценция, но ее можно использовать для количественного анализа экстрактов только после ТСХ-разделения и элюирования пятен.
ЗАГОТОВКА, СУШКА И ХРАНЕНИЕ ЛРС
Заготовку корневищ с корнями левзеи проводят в августе – сентябре, после созревания плодов. Выкапывают лопатами или кирками, обрезая у самой земли надземную часть, отряхивают от земли и быстро промывают проточной водой. Сушат на солнце, на воздухе в тени, в хорошо проветриваемых помещениях или в сушилках при температуре 50 – 60 °С.
Корневища с корнями хранят в сухих, хорошо проветриваемых помещениях.
ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ.
Экдизоны оказывают выраженное психостимулирующее и адаптогенное действие. Кроме того, они усиливают процессы белкового синтеза в организме, и могут быть использованы как анаболические средства.
Противоположным экдизонам действием, ингибирующим линьку насекомых, обладает стероидный лактон, выделенный из растения сем. Яснотковых – живучки лежачей (Ajuqa decumbens D. Don) и получивший название аюголактона.
131

Таблица 9 Химический состав, фармакологическая активность
и использование ЛРС, содержащего сапонины и фитоэкдизоны
Наименование |
Биологиче- |
Лекарствен- |
Фармаколо- |
растительного |
ски актив- |
ные средства |
гическое |
сырья, растений |
ные вещества |
|
действие |
и семейства |
|
|
|
Пентациклические тритерпеновые сапонины, производные олеанана
Солодки корни – |
Глицирризин, |
Отвар, сухой |
Отхаркива- |
Glycyrrhizae radices, |
глицирризи- |
и густой экс- |
ющее, проти- |
Солодка голая |
новая, глиц- |
траты, сироп, |
вовоспали- |
(Лакрица) – |
ирретиновая, |
эликсир груд- |
тельное, |
Glycyrrhiza glabraL., |
ураленоглю- |
ной, |
бронхолити- |
Солодка уральская – |
куроновая |
Глицирам, |
ческое, проти- |
Glycyrrhiza |
к-ты; флаво- |
Глидеринин, |
воязвенное, |
uralensis Fisch., |
ноиды, поли- |
Ликвиритон, |
антиаллерги- |
Бобовые - |
сахариды |
Флакарбин, |
ческое, имму- |
Fabaceae |
|
Халкорин, |
номодулирую- |
|
|
Тримунал , |
щее, регули- |
|
|
Амтерсол, |
рующее вод- |
|
|
Коделак фито, |
но-солевой |
|
|
Линкас лор, |
обмен |
|
|
Простанорм, |
|
|
|
Урофлукс, |
|
|
|
Фосфоглив, |
|
|
|
Холафлукс, |
|
|
|
микстура су- |
|
|
|
хая от кашля, |
|
|
|
сироп от каш- |
|
|
|
ля с синюхой |
|
|
|
и солодкой |
|
Конского каштана |
Эсцин (смесь |
Эскузан, |
Венотонизи- |
семена– |
эсцина и кри- |
Эсфлазид, |
рующее, ка- |
Hippocastani |
птоэсцина), |
Эссавен, |
пилляро- |
semina, |
кумарины: эс- |
Анавенол, |
укрепляющее, |
Конского каштана |
кулин, эскуле- |
Венитан, |
тромболити- |
листья – |
тин, фраксин; |
Веноплант, |
ческое, проти- |
Hippocastani folia, |
флавоноиды |
Репарил, |
вовоспали- |
Конский каштан |
(биозиды и |
Аэсцин, |
тельное, анти- |
обыкновенный – |
триозиды |
Веносал гель, |
геморродаль- |
Aesculus |
кемпферола и |
Венозан |
ное |
|
132 |
|
|
